牛坏死杆菌43K OMP 单克隆抗体的制备及鉴定
2021-01-19贺显晶张思瑶蒋剑成王丽娜肖佳薇汪锋锋孙东波郭东华
贺显晶,张思瑶,蒋剑成,王丽娜,肖佳薇,汪锋锋,孙东波,郭东华
黑龙江八一农垦大学动物科技学院,黑龙江大庆163319
坏死杆菌(Fusobacterium necrophorum)是革兰阴性、无鞭毛和芽胞的严格厌氧性细菌,广泛存在于人和动物的呼吸道、消化道和泌尿道黏膜,作为一种机会主义病原,能引起人和动物多种坏死性化脓性疾病。坏死杆菌可引起牛肝脓肿、腐蹄病和坏死性喉炎,目前已成为临床子宫内膜炎和乳房炎的特征菌属,给畜牧业带来了严重的经济损失。
牛坏死杆菌侵入动物机体后,主要通过毒力因子完成其对动物的感染以及介导机体损伤,其中主要的致病因子包括:白细胞毒素、溶血素、内毒素脂多糖、血凝素、黏附素、血小板凝集因子、皮肤坏死毒素和一些胞外酶[1]。近10 年来,有关坏死杆菌致病机理的研究多集中在白细胞毒素、溶血素、内毒素等毒力因子[2-7]。外膜蛋白(outer membrane protein,OMP)作为一种革兰阴性杆菌细胞壁特有的蛋白质,在维持细菌细胞膜完整性、诱导细菌产生耐药性、调节细菌生物被膜形成、促进细菌黏附和侵袭能力、物质运输及介导机体免疫反应等方面,发挥重要作用[8]。因此,深入了解OMP 功能为探究革兰阴性致病菌致病机制奠定了基础。2013 年,本实验室首次鉴定了牛坏死杆菌43K OMP,并在后续试验中发现其能激发出特异性的体液免疫和细胞免疫,其将有望成为坏死杆菌病亚单位疫苗的候选抗原。本文经原核表达系统表达并纯化牛坏死杆菌43K OMP,制备单克隆抗体,为深入研究牛坏死杆菌致病机制及其有效防治措施奠定基础。
1 材料与方法
1.1 细胞、质粒及菌株 小鼠骨髓瘤细胞(SP2 / 0 细胞)、BHK-21 细胞、pET-32a(+)载体、pCAGGS-HA 质粒及E.coli BL21(DE3)感受态细胞由本院分子病理学实验室保存;坏死杆菌A25 标准菌株购自美国ATCC(Fusobacterium necrophorum,Fnn 亚种,ATCC 25286)。
1.2 实验动物 8 只雌性 SPF 级 BALB / c 小鼠,6 ~8 周龄,体重(20 ± 1)g 由哈尔滨医科大学提供,动物许可证号:SCXK(吉)-2018-0007。
1.3 主要试剂 HRP 标记的山羊抗鼠IgG(IgGHRP)、FITC 标记的山羊抗鼠 IgG、Ni-NTA Agarous Kit 试剂盒购自北京中杉金桥生物技术有限公司;胎牛血清、DMEM 培养液、青链霉素混合液、EDTA-胰酶购自美国GIBCO 公司;SDS-PAGE 凝胶制备试剂盒购自北京索莱宝科技有限公司;SBA ClonotypingTMSystem / HRP 抗体亚类鉴定试剂盒购自美国Southern Biotech 公司;弗氏完全佐剂和不完全佐剂购自美国Sigma 公司;鼠阴性血清和阳性血清由本院分子病理学实验室保存并提供。
1.4 抗原制备 质粒构建由哈尔滨博仕生物技术有限公司完成:根据GenBank 中登录的牛坏死杆菌H05菌株43K OMP 核苷酸序列(JQ740821.1)设计特异性引物,优化后在5′末端和3′末端分别加入BamHⅠ和XhoⅠ酶切位点,合成牛坏死杆菌H05 菌株43K OMP 核苷酸序列,连接 pET-32a(+)载体,构建质粒 pET-32a(+)/43K OMP。将质粒 pET-32a(+)/43K OMP 转化 E.coli BL21(DE3),加入 IPTG 至终浓度为 1 mmol/L,16 ℃,160 r/min 振荡培养 16 h;收集菌液沉淀,7 000 × g 离心10 min;超微破碎后,7 000 × g离心25 min;收集沉淀,用Ni-NTA Agarous Kit 纯化重组蛋白,取样进行10%SDS-PAGE 分析。
1.5 动物免疫 将纯化的重组43K OMP 与弗氏完全佐剂按1 ∶1 比例乳化后,腹部皮下注射BALB / c小鼠,50 μg / 只,共免疫 3 次,每次间隔 2 周,2 免和3 免使用弗氏不完全佐剂与43K OMP 混合后免疫,免疫部位及剂量同初免。3 免后7 d,尾静脉采血,分离血清,检测血清效价。于融合前3 d 进行加强免疫,每只 100 μg 重组43K OMP,3 d 后进行细胞融合。
1.6 间接ELISA 检测方法的建立 将重组43K OMP 用包被液倍比稀释(稀释比例为 1 ∶100、1 ∶200、1 ∶400、1 ∶800、1 ∶1 600、1 ∶3 200、1 ∶6 400 和 1 ∶12 800),混匀后加至 96 孔板中,37 ℃孵育 2 h;PBST 洗涤 3 次,加入 5%脱脂乳 37 ℃封闭 1 h;PBST 洗涤3 次,加入小鼠阴性血清、阳性血清(稀释比例为 1 ∶100、1 ∶200、1 ∶400、1 ∶800、1 ∶1 600 和1 ∶3 200),37 ℃孵育 1 h,同时设空白对照;PBST 洗涤 3 次,加入 HRP 标记的山羊抗鼠 IgG(1 ∶5 000 稀释),37 ℃孵育 1 h;PBST 洗涤 3 次,加入 TMB 底物显色液 100 μL,37 ℃避光作用 10 ~ 15 min;加入2 mol / L H2SO4100 μL,终止显色,酶标仪读取 A450值。以阳性血清A450值在1.0 以上(包括1.0),阴性血清 A450值在 0.2 以下,P / N(阳性 / 阴性)值最大为判定标准,筛选最佳抗原包被量和血清稀释度。
1.7 单克隆抗体的制备 无菌取小鼠脾细胞,与对数生长期的SP2/0 细胞进行细胞融合。以纯化的43K OMP 为抗原,间接ELISA 法进行筛选,将得到的阳性细胞株经3 次克隆纯化后,获得稳定杂交瘤细胞株。将BALB / c 小鼠腹腔无菌注射液体石蜡致敏,1 周后经腹腔注射杂交瘤细胞株,5 × 106个 / 只,待小鼠出现腹部隆起后采集腹水。
1.8 单克隆抗体的鉴定
1.8.1 抗体效价及亚类 用已建立的间接ELISA方法检测杂交瘤细胞株的细胞培养上清及腹水的抗体效价;通过抗体亚类鉴定试剂盒进行单克隆抗体亚类的鉴定。
1.8.2 免疫原性 采用Western blot 法。将纯化的重组43K OMP 转印至PVDF 膜上,加入5%脱脂乳室温封闭3 h;用阳性杂交瘤细胞株上清作为一抗(1 ∶800 稀释),HRP 标记的山羊抗鼠 IgG 作为二抗(1 ∶1 000 稀释),进行 Western blot 分析。
1.8.3 特异性 采用间接免疫荧光试验。参照文献[9]构建重组质粒pCAGGS-43K OMP,并瞬时转染BHK-21 细胞,阴性对照为pCAGGS-HA 空质粒,37 ℃孵育 2 h;PBS 洗涤,4%多聚甲醛固定 30 min;PBS 洗涤,加入5%脱脂乳室温封闭1 h;加入单克隆抗体(1 ∶500 稀释),室温孵育 1 h;PBS 洗涤 3 次,加入 FITC 标记的山羊抗鼠 IgG(1 ∶800 稀释),室温避光孵育1 h;PBS 洗涤后,荧光显微镜下观察。
2 结 果
2.1 纯化的重组43K OMP 的鉴定 10%SDS-PAGE分析显示,纯化蛋白在相对分子质量约59 500 处可见特异性蛋白条带,大小与预期相符,见图1。
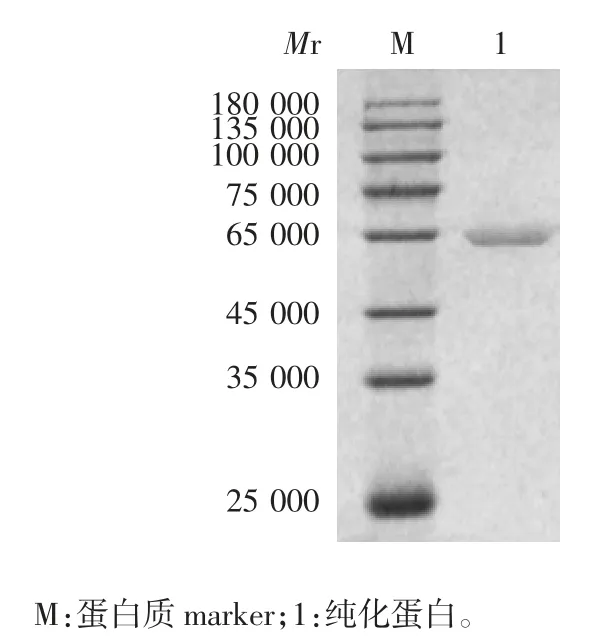
图1 纯化的重组43K OMP 的鉴定Fig.1 Identification of purified recombinant 43K OMP
2.2 间接ELISA 检测方法的建立 方法如下:将重组43K OMP 用包被液进行 1 ∶400 稀释,37 ℃孵育 2 h;5%脱脂乳37 ℃封闭1 h;一抗血清最佳稀释度为1 ∶200,37 ℃孵育 1 h;酶标二抗稀释度为 1 ∶5 000,37 ℃孵育 1 h;37 ℃避光显色 10 ~ 15 min。抗原包被量及血清稀释度优化结果见表1。
2.3 单克隆抗体的鉴定
2.3.1 效价 共获得3 株稳定表达抗43K OMP 的杂交瘤细胞株,选取其中效价最高的1 株命名为O43,其细胞上清和腹水效价分别为1 ∶25 600 和1 ∶105。
2.3.2 亚类 O43 株分泌的抗43K OMP 单克隆抗体的类型为IgG1,轻链为κ 链,见图2。

图2 单克隆抗体亚类鉴定结果Fig.2 Identification of subclass of McAb
2.3.3 免疫原性 Western blot 分析显示,抗43K OMP单克隆抗体可与纯化的重组43K OMP 发生特异性反应,在相对分质量约59 500 处可见特异性条带,大小与预期相符,见图3。
2.3.4 特异性 间接免疫荧光试验结果显示,抗43K OMP 单克隆抗体可与转染后瞬时表达在BHK-21 细胞的43K OMP 特异性结合,产生荧光反应,而阴性对照未见荧光,见图4,表明制备的单抗可识别瞬时表达在BHK-21 细胞的43K OMP。
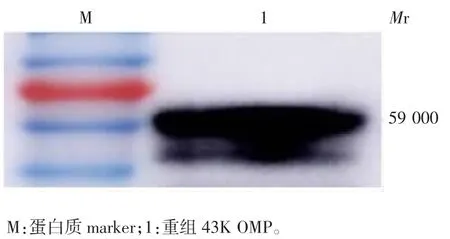
图 3 抗43K OMP 单克隆抗体的Western blot 鉴定Fig.3 Western blotting of McAb against 43K OMP

表1 最佳抗原包被量及血清最佳稀释度(A450)Tab.1 Optimization of antigen concentration for coating and dilution of serum(A450)

图4 间接免疫荧光试验鉴定单克隆抗体特异性Fig.4 IFA of specificity of McAb
3 讨 论
本实验室首次在牛坏死杆菌中鉴定了一个43kD的OMP(43K OMP),且此蛋白在牛坏死杆菌不同分离株中广泛存在,具有高度保守性,其与同菌属的其他梭菌属成员的外膜极性蛋白相似[10-11]。此后,KUMAR 等[12]也验证了牛坏死杆菌中 43K OMP 的存在。MENON 等[13]发现,43K OMP 作为坏死杆菌的一种黏附素,有助于宿主的黏附和定植。王志慧[14]发现,牛坏死杆菌43K OMP 可黏附BHK-21细胞、子宫内膜细胞和乳腺上皮细胞。因此,针对牛坏死杆菌43K OMP 功能的研究将有助于更好地了解牛坏死杆菌的致病机制。
本研究将 pET-32a(+)/ 43K OMP 质粒在 E.coli BL21(DE3)中经 IPTG 进行诱导表达,纯化后免疫BALB /c 小鼠,获得具有分泌抗43K OMP 的脾细胞,与杂交瘤细胞融合后,筛选出1 株稳定分泌抗牛坏死杆菌43K OMP 的单克隆抗体。杂交瘤细胞培养上清与腹水抗体效价分别为 1 ∶25 600 和 1 ∶105,单克隆抗体的重链为IgG1,轻链为κ 链。Western blot和间接免疫荧光试验结果显示,抗43K OMP 单克隆抗体可与重组43K OMP 发生特异性反应,在相对分子质量约59 500 处可见特异性条带,也可与瞬时表达43K OMP 的BHK-21 细胞发生荧光反应。证明获得的抗43K OMP 单克隆抗体具有良好的免疫原性和特异性。本实验制备的43K OMP 单克隆抗体为研究牛坏死杆菌43K OMP 的结构和功能提供了依据,也为深入研究牛坏死杆菌致病机制奠定了基础。
