胚胎干细胞对孕鼠缺血受损心肌的修复作用
2016-07-15王宏茂邱彬邓然王超雍伟东石琳
王宏茂,邱彬,邓然,王超,雍伟东,石琳*
(1.首都儿科研究所附属儿童医院,心血管内科,北京 100020;2.北京协和医学院&中国医学科院医学实验动物研究所,基因与发育实验室,北京 100021)
胚胎干细胞对孕鼠缺血受损心肌的修复作用
王宏茂1,邱彬2,邓然2,王超2,雍伟东2,石琳1*
(1.首都儿科研究所附属儿童医院,心血管内科,北京 100020;2.北京协和医学院&中国医学科院医学实验动物研究所,基因与发育实验室,北京 100021)
【摘要】目的 探讨胎鼠胚胎干细胞是否可通过血液循环系统进入怀孕母体,并对孕鼠缺血损伤的心肌组织进行修复。方法 将24只6~8周龄C57雌性小鼠随机分为假手术组(n=8)、手术+受孕组(n=8)和手术组+未受孕组(n=8),通过结扎冠状动脉左前降支的方法制作心肌梗死模型,并将手术后受孕组小鼠与e-GFP转基因雄鼠进行杂交。三组小鼠分别在术前、术后和孕产后进行心电图和超声心动检测,比较其心功能的变化;通过免疫组织化学染色,观察各组小鼠心肌结构的变化,并检测孕鼠心肌是否表达荧光蛋白,以确定是否存在胚胎来源的Gfp阳性细胞。同时通过普通半定量PCR扩增技术检测孕鼠血液DNA中是否存在Gfp基因。结果 手术+受孕组及手术+未受孕组小鼠术后心电图结果可见其ST段具有显著抬高,提示出现明显的心肌缺血表现,而手术+受孕组小鼠产后心电图结果提示其缺血症状较孕前减轻。超声结果也证实手术后小鼠均出现明显的心肌梗死表现,手术+受孕组小鼠产后心腔结构虽较孕前未见明显改变,各项心功能指标较假手术组减低,但与手术+未受孕组相比,心功能指标明显升高(P<0.05)。此外,通过免疫组化染色和PCR检测发现手术+受孕组心肌梗死区域具有GFP阳性表达,而其他两组均为GFP阴性。结论 胎鼠的胚胎干细胞可透过胎盘屏障,随血液迁移至母孕鼠体内,并对缺血损伤的心肌进行修复。
【关键词】胚胎干细胞;绿色荧光蛋白;心肌缺血;心肌损伤修复;小鼠;孕鼠
研究表明,不仅在妊娠期,甚至在胎儿出生后几十年内仍可在母体的外周血及器官内检测到胎儿的相关细胞[1]。这是由于在妊娠期时,母体与胎儿的有核血细胞之间存在双向运输,从而形成了胚胎期细胞的微嵌合体(microchimerism,MC)。微嵌合体属于嵌合体的一种,当供/受体细胞比例>1%时,称为嵌合体;而<1%时,则被称为微嵌合体,是指有一小部分来自于另一个个体、遗传上与宿主不同的细胞在宿主的身体内残留,即在母体身上发现子代个体的DNA或细胞的现象。这种微嵌合体可能通过修改母体免疫识别或者免疫耐受机制而长期稳定存在于母体,而这种转移至母体的可稳定存在的微嵌合体(胚胎干细胞),可能通过发挥其修复和再生作用,进而影响和参与多种疾病的发展和转归[2]。胚胎干细胞(embryonic stem cells,ESCs)是早期胚胎或原始性腺中分离出来的一类细胞,具有无限增殖、自我更新和多向分化的特性。ESCs具有发育的全能性,可分化为外胚层、中胚层和内胚层的各种细胞,具有分化成为机体内任一组织和器官的能力,因而称之为“万能”细胞。近年来的研究表明,ESCs在临床医学和再生医学领域的有着十分重要的意义,特别是在修复坏死心肌细胞、视网膜退化、脑缺血及神经退行性病变等方面[3-7]。国外研究表明胚胎干细胞能够通过胎盘屏障,进入母体血液循环并可发生定植,但是否可通过此方式修复母体缺血受损的心肌组织,国内外尚未见报道。本研究利用小鼠心肌梗死模型和e-GFP转基因小鼠,探讨胎鼠胚胎干细胞是否可以迁移至母孕鼠的缺血心肌组织,并初步探索胎儿胚胎干细胞是否对母体孕鼠器官的急性损伤具有修复作用。
1 材料与方法
1.1 实验动物及分组
SPF级C57雌性小鼠24只,体重20~25 g,6~8周龄,购自北京华阜康生物科技有限公司【SCXK(京)2014-0004】,随机分为3组(每组8只),分别为假手术组、手术+受孕组和手术组+未受孕组。清洁级GFP转基因雄性小鼠8只,8周龄,为本实验室保存。以上动物均饲养于中国医学科学院医学实验动物研究所清洁级小鼠房内【SYXK(京)2011-0022】。
1.2 材料
戊巴比妥钠(国药集团化学试剂有限公司,中国)、阿莫西林舒巴坦(哈药集团,中国)、呼吸机(Kent Scientific,美国)、MP150型多导电生理记录仪(16通道)(Biopac,美国)、高分辨小动物超声系统(Visualsonic Vevo 770,美国)、解剖镜(YZ20T9,中国)、冷光源(北京玻璃研究院,中国)、GFP抗体(Abcam,美国)、山羊抗兔二抗(中杉金桥,中国)、DAB显色液(中杉金桥,中国)。
1.3 方法
1.3.1 小鼠心肌梗塞模型制备及分组
根据小鼠短期缺血-再灌注模型制备[8-11]的方法加以改进,具体如下:腹腔注射2%戊巴比妥钠(0.024 mL/10 g)麻醉动物,脱去颈部及前胸部皮肤后备皮、消毒,将小鼠仰卧位固定于手术台上。通过气管插管术连接呼吸机,设定潮气量3 mL、正压通气30 cm H2O、呼吸频率120次/分。待小鼠呼吸节律与呼吸机一致时,即气管插管成功。插管成功后,对小鼠进行开胸手术。先于小鼠在左胸骨外1~2cm纵向剪开皮肤,开口长度1~2 cm,然后顺肋间隙方向于胸骨左旁第3肋间逐层钝性分离肌肉及胸膜,于2~3肋骨间撑开进胸,向右上方推开胸腺,可暴露心脏及大血管根部,切开心包,可在左心耳下缘处看到左冠状动脉前降支起始部,用6-0 prolene线缝针以起始部至心尖中上1/3处进针,进针深度控制在0.1 cm,宽度控制在0.1~0.2 cm。回纳心脏入胸廓,待小鼠10次心动周期后,收线打结。观察数分钟后,彻底止血并逐层关胸。关胸过程中可稍用力挤压胸腔,尽量排尽胸腔积气。5 min后待小鼠状态稳定,恢复小鼠自主呼吸,拔出小鼠气管内插管,将小鼠放至日光灯下复温10 min。以上手术操作均在严格无菌条件下进行,术后腹腔给予阿莫西林舒巴坦(3 mg/10 g)以预防感染。假手术组小鼠开胸后,仅在相同部位缝线但不结扎。雌鼠于术后1周进行心电图及超声心动检测,术后2周可与雄鼠合笼。
1.3.2 交配受孕
手术+受孕组雌鼠于手术稳定2周后开始与GFP转基因雄性小鼠以1∶1进行合笼。每天下午5点合笼,次日上午8点检查是否形成阴道栓,以检查到阴道栓时记为0.5 d。实验中合笼2 d时,所有受孕组小鼠(各8只)均见栓,妊娠周期为18~20 d。
1.3.3 心电监测
各组小鼠(各8只)于手术后1周及孕鼠产后(手术后32~35 d)各组小鼠分别使用MP150型多导电生理记录仪(16通道)(Biopac,美国)进行小鼠心电监测,了解术后及产后心电图变化。腹腔注射0.6%戊巴比妥钠(0.08 mL/10 g)麻醉小鼠,以II导联连接小鼠肢体,记录各组心电图。
1.3.4 超声心动检测
各组小鼠(各8只)于手术后1周及孕鼠产后(手术后32~35 d)进行超声心动检测,以比较小鼠手术后和孕后不同时期心脏结构的变化。腹腔注射三溴乙醇(1.25%,0.2 mL/10 g)麻醉小鼠,胸部脱毛后以仰卧位固定于超声架上,使用高分辨小动物超声系统(Visualsonic Vevo 770,美国)对小鼠心脏进行超声检测,记录图像及心功能数据并进行分析。
1.3.5 心脏取材
各组小鼠(各8只)于手术1月后(约为32~35 d)腹腔注射0.6%戊巴比妥钠(0.08 mL/10 g)麻醉,打开腹腔,从腹腔静脉内取血0.3 mL。之后打开胸腔,取出心脏,在PBS缓冲液中清洗3次。心脏修剪整齐以OCT包埋后放入-80℃保存。
1.3.6 血清DNA提取及PCR扩增
各组小鼠(各8只)血液以盐析法提取 DNA后,通过PCR扩增反应及水平凝胶电泳检测Gfp基因表达。PCR扩增反应条件为:94℃预变性5 min,然后94℃变性30 s,60℃退火30 s,72℃延伸60 s,共35个循环,最后以72℃延伸10 min。各组小鼠Gfp表达以Gapdh进行校正。Gfp正向引物:5'-ATGGTGAGCAAGGGCGAGGAG-3';Gfp反向引物:5'-TCAAAGATCTACCATGTACAGCTCGT-3';Gapdh正向引物:5'-ACCACAGTCCATGCCATCAC-3';Gapdh反向引物:5'-TCCACCACCCTGTTGCTGTA-3'。
1.3.7 冰冻切片及免疫组织化学染色
从-80℃取出OCT包埋的各组心脏组织(每组8只),于-20℃复温1 h后,使用冰冻切片机(Leica,德国)以5 μm为厚度进行冰冻切片。切片以病变部位为主,纵切并尽量包含四腔心。切片后于-20℃保存。
切片从-20℃取出后于4℃回温10 min,室温回温20 min后,以PBS冲洗3次。切片经微波修复(柠檬酸钠)后,使用3%H2O2消除内源性过氧化物酶。切片经山羊血清封闭后,一抗(1∶200)孵育4℃过夜。次日以PBS洗去未结合一抗,并按照实验步骤孵育二抗。应用DAB溶液显色后,以苏木素复染。梯度酒精脱水封片,室温放置1 d后,收片保存。应用正置显微镜采集图片(Leica,德国)。
1.4 统计学处理
2 结果
2.1 肉眼大体形态观察
手术1月后手术+受孕组及手术+未受孕组小鼠均可观察到左室前外侧壁可见椭圆形、不规则形心脏变白区,约占左室面积1/3~1/2,变白区心肌活动减弱或消失,甚至反常运动;同时可见左室前外侧壁明显变薄,心肌横截面约占左室周径1/3的左室前外侧壁明显变薄。由此可证实手术模型建立成功,手术后各组均出现肉眼可见的心肌梗死形态。
2.2 受孕明显改善心梗诱导的小鼠心电图改变
心电图为检测心肌梗死手术模型制作成功与否的金标准。本实验中手术后雌鼠心电图呈现特殊的ST段抬高的心肌缺血或梗死表现,说明心肌梗死模型制作成功(图1 C和E)。通过建立心肌梗死模型,观察术前及术后心电图变化情况,研究手术+受孕组胚胎干细胞迁徙受损心肌后,在心电图方面改善的情况。图1A和B为正常组心电图;图1 C和D分别为手术+未受孕组同只母孕鼠在手术后1周和产后1月的心电图,前者可见到ST段弓背向上抬高,为心肌梗死急性期表现;后者可看到ST段较前稍有下降,但无明显恢复的变化。图1 E和F为手术+受孕组同只母鼠术后1周和1月心电图,前者表现为ST段高耸,为心肌梗死急性期表现;后者表现为ST段轻度倒置,表现为心肌梗死已经进入慢性期,其恢复水平较手术+未受孕组好。

图1 各组雌鼠心电图的改变情况Note.A.ECG of a mouse of the sham group at 1 week after operation;B.ECG of a mouse of the sham group at 1 month after operation;C.ECG of a mouse of the surgery+no pregnancy group at 1 week after operation;D. ECG of a mouse of the surgery+no pregnancy group at 1 month after operation;E.ECG of a mouse of the surgery +pregnancy group at 1 week after operation;F.ECG of a mouse of the surgery+pregnancy group at 1 month after operation.n=8.Fig.1 Changes of electrocardiogram(ECG)in each group
2.3 受孕明显改善心梗诱导的小鼠心脏结构改变
超声心动图为检测孕鼠术后远期发生心肌重构后的结构和功能,观察孕鼠术后1个月心脏结构变化,及心功能变化情况。心肌梗死亚急性期或慢性期出现心室重构,心功能降低,故超声心动图既可以评价心肌结构变化,也可作为评判心梗模型建立成功与否的标准之一。图2分别为假手术组、手术+受孕组、手术+未受孕组在相同条件下饲养1月后的超声心动图。由结果可见,假手术组雌鼠手术后1月心脏结构完整,心功能大致正常(图2A)。手术+未受孕组雌鼠超声图像,可见其心脏心腔明显扩大,心尖钝圆明显,前壁变薄,心肌内出现梗死灶,心室重构明显,甚至出现室壁瘤,而心功能明显减低(图2 B)。从手术+受孕组超声图像中可见心脏心腔扩大,前壁变薄,心肌梗死灶明显,已经发生心室重构,心功能减低(图2 C)。但通过图2 B和图2 C的比较可见,前者心腔扩大更为明显,心脏前壁更薄,心尖更钝圆,说明心肌梗死程度更重,也说明心肌梗死已由急性期演变到慢性期;前者即手术+受孕组心肌梗死损伤情况较后者轻,提示可能是由于胎鼠胚胎干细胞迁移至母鼠心脏损伤处对梗死心肌的修复作用所致。
通过建立心肌梗死模型,观察各组小鼠超声心动图及心功能的改善情况,特别是手术+受孕组,根据比较其心功能改善情况,来评价受孕对心肌梗死后心功能的改善作用。如表1所示假手术组、手术+受孕组和手术+未受孕组小鼠,于手术1月后(手术+受孕组小鼠均已进入孕产期)以超声检测各组小鼠左心室射血分数(EF/%)、左室内径(收缩期)(LVID/d)、左室内径(舒张期)(LVID/s)。结果显示手术 +受孕组 EF%较假手术组减低(P<0.05),而较手术+未受孕组升高(P<0.05);手术+受孕组LVID/d较假手术组升高(P<0.05),而较手术+未受孕组降低(P<0.05);手术+受孕组LVID(s)较假手术组升高(P<0.05),而较手术+未受孕组降低(P<0.05)。
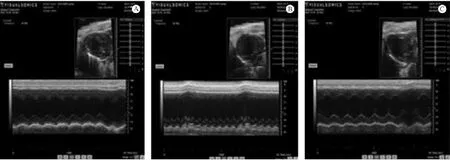
图2 各组小鼠超声心动图检测Note.A.Echocardiography of a mouse of the sham group;B.Echocardiography of a mouse of the surgery without pregnancy group;C.Echocardiography of a mouse of the surgery+pregnancy group.n=8.Fig.2 Changes of the cardiac function in mice of each group detected by echocardiography taken at one month after operation
表1 各组小鼠心脏超声心动参数(n=8,±s)Tab.1 The echocardiographic parameters in the mice of each group

表1 各组小鼠心脏超声心动参数(n=8,±s)Tab.1 The echocardiographic parameters in the mice of each group
注:*,手术+受孕组与假手术组相比差异有显著性;#,手术+未受孕组与手术组相比差异有显著性(P<0.05)。Note.*,significant difference when the surgery+pregnancy group was compared with sham group;#,significant difference when the surgery+pregnancy group compared with the surgery without pregnancy group(ANOVA on ranks,P<0.05).
组别Groups EF/% LVID/d LVID/s假手术组Sham group 0.704±0.043 3.264±0.188 2.204±0.175手术+受孕组Surgery+pregnancy group 0.501±0.01* 3.91±0.216* 3.000±0.338*手术组+未受孕组Surgery without pregnancy group 0.315±0.089# 4.714±0.635# 3.938±0.815#
2.4 孕鼠血液中可检测到GFP基因
各组小鼠(各8只)于手术1月后提取血液DNA,通过PCR扩增和水平凝胶电泳,检测是否存在GFP基因,以检验孕鼠血液循环中是否含有来源于胚胎的GFP基因。通过盐析法提取手术后一月雌孕鼠血液中DNA,经GFP引物进行PCR扩增后,进行水平凝胶电泳检测。如图3所示,手术+受孕组雌鼠血液中存在GFP基因,而假手术组和手术+未受孕组雌鼠血液中均未检测到GFP基因。因此提示胚胎细胞可穿过胎盘屏障进入母鼠体内。
2.5 受孕母鼠心脏中表达GFP蛋白

图3 血液中GFP基因的检测Note.M:DNA molecular marker;Lane 1:Negative control;Lane 2:H2O;Lane 3:Surgery without pregnancy group;Lane 4-6:Surgery+pregnancy groups;Lane 7:Positive control.Fig.3 Detection of GFP gene in the blood
前文已经通过心电图、超声心动图证实受孕可以改善心功能,并且通过血液PCR检测也证实胚胎干细胞可进入母体血液系统的事实,因此我们推测受孕母鼠心梗状况的减轻是由于胚胎干细胞迁徙至受损心肌发挥的修复作用。为此我们通过免疫组化方法检测受孕母鼠心脏中是否表达GFP基因。以各组小鼠(各8只)心脏组织冰冻切片,进行GFP免疫组织化学染色后结果如图4所示,图4A、B和C分别为手术+未受孕组免疫组化50倍、100倍及200倍镜下图片,在梗死区域附近未见GFP荧光蛋白褐色沉淀,但可见大量炎症细胞浸润。而D、E和F分别为手术+受孕组50倍、100倍及200倍镜下图片,在整个梗死区明显可见大量GFP荧光蛋白褐色沉淀,证明有较多的含有GFP的胚胎干细胞存在于心肌梗死区,并可见部分炎症细胞浸润。
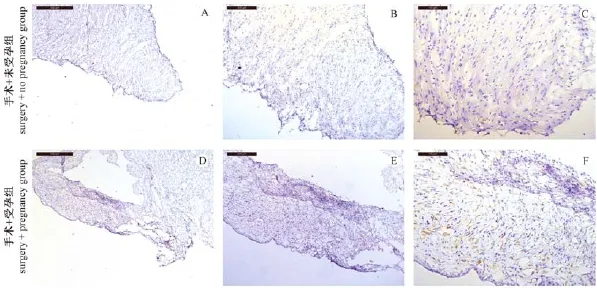
图4 小鼠心肌组织中GFP荧光蛋白表达Note.A,B and C are respectively the microscopic images of×50,×100 and×200 in the same myocardial infarction area of surgery without pregnancy group,and no GFP fluorescent protein was detected in the cardiomyocytes.Figure D,E and F are respectively the microscopic images of×50,×100 and×200 in the same myocardial infarction area of surgery +pregnancy group,abundant brown cells were detected in the mouse myocardium.×50,bar=500 μm;×100,bar= 200 μm;×200,bar=100 μm.Fig.4 GFP expression in the mouse myocardial tissues
3 讨论
心肌梗死及其引起的心力衰竭是导致心血管疾病患者死亡的主要原因,目前主要治疗方法为药物治疗、介入治疗及“搭桥”手术治疗等,但这些治疗方法仅能缓解症状,延缓疾病进展,不能根本上修复已经坏死的心肌细胞。干细胞对各组织的修复作用已经被国内外研究所证实,如发现胚胎干细胞可以存在于母孕鼠大脑、肾脏、肝脏、血液及皮肤等损伤部位[12-15]。那么胚胎干细胞是否可以通过胎盘屏障迁移至受损心肌发挥修复作用呢?
在本实验中,我们在进行小鼠心肌梗死模型后,通过心电图和超声心动图确认模型是否成功,并利用二者观察受孕是否能够改善心肌梗死损伤。心电图在心肌梗死诊断中具有特征性改变的演变规律,特异性强,敏感性高,对定性、定位、分类及预后评估等方面具有重要地位,特别是在前降支单支病变中具有重要提示作用[16],更是确认心肌梗死模型建立成功与否的金标准。心肌梗死时心电图的演变分为三期[17]:超急性期在冠状动脉闭塞10分钟到数小时内,心电图表现为巨大高耸的T波或ST段呈直立型升高;急性期历时数小时至数天,从ST段弓背向上抬高呈单向曲线,出现坏死型Q波,至ST段恢复到等电线,T波倒置。亚急性期数天至数周,表现为病理性Q波,T波逐渐恢复或表现慢性冠状动脉供血不足。恢复期心电图仅残留病理性Q波,如为小面积的心肌梗死,可不遗留病理性Q波。本实验中手术+非受孕组和手术+受孕组于急性期均表现为ST段弓背向上抬高呈单向曲线,提示模型建立成功;于1月后进展至亚急性期,但手术+非受孕组心电图仅表现为T波稍有恢复,而手术+受孕组心电图T波恢复较为明显。此外,超声心动图结果也显示手术+未受孕组雌鼠心脏心腔明显扩大,存在心肌梗死灶,心室重构明显,且出现心功能指数的明显减低。而手术+受孕组虽仍有心脏结构变化,但较手术+未受孕组已具有明显改善。以上结果提示受孕对心肌损伤具有明显的修复作用。
由于心肌细胞的不可再生性,心肌梗死后心肌细胞可发生坏死及心室重构。因此我们推测受孕母鼠心梗症状减轻可能是由于胚胎干细胞进入体内,分化为心肌细胞从而起到对母鼠心脏的修复作用。而国外也有报道,50%以上的自发性心力衰竭女性能自愈[18-19],而围产期心力衰竭的自愈率最高[20],但其机理尚未阐明。我们利用GFP雄鼠与心梗模型雌鼠进行交配,并且检测到怀孕后1月母鼠的血液和心脏中具有GFP基因的表达,证实了GFP荧光蛋白标记的胚胎干细胞可以通过血液循环系统,迁徙至心肌梗死后的母鼠心肌损伤处起到修复作用。
本研究初步探索了胎儿母体干细胞转移和微嵌合体现象,并且发现其对缺血损伤的心肌有可能存在一定的修复作用,从而为胚胎干细胞治疗心脏疾病提供了重要的实验依据。
参考文献
[1] Liegeois A,Gaillard MC,Ouvre E,et al.Microchimerism in pregnant mice[J].Transplant Proc,1981,13(1 Pt 2):1250-1252.
[2] Nelson JL.Maternal-fetal immunology and autoimmune disease:is some autoimmune disease autoalloimmune or allo-autoimmune?[J].Arthritis Rheum,1996,39(2):191-194.
[3] Chong JJ,Murry CE.Cardiac regeneration using pluripotent stem cells—progression to large animal models[J].Stem Cell Res,2014,13(3 Pt B):654-665.
[4] Reynolds J,Lamba DA.Human embryonic stem cell applications for retinal degenerations[J].Exp Eye Res,2014,123:151-160.
[5] Maccario R,Podestà M,Moretta A,et al.Interaction of human mesenchymal stem cells with cells involved in alloantigen-specific immune response favors the differentiation of CD4+T-cell subsets expressing a regulatory/suppressive phenotype[J].Haematologica,2005,90(4):516-525.
[6] 陈镇洲,徐如祥,姜晓丹.骨髓基质细胞移植治疗脑缺血[J].中华神经医学杂志,2006,5(1):101-103.
[7] 何玲,李伟,周铄.诱导多能干细胞与帕金森病治疗研究进展[J].临床神经病学杂志,2014,27(4):311-313.
[8] 汪谦.现代医学实验方法[M].北京:人民卫生出版社,1997,976-977.
[9] Zhu X,Liu B,Zhou S,et al.Ischemic preconditioning prevents invivo hyperoxygenation in postischemic myocardium with preservation of mitochondrial oxygen consumption[J].Am J Physiol Heart Circ Physiol,2007,293(3):H1442-1450.
[10] Gao EH,Lei YH,Shang XY,et al.A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse [J].Circ Res,2010,107(12):1445-1453.
[11] 尉新华,范慧敏,李铁岩,等.小鼠心肌梗死模型的建立和无创评价方法[J].同济大学学报(医学版),2011,32(5):20-22.
[12] Nassar D,Droitcourt C,Mathieu-d'Argent E,et al.Fetal progenitor cells naturally transferred through pregnancy participate in inflammation and angiogenesis during wound healing[J].FASEB J,2012,26(1):149-157.
[13] Nguyen Huu S,Oster M,Uzan S,et al.Maternal neoangiogenesis during pregnancy partly derives from fetal endothelial progenitor cells[J].Proc Natl Acad Sci U S A,2007,104(6):1871-1876.
[14] Tan XW,Liao H,Sun L,et al.Fetal microchimerism in the maternal mouse brain:a novel population of fetal progenitor or stem cells able to cross the blood-brain barrier?[J].Stem Cells,2005,23(10):1443-1452.
[15] Wang Y,Iwatani H,Ito T,et al.Fetal cells in mother rats contribute to the remodeling of liver and kidney after injury[J].Biochem Biophys Res Commun,2004,325(3):961-967.
[16] 孙瓅贤,严建华,李全,等.前降支单支病变急性心肌梗死患者的心电图ST段分析[J].中华医学杂志,2011,91(16):1096-1099.
[17] 葛均波,徐永健.内科学(第8版)[M].北京:人民卫生出版社,2013,246-247.
[18] James PR.A review of peripartum cardiomyopathy[J].Int J Clin Pract,2004,58(4):363-365.
[19] Ro A,Frishman WH.Peripartum cardiomyopathy[J].Cardiol Rev,2006,14:35-42.
[20] Felker GM,Thompson RE,Hare JM,et al.Underlying causes and long-term survival in patients with initially unexplained cardiomyopathy[J].N Engl J Med,2000,342(15):1077-1084.
Repairing effect of embryonic stem cells on injured maternal myocardium in pregnant mice
WANG Hong-mao1,QIU Bin2,DENG-Ran2,WANG Chao2,YONG Wei-dong2,SHI Lin1*
(1.Department of Cardiovascular Diseases,Children's Hospital Affiliated to Capital Institute of Pediatrics,Beijing 100020,China;2.Institute of Laboratory Animal Science,Peking Union Medical College&Chinese Academy of Medical Sciences Laboratory of Gene and Development,Beijing 100021,China)
【Abstract】Objective To determine if fetal stem cells can enter the maternal circulation during pregnancy and repair the injuries of maternal heart.Methods C57 female mice at the age of 6-8 weeks were randomly assigned to three groups:sham control,surgery without pregnancy,and surgery with pregnancy(n=8,eath group).The control sham group was developed by opening and closing of the chest.The other two groups underwent heart surgery.The myocardial infarction(MI)model was induced by ligation of the left anterior descending coronary artery.Half of the surgical mice mated with e-GFP transgenic male mice,and another half group was not.Electrocardiogram(ECG)and echocardiographic images were recorded at pre-operation,post-operation and postpartum.The collected data were used to evaluate the heart function. The GFP expression was detected by immunohistochemistry and q-PCR.Results When compared with the sham group,both the ischemia surgery groups with and without pregnancy,the ECG ST segment was significantly increased.This measurement indicated that the myocardial ischemia surgery was successful,and no significant difference in the ST segments between two ischemia surgery groups was found.However,when ECG was measured in the surgical mice after postpartum,their myocardial ischemia was dramatically improved when compared with that of the ischemia surgery only mice.Echocardiographic images also indicated that both the surgery groups had myocardial ischemia,however,no significant difference was observed in the pregnant mice before and after postpartum.The order of the cardiac function indexes from high to low was the sham group,surgery with pregnancy group,and surgery with no pregnancy group;in particular,the cardiac function of pregnancy group was significantly enhanced compared with that of the surgery with no pregnancy group(P<0.05). More importantly,both immunofluorescence and q-PCR results showed that the embryonic stem cell translocation through circulation system with GFP expression in the heart of pregnancy group,while negative in other two groups.Conclusions Embryonic stem cells can be transferred into the maternal circulation of pregnant mice,and play a role in the repairing of their cardiac injuries.
【Key words】Embryonic stem cells;GFP;Myocardial ischemia;Cardiac repair;Mice;Pregnancy
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2016)02-0127-07
Doi:10.3969/j.issn.1005-4847.2016.02.004
[基金项目]中国医学科学院医学实验动物研究所基本科研业务费专项(DWS201508);863(2012AA02240)资助;国家科技重大专项(2014ZX10004002-001)。
[作者简介]王宏茂(1986-),男,医师,硕士学位,E-mail:sunnyboymao@126.com
[通讯作者]石琳,女,主任医师,教授,E-mail:shilin9789@126.com
Corresponding author:SHI Lin,Email:shilin9789@126.com
[收稿日期]2015-12-05
