基于TCGA讨论EPHB2表达与子宫内膜癌预后的关系
2021-01-18王翠翠马晓欣
王翠翠,马晓欣
子宫内膜癌(endometiral cancer, EC)是最常见的妇科恶性肿瘤之一,早期EC预后较好,5年生存率能达到90%以上,然而,Ⅲ期、Ⅳ期EC患者5年生存率仅有60%、20%[1]。促红细胞生成素的肝癌细胞(erythropoietin-producing hepatomocellular, Eph)受体根据序列同源性及相应配体肝配蛋白亲和性不同分为A(EphA1-10)、B(EphB1-6)两大类。近年来,越来越多的研究[2-3]表明EphB2作为家族成员之一和配体一起可以调节细胞的许多功能,包括增殖、自噬、凋亡、侵袭及上皮间质转化等,虽然有研究[4-6]报道EphB2在很多恶性肿瘤中,与正常组织相比表达有差异,但其与EC的关系尚无研究。该文基于TCGA探讨EPHB2的表达与EC患者预后关系,并利用基因集富集分析(gene set enrichment analysis,GSEA)进一步了解那些既涉及EPHB2调控网络又参与子宫内膜癌的发生发展的可能的生物学通路。
1 材料与方法
1.1 材料从TCGA官网(https://cancergenome.nih.gov/)下载子宫内膜癌(UCEC)校正后的基因转录组数据575例和临床样本数据548例。EPHB2在23例正常的子宫内膜组织及552例EC组织间的表达差异通过散点图表现。再比较EPHB2在不同临床病理参数间的表达情况。最后利用校正后的基因表达数据和相应的临床样本数据做单因素及多因素分析及GSEA。
1.2 方法GSEA是一种基于Java平台利用电脑计算方法分析一种或一组预先定义的基因在两种不同生物状态之间差异是否有统计学意义。该文中GSEA以所有基因与EPHB2表达的相关性生成的有序的基因列表为基础,并以EPHB2在EC中的表达水平作为标签,分成高表达组及低表达组,阐明EPHB2高表达组与低表达组之间是否存在生存差异。每个分析行1 000次基因组排列。以归一化评分对各表型中富集的途径前后排序。
1.3 统计学处理计量资料进行正态性及方差齐性检验,若数据符合正态分布,对于单变量两组资料之间的比较采用t检验,否则采用Wilcoxon两样本比较检验。对于多组资料之间的比较,若数据符合正态分布,采用方差分析,否则采用Kruskal-Wallis检验。按EPHB2表达的中位值将其分为高表达组及低表达组,Logistic回归分析EPHB2的表达与临床病理特征的关系。Kaplan-Meier法做生存分析曲线。Cox单因素及多因素分析预测EPHB2表达以及其它一些临床特征(如分期、分级、肿瘤状态、组织学类型、淋巴结转移情况、手术方式、是否有残留病灶及腹水细胞学等)对预后的影响。所有统计分析均用R语言执行,以P<0.05为差异有统计学意义。
2 结果
2.1 患者特征从TCGA官网上下载同时具有校正后基因转录组表达数据及临床数据的EC样本共548例,具体临床资料信息见表1。

表1 TCGA EC患者的临床特征
2.2 EPHB2的表达与临床病理参数的关系575例来自TCGA数据库中与子宫内膜相关的基因表达数据中,正常内膜组织样本23例,子宫内膜恶性肿瘤样本552例,子宫内膜恶性肿瘤样本中EPHB2的表达量高于正常的子宫内膜样本(图1)。在552例内膜癌组织样本中,有548例同时具有基因表达数据及患者临床资料。结果显示EPHB2表达量与EC期别、分化程度、腹水中是否查到瘤细胞及组织类型等有关,对于高期别、高级别、腹水细胞学阳性及组织病理类型为浆液性腺癌的患者,EPHB2表达量增高(图2) 。
单因素分析也表明EPHB2的表达与一些关键临床特征有关,而这些临床特征往往预示着患者的不良预后(表2)。EPHB2高表达组与EC晚期,高级别EC,携瘤状态,腹水找到瘤细胞及较差的组织学类型有关(P<0.05),说明相比于EPHB2表达减低,EPHB2表达增高更有可能出现不良预后。

图1 EPHB2基因表达情况

表2 EPHB2的表达与临床病理特征的关系
2.3 生存结局和多因素分析Kaplan-Meier结果显示EPHB2高表达组的总生存时间低于EPHB2低表达组(P<0.000 1)(见图2 F)。Cox单因素分析结果显示EPHB2表达水平与不良生存结局有关。其他可能影响生存预后的因素还包括肿瘤期别、分化程度、是否携带肿瘤、腹水中是否可见肿瘤细胞,淋巴结转移情况以及组织病理类型等。并且多因素分析还提示EPHB2可能是一个与总体生存相关的独立预后因子(表3)。
2.4 GSEA确定的与EPHB2相关的信号通路为明确EPHB2可能参与在影响子宫内膜癌进展的哪些通路,设EPHB2的表达水平为表型,分为高表达组及低表达组。以MSigDB数据库中c2.cp.kegg.v5.2.symbols. gmt 数据集作为功能基因集,按归一化富集分数(NES)排序,在两组中找到FDR-q值<0.05且FWER-P值<0.05的通路。结果表明EPHB2高表达组主要富集在轴突导向通路中,EPHB2低表达组主要富集在α亚麻酸代谢通路中(图3)。
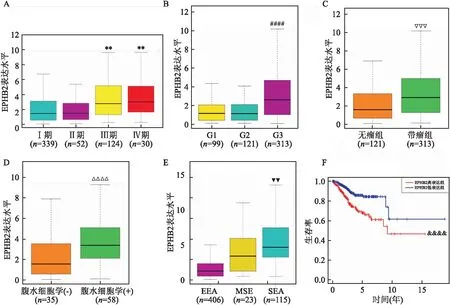
图2 EPHB2的表达与临床病理特征的关系

表3 EPHB2的表达与EC总生存率关系的单因素与多因素分析

图3 EPHB2 基因高表达样本相关富集基因集
3 讨论
本文基于TCGA数据库中的EC转录组数据及临床资料进行生物信息学分析,表明EC中EPHB2的表达与部分临床性状有关(如肿瘤分期、分级、腹水中是否找到瘤细胞以及肿瘤组织类型等)。晚期、高级别、腹水中见瘤细胞及较差的病理类型与EPHB2高表达有相关性,提示EPHB2表达增高可能与EC的不良预后相关;通过Kaplan-Meier生存分析及Cox单因素及多因素分析证实了这一推测,且EPHB2的表达可能成为一个独立预测不良结局的因素。为了进一步讨论EPHB2影响EC患者预后的机制,又完成了GSEA分析,结果显示EPHB2表达水平的变化可能通过参与轴突导向通路及α亚麻酸代谢通路而影响EC的预后。
Eph受体是酪氨酸激酶受体亚家族成员,最先发现是作为神经系统细胞间相互作用的调节因子,包括轴突导向和神经生长锥的发育。本文利用GSEA也推测EPHB2表达增高可能促进轴突导向通路。基因敲除鼠模型研究[7]发现EPHB2和肝配蛋白B2在动静脉的血管内皮细胞相互结合,启动EPHB-肝配蛋白B信号通路,从而调节血管及淋巴管的发育,而且肝配蛋白的反向信号通路还在肿瘤的血管生成中起重要的作用。除了肿瘤的血管新生,EPHB2-肝配蛋白信号通路还可以介导肿瘤的增殖[8]、上皮间质转化[3]、侵袭[9]和凋亡等。有学者[10]利用TCGA数据库中的头颈部鳞状细胞癌患者的临床数据,通过Kaplan-Meier生存分析得出EPHB2过表达可降低患者的生存期,其他学者[11]在肺腺癌中也得到相同的结论。在EC中,尚无人指出EPHB2的表达对EC的影响,本文首次利用TCGA数据库总结出EPHB2在EC中表达增高,差异有统计学意义,且EPHB2高表达与很多临床病理参数相关,EPHB2表达量越高,EC患者的预后越差。
α亚麻酸是人类及其它高等动物自身无法合成的必须脂肪酸,在人体中,这种脂肪酸可以产生花生四烯酸(ARA),二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),这些物质可调节机体稳态,高水平的α亚麻酸可帮助预防炎症性疾病、肿瘤、心血管疾病或其它慢性病[12-13]。α亚麻酸抑制肿瘤发生的具体机制还不明确。本文通过GSEA得出高表达EPHB2可能通过抑制α亚麻酸代谢促进EC的发生,具体机制还需要细胞学分子水平上的进一步研究。
轴突导向是指轴突延伸到指定靶点的过程,在神经系统中,轴突之所以能沿着精确的路径生长是由于轴突导向作用在神经系统的发育中有着非常重要的作用。在轴突生长的尖端,有一种活力很高的结构,即生长锥,其上含有能识别导向的受体,并激活各种信号分子调节细胞骨架[14]。起初认为轴突导向分子是用来调节大脑神经元细胞的生长和定位,然而近年来发现它在肿瘤发展中也起到重要的作用。具有代表性的是Slits家族,通过与Robo跨膜受体结合激活Slit-Robo信号通路改变肿瘤的迁移、侵袭和增殖等生物学行为[15]。本研究显示在GSEA中EC EPHB2高表达组富集在轴突导向通路中,它可能通过改变轴突导向相关蛋白的表达影响EC的发生和发展。
综上,EPHB2的表达水平可能成为预测EC不良预后结局的分子标志物,轴突导向和α亚麻酸代谢通路可能是EPHB2起作用的关键通路。本文不足在于,结论仅基于TCGA数据库中的数据,用转录组表达数据预测蛋白表达量还不够准确,且只用GSEA推断EC中与EPHB2可能相关的通路有一定的局限性,后续还需要实验进一步验证。
