miR-26b调控Wnt/β-catenin信号通路促进成肝样分化MSCs迁移研究
2021-01-18吉杨丹罗红阳杨小燕何志旭刘金河汪显耀张丽娟张玲敏许键炜
吉杨丹,罗红阳,王 丹,王 恒,杨小燕,何志旭,刘金河,汪显耀,赵 锦,张丽娟,张玲敏,秦 臻,许键炜,
间充质干细胞(mesenchymal stem cells,MSCs)因具有自我复制和多向分化潜能,可用于多种损伤性疾病的组织重建与修复[1]。临床和动物实验研究发现,MSCs能靶向受损的肝组织,对急慢性肝损伤均有修复作用,但疗效并不稳定,个体差异非常大。究其原因,可能与MSCs的迁移归巢和分化以及局部微环境的影响有着密切的关系[2]。研究[3]发现,肝细胞生长因子(hepatocyte growth factor,HGF)能趋化MSCs向病灶部位迁移。同时微小RNA (microRNA,miRNA)参与了细胞的迁移、增殖、分化[4],在生命活动中起重要作用。课题组前期研究[5]发现miR-26b和Wnt/β-catenin信号通路参与了 MSCs干性的维持以及趋化迁移的调控。该实验以miR-26b作为研究靶点,初步探讨其对Wnt/β-catenin信号通路以及成肝样不同分化状态MSCs向HGF趋化迁移的影响,为MSCs作为种子细胞定向迁移治疗肝损伤及相关机制提供实验依据。
1 材料与方法
1.1 材料SD大鼠[贵州医科大学实验动物中心,动物合格号SYXK(黔)2018-0001],L-DMEM培养基、l0%FBS及0.25%EDTA(美国Hyclone公司),HGF、表皮生长因子(epidermal growth factor,EGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)(美国Sigma公司),相差显微镜(德国Leica公司),CO2培养箱(美国Thermo Forma公司),Transwell小室(美国Corning公司),超净工作台(苏州苏净集团),细胞培养箱(Model311)、SYBR Green RT-qPCR 试剂盒(美国Thermofisher公司),台式高速冷冻离心机(Allegra 64R,美国贝克曼库尔特公司),qRT-PCR仪(StepOne,美国ABI公司),U-LH100L-3活细胞工作站(日本OLYMPUS公司),TRIzol、转染试剂(美国Ambion公司),miR-26b引物(广州锐博生物科技公司),Q-PCR引物由生工生物工程(上海)股份有限公司合成。
1.2 实验方法
1.2.1大鼠MSCs的培养、鉴定 取5~8周龄、体质量(150±20) g SD大鼠,乙醚麻醉处死后取两侧股骨,剪去股骨两端,用注射器吸取L-DMEM混合液从骨髓腔反复冲出骨髓至无菌平皿中。接种于25 cm2的培养瓶中,加入含有10%FBS的L-DMEM液,5%CO2、37 ℃恒温培养,3~4 d换液1次。细胞生长铺展至瓶底约80%~90%后0.25%EDTA消化传代。培养至第4代,采用流式细胞术分析细胞膜表面分子CD71、CD29、CD45和CD34的表达。
1.2.2miR-26b对Wnt/β-catenin信号通路的影响 选用生长至80%左右汇合的第四代MSCs,通过感染重组腺病毒(Ad-26b)高表达miR-26b,乱序的空病毒(Ad)为对照(由课题组前期包装重组腺病毒获得)[5],PBS洗2次,按浓度为107pfu/ml的病毒液,每个培养皿中加入100 μl,37 ℃孵育1.5~2 h后更换为完全培养基培养48 h,荧光显微镜下观察绿色荧光蛋白(green fluorescent protein,GFP)的表达。选取表达强且感染效率高的MSCs,PBS清洗2次,加入液氮,以200 μl细胞裂解液提取总蛋白,并按说明书进行操作。Western blot检测activated β-catenin(ABC)、β-catenin、p-β-catenin(S33/S37/T41)蛋白表达的变化。将上述细胞用PBS液清洗3次。TRIzol RNA,参照试剂盒说明书,去除基因组DNA,将总RNA逆转录成cDNA,以GAPDH作为内参,qRT-PCR检测Wnt/β-catenin信号通路下游靶基因c-Myc,RUNX2转录水平的变化。
1.2.3miR-26b对MSCs黏着斑(focal adhension,FA)、细胞骨架及形态的影响 选取上述表达强且感染效率高的MSCs,消化重悬,将细胞稀释成1×104/ml的细胞悬液,接种至多聚赖氨酸(polylysine,PLL)包被的玻片上,桩蛋白(Paxillin)免疫荧光染色观察FA,细胞铺展面积和极性指数(长轴和短轴之比)。
1.2.4成肝样不同分化状态MSCs的制备及miR-26b在不同状态MSCs中的表达 根据MSCs成肝样细胞分化状态,将分化过程分为A、B、C、D 4个时间点。未分化的细胞状态设为A点,加入HGF、EGF、bFGF(加入量均为10 μl/L)与MSCs建立诱导共培养体系,加入诱导剂第7天(设为B点),第14天(设为C点),第21天(设为D点)分别得到4种处于不同分化状态(A、B、C、D) 的细胞用于后续实验。qRT-PCR检测不同状态MSCs中miR-26b的相对表达量。见表1。

表1 各基因RT-qPCR引物一览表
1.2.5miR-26b对不同分化状态的MSCs趋化迁移的影响 选用生长汇合至80%左右的第4代MSCs,通过感染重组腺病毒(Ad-26b)高表达miR-26b,空病毒(Ad)为对照(方法同1.2.2)。选取表达强且感染效率高的细胞用于诱导成肝样细胞迁移实验。诱导分化方法同1.2.4。
1.2.5.1Transwell趋化迁移实验 取不同分化状态各组细胞,制备成2×105/ml的细胞悬液,将8.0 μm孔径的Transwell小室置于24孔培养板,在上室加入细胞悬液200 μl/孔,同时在下室加入500 μl含HGF(25 ng/ml)L-DMEM,于37 ℃、5%CO2浓度的培养箱孵育6 h,对下室细胞采用4%多聚甲醛固定,0.1%结晶紫浸泡染色30 min,PBS漂洗3次后显微镜下拍照,计算迁移至室膜下方的细胞总数。将对照组的迁移细胞数作为基数,标准化定义为1。
1.2.5.2Dunn chamber迁移实验 将上述不同分化状态的细胞按1×104/ml的浓度接种在含PLL包被盖玻片的培养皿中,在Dunn chamber内槽加满分化培养基,取长有细胞的盖玻片细胞面朝下,放置在槽的正上方,一侧仅盖住桥不盖住外槽,另外3侧用凡士林封片,外槽加入含HGF(25 ng/ml)的L-DMEM液,凡士林封口。外槽内的趋化因子在张力的作用下缓慢渗入内槽,在内外槽之间形成浓度梯度。Dunn chamber置于活细胞工作站显微实时摄影系统,每5 min拍照1次,连续拍摄6 h。随机选择30个未与其他细胞产生牵拉的细胞,Cellsens软件分析细胞迁移的轨迹,统计迁移距离,计算迁移速率(μm/min)。

2 结果
2.1 大鼠骨髓可分离、培养、扩增MSCs显微镜下可见原代培养的细胞在4~6 h开始贴壁,5 d后呈集落生长并迅速增多,传至第3代后,大部分细胞呈长梭形,流水、漩涡状生长。见图1。课题组前期用同样方法培养的细胞,流式细胞术检测结果显示大鼠MSCs: CD71、CD29呈阳性表达,而CD45和CD34呈阴性。

图1 第4代骨髓间充质干细胞 ×100
2.2 miR-26b参与对Wnt/β-catenin信号通路的调控取上述重组腺病毒感染48 h后高表达miR-26b的MSCs,在绿色荧光显微镜下可观察到约70%左右的MSCs发绿色荧光。qRT-PCR检测Ad-26b组miR-26b的表达量较空病毒对照组上调,可用于后续实验。感染48 h后提取总RNA,qRT-PCR检测MSCs中miR-26b的相对表达量。使用U6为内参基因,进行3次生物学重复,数据采用2-ΔΔCt法统计分析。将感染Ad后细胞中miR-26b的相对表达量标准化为1。见图2。Western blot检测β-catenin、p-β-catenin(S33/S37/T41)、activated β-catenin(ABC)蛋白表达的变化。结果显示高表达miR-26b后ABC蛋白水平升高,p-β-catenin的蛋白水平下降,β-catenin总蛋白无变化。Wnt/β-catenin信号下游靶基因c-Myc,Runx2的表达升高。见图3。
2.3 miR-26b上调MSCs细小FA数量、重组细胞骨架、缩小铺展面积项目组通过重组腺病毒感染MSCs以高表达miR-26b,然后进行Paxillin免疫荧光染色以指示FA。统计显示,每百个FA中小于25 μm的FA, Ad-26b组为(57.5±6.5)个,Ad组为(38.2±3.8)个,差异有统计学意义(t=25.63,P<0.05)。细胞高表达miR-26b后,细小FA数目增多,细小FA向细胞的前端周边分布。说明miR-26b影响FA的大小及分布。见图4。
miR-26不仅参与了细胞骨架重组和细胞迁移等活动,还参与细胞形态改变。通过Cellsens软件分析MSCs的极性指数(长轴和短轴之比)、铺展面积。结果显示,细胞相对面积,差异有统计学意义(t=61.01,P<0.05);极性指数,差异有统计学意义(t=64.41,P<0.05)。如图5所示,高表达miR-26b后细胞面积变小,同时极性指数增大。实验结果表明高表达miR-26b促使MSCs铺展面积变小并且细胞呈现极性分布。

图2 重组腺病毒感染MSCs 48 h后GFP及miR-26b的表达情况 ×400

图3 miR-26b对β-catenin、p-β-catenin(S33/S37/T41)、activated β-catenin蛋白及Wnt/β-catenin下游靶基因c-Myc、Runx2的影响
2.4 miR-26b在不同分化状态 MSCs中差异性表达在诱导分化7 d(B点)左右,MSCs逐渐失去其原有长梭形形态,向中心收缩、变短、变圆,诱导至14 d(C 点)左右,呈现多边形或立方体形、核仁椭圆的肝细胞样形态。诱导分化至21 d,细胞形态一致,立体感更强,边界清晰,更为典型。免疫组化检测,随着分化时间的增加,细胞甲胎蛋白和角质蛋白19逐渐呈阳性表达。见图6。qRT-PCR检测诱导分化至7 d(B点)以后,细胞miR-26b表达开始增高,B、C、D点较分化前(A点)差异有统计学意义(P<0.05)。见图7。
2.5 miR-26b促进不同分化状态MSCs趋化迁移经过6 h Transwell趋化迁移实验,在显微镜100倍视野观察迁移至小室下侧的细胞数。分化至7 d的MSCs趋化迁移能力最强,较0、14、21 d组有差异;相同分化时间点,miR-26b组较Ad组迁移能力更强。见表2、图8。
经过6 h Dunn chamber迁移实验,分化至7 d(B点)组的MSCs平均迁移速率最高,较0、14、21 d组有差异;相同分化时间点,miR-26b组较Ad组迁移速率更高。见表3。
3 讨论
本实验探索了SD大鼠骨髓来源的MSCs在成肝样分化过程中,不同分化阶段以及在高表达miR-26b状态下的趋化迁移特点。MSCs由于具有多向分化潜能,近年来MSCs移植治疗给包括急慢性肝损伤和终末期肝病在内的许多疑难疾病患者带来了新的希望。骨髓来源的MSCs因其具有容易获得,易于扩增,体外多代次传代培养生物学特性稳定等特点[6],加之如果用于自身,不用担心外源性病毒或肿瘤等的污染,更适合自体移植[7]。肝损伤后的自我修复过程中,包括HGF在内的许多炎症因子表达增高。本研究显示HGF能促进MSCs向病变部位的迁移,并促进其分化,这与Valente et al[8]和Shams et al[9]的研究结果一致。细胞移植中MSCs归巢的数量与其迁移的能力密切相关,而归巢的MSCs数量又与疗效呈正比[10]。体内实验研究证实只有少量MSCs迁移到了病变或损伤部位,疗效非常有限。因此,提高 MSCs的分化和定向迁移能力,增加定植到损伤或病变部位的移植细胞数量,更好地发挥其独特的生物学优势,对改善疗效至关重要。

图4 miR-26b对MSCs FA大小的影响 ×1 000

表2 miR-26b对不同分化状态MSCs趋化迁移的影响
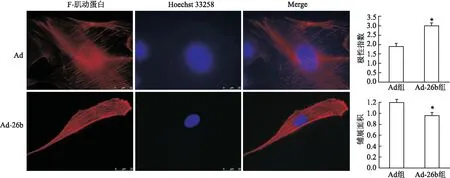
图5 miR-26b对MSCs铺展面积、极性指数的影响 ×1 000与Ad组比较:*P<0.05

图6 MSCs成肝样诱导分化不同分化状态细胞形态及甲胎蛋白和角质蛋白19的表达 ×200

图7 MSCs成肝样诱导分化不同分化状态miR-26b的表达

表3 miR-26b对不同分化状态MSCs迁移速率的影响

图8 miR-26b对不同分化状态MSCs趋化迁移的影响 ×100
Wnt/β-catenin信号通路与MSCs的迁移密切相关。文献[11]报道,β-catenin入核是Wnt/β-catenin信号活化的重要标志。本研究显示miR-26b高表达后可激活β-catenin (ABC),促进其表达,并抑制Ser33/37/Thr41位点磷酸化的β-catenin的表达,从而使β-catenin的降解受到抑制,说明在MSCs中高表达miR-26b可激活Wnt/β-catenin 信号。Wnt/β-catenin信号通路激活后,β-catenin入核并结合TCF/LEF实现对下游靶基因的调控,从而影响各种生命活动。RT-qPCR结果显示高表达miR-26b促进了c-Myc和Runx2的表达。所有这些结果都表明在MSCs中高表达miR-26b确实能够激活Wnt/β-catenin信号通路,从而促进MSCs趋化迁移。
项目组还采用了成肝样分化不同阶段的MSCs作为研究对象,显示在不同分化阶段,miR-26b的表达量不尽相同。在前期的研究中,用基因芯片筛选出十几个差异表达的miRNAs,其中包括表达上调的miR-26b。经定量PCR进一步验证和下游信号分析表明miR-26b确实参与MSCs定向迁移的调控[5]。FA在细胞迁移的过程中始终处于一个组装-解聚-再组装的动态过程中,而细胞迁移的状态与FA在细胞中的分布及大小密切相关[12]。FA由多种FA相关蛋白如桩蛋白及黏着斑激酶(FAK)等组装形成[13]。miR-26b通过影响与MSCs迁移相关的片状伪足中FA的大小以及MSCs铺展面积、极性指数来调控迁移。高表达miR-26b使MSCs细小FA数目增多,细小FA向细胞的前端周边分布。说明miR-26b影响FA的大小及分布;同时使MSCs细胞面积变小,极性指数增大,细胞呈现极性分布,这些都为提高MSCs的迁移能力提供了条件[14]。本研究显示分化早期(7 d)的MSCs其趋化迁移能力最强,且迁移能力的强弱与miR-26b呈正相关。通过提高miR-26b的表达,可进一步提高MSCs的趋化迁移能力[15]。这为制备迁移能力更强的MSCs提供了实验依据,为临床MSCs移植采用何种分化状态的细胞提供了参考。本研究表明miR-26b有助于促进MSCs成肝样分化。但体内外由于微环境差异巨大,体外实验可能并不能完全反映体内的情况,项目组后续将从体内动物实验进一步明确miR-26b对MSCs的迁移、分化的影响,以期为MSCs对临床肝病乃至其他疾病的治疗提供实验参考。
