5-氮杂-2′-脱氧胞苷对人甲状腺乳头状癌细胞DNA甲基化及DAPK基因表达的影响
2021-01-18梁书卿孙洪莉王晓艳李冉浩马玉博
梁书卿,魏 枫,孙洪莉,郑 朦,王晓艳,李冉浩,马玉博
甲状腺癌是内分泌系统中最常见的恶性肿瘤,在过去几十年的发病率呈逐年上升趋势[1]。肿瘤的发生涉及基因的多种复杂变化及基因表型的改变,其中,表观遗传学改变在肿瘤的发生发展中起了重要的作用,DNA甲基化是一种由DNA甲基转移酶(DNA methyltransferases,DNMTs)介导的化学修饰,与肿瘤的发生发展密切相关[2-4]。死亡相关蛋白激酶基因(death-associated protein kinase,DAPK)启动子区域甲基化促进多种肿瘤的发生,但在甲状腺乳头状癌上少有报道,是目前研究的热点之一[5-6]。因此,抑制DNMTs可能作为治疗甲状腺癌的靶点,5-Aza-CdR是一种甲基转移酶抑制剂,研究[7-8]显示该药已经成功作用于肺癌、白血病等肿瘤,而在甲状腺癌中作用尚不清楚。该文以甲状腺乳头状癌细胞系及甲状腺正常细胞系为研究对象,通过体外给予5-Aza-CdR来观察细胞系中DAPK、DNMT1、DNMT3A、DNMT3B mRNA和蛋白表达的情况,为研究甲状腺癌的发生发展机制及治疗提供理论依据。
1 材料与方法
1.1 材料人正常甲状腺细胞(Nthy-ori-3)、人甲状腺乳头状细胞(TPC-1)均购自复旦细胞库;去甲基化制剂5-Aza-CdR购自美国Sigma公司;1640培养基、胎牛血清、PBS均购自美国Gibco公司;反转录试剂盒购自日本Toyobo公司;一抗GAPDH、DNMT1、DNMT3A、DNMT3B均购自美国CST公司;DAPK抗体购自英国Abcam公司;抗兔辣根过氧化酶(HRP)Ig G二抗购自北京中杉金桥技术有限公司;引物均由上海生物技术公司合成;RealSYBR Mixture购自北京康为世纪生物科技有限公司。
1.2 方法
1.2.1Nthy-ori-3、TPC-1细胞的培养及细胞模型的制备 Nthy-ori-3、TPC-1细胞在含10%胎牛血清的1640培养基,37 ℃、 5%CO2孵育箱中培养,2~3 d传代。根据实验要求,将细胞分别接种于培养皿或孔板中,取对数生长期细胞进行下一步实验。培养Nthy-ori-3、TPC-1细胞,待其状态稳定,形态饱满,达到指数生长期,融合度约为60%~70%时换液,实验组加入10 μmol/L的5-Aza-CdR,对照组加入完全培养基继续培养,整个实验分为甲状腺正常细胞未加药组Nthy-ori-3(-)、甲状腺正常细胞加药组Nthy-ori-3(+)、甲状腺乳头状癌未加药组TPC-1(-)、甲状腺乳头状癌加药组TPC-1(+),继续置于37 ℃、5%CO2培养箱中培养48 h。
1.2.2Real-time PCR检测各组DAPK及DNMTs的mRNA表达 采用TRIzol 法提取各实验组细胞总RNA,使用NanoDrop-2000检测提取的RNA浓度,使用Toyobo反转录试剂盒按照说明书操作进行DNA反转录,在ABI7900上进行Real-time PCR,引物序列见表1。反应体系均为:Mix 10 μl,cDNA 2 μl;上下游引物各0.5 μl;去离子水7 μl;扩增均在不同的管中进行,扩增反应条件:95 ℃预变性5 min,95 ℃变性30 s(DAPK:59℃,DNMT1、DNMT3A、DNMT3B:60℃,GAPDH:59℃)退火30 s,72 ℃延伸30 s共40个循环,最后72 ℃继续5 min让反应充分,4 ℃暂时保存,实验重复3次。
所有反应设置3个复孔,目标基因的CT值通过GAPDH的CT值均一化,即ΔCT=CT目标-CTGAPDH,而目标基因mRNA相对丰度值以 ΔΔCT 值(DD value)表示,ΔΔCT=2-ΔCT。通过比较各组目标基因 ΔΔCT,分析其表达的变化。

表1 荧光定量RCR引物序列
1.2.3Western blot检测各实验组DAPK及DNMTs的蛋白表达 收集药物作用前后的细胞,用RIPA细胞裂解液(强)裂解细胞,提取各组蛋白,BCA蛋白定量法测提取蛋白的浓度。20 μg蛋白定量,用SDS-PAGE(5%~10%)分离,再转到PVDF膜上。用5%脱脂奶粉封闭1.5 h,加入一抗体(1 ∶1 000),4 ℃孵育过夜,再在与辣根过氧化物酶标记的二抗(1 ∶3 000)室温孵育2 h。每步完成都要用TBST洗涤3次,每次10 min。ECL发光液处理,图像通过Tanon-5800成像系统获得,以GAPDH为内参。

2 结果
2.1 Real-time PCR上机实验加样上机进行Real-time PCR实验,扩增曲线不同颜色代表4个分组:甲状腺正常细胞未给药组Nthy-ori-3(-)、甲状腺正常细胞给药组Nthy-ori-3(+)、甲状腺乳头状癌细胞未给药组TPC-1(-)、甲状腺乳头状癌细胞给药组TPC-1(+),曲线共同抬头于第20循环,反应良好,见图1。

图1 Real-time PCR扩增曲线图
2.2 Real-time PCR分析各组DNMTs mRNA的表达DNMT1、DNMT3A、DNMT3B的mRNA表达水平以GAPDH mRNA为内参得到各组相对值,与正常甲状腺细胞未给药组相比,甲状腺乳头状癌细胞未给药组的DNMT1、DNMT3A、DNMT3B的mRNA的表达量较高,差异有统计学意义(P<0.05)。与甲状腺乳头状癌细胞未给药组相比,甲状腺乳头状癌给药组经5-Aza-CdR处理48 h后,DNMT1、DNMT3A、DNMT3B的mRNA 表达量均下降(F=9.381、17.009、4.867,P=0.005、0.001、0.033),差异有统计学意义(P<0.05)。见图2。
2.3 Real-time PCR分析各组DAPK mRNA的表达Real-time PCR结果显示,各组DAPK mRNA的表达存在差异(F=10.790,P=0.003)。在人正常甲状腺细胞中DAPK表达甚少,且加药后无改变,差异无统计学意义(P=0.999);甲状腺乳头状癌细胞经5-Aza-CdR处理48 h后,DAPK基因mRNA的表达升高,差异有统计学意义(P=0.024)。见图3。

图2 各实验组甲基转移酶mRNA的相对表达量
2.4 Western blot分析各组DNMTs蛋白的表达Western blot结果显示,各组DNMT1、DNMT3A、DNMT3B蛋白水平表达存在差异(F=7.642,P=0.010;F=4.983,P=0.031;F=13.446,P=0.002)。正常甲状腺细胞无论给药前后,DNMTs的蛋白表达均无差异(P>0.05)。与人正常甲状腺细胞未给药组相比,甲状腺乳头状癌细胞未给药组中DNMT1、DNMT3A和DNMT3B的蛋白表达量高,差异有统计学意义(P<0.05)。与甲状腺乳头状癌细胞未给药组相比,5-Aza-CdR处理48 h后DNMT1、DNMT3A和DNMT3B的蛋白表达量下降,差异有统计学意义(P<0.05)。见图4。

图3 DAPK mRNA相对表达量
2.5 Western blot分析各组DAPK基因蛋白的表达Western blot结果显示,各组DAPK蛋白表达水平存在差异(F=7.954;P=0.009)。在正常甲状腺细胞中抑癌基因DAPK蛋白有表达,且加药前后无改变,差异无统计学意义(P=0.485);与正常甲状腺细胞未给药组相比,甲状腺乳头状癌细胞未给药组抑癌基因DAPK蛋白表达低,差异有统计学意义(P=0.006),经5-Aza-CdR处理48 h后,人甲状腺乳头状癌细胞中DAPK基因蛋白表达升高,差异有统计学意义(P=0.002)。见图5。
3 讨论
DAPK最早发现于1995年,是一种钙调蛋白(calmodulin,CaM)调节的丝氨酸/苏氨酸蛋白激酶,参与凋亡、自噬和炎症等多种细胞过程[9-10],是凋亡的正性调节因子之一。Jing et al[11]研究发现通过抑制miR-34a-5p阻止p53-DAPK轴的破坏,上调DAPK的表达,从而抑制肾透明细胞癌的进展。DAPK作为一种肿瘤抑制基因,其启动子区域GpG岛的高甲基化致使基因转录沉默而失去功能,参与肿瘤的发生发展。已经在乳腺癌、非小细胞肺癌、膀胱癌、胃癌、宫颈癌等肿瘤中发现DAPK基因启动子区域因不同程度的高甲基化导致其表达低。在哺乳动物细胞中, 目前已知有3种DNMT(DNMT1、DNMT3A、DNMT3B)参与了DNA的甲基化修饰过程,DNA 启动子区域GpG岛甲基化后并不会改变核酸的序列,只是部分碱基发生甲基化的修饰,因此基因的甲基化是一种可以被逆转的表观遗传学修饰过程。使用甲基转移酶抑制剂可以逆转启动区域的高甲基化,使DAPK重新表达[12-13]。徐雅娣 等[14]研究发现,DNMT1抑制剂通过调控增殖及侵袭相关蛋白的表达抑制胶质瘤细胞的增殖和侵袭。5-Aza-CdR是一种典型DNMT抑制剂,已经有研究[12,15-16]报道5-Aza-CdR通过沉默甲基转移酶诱导肺癌、乳腺癌、食管癌等细胞株的DAPK mRNA的重新表达。但是目前国内外尚未发现5-Aza-CdR作用在人甲状腺乳头状癌细胞株DAPK基因表达影响的相关报道。研究显示甲状腺乳头状癌细胞系TPC-1中DNMTs表达上调,其抑癌基因DAPK的表达水平很弱。使用去甲基化药物5-Aza-CdR处理TPC-1细胞后,DNMTs的mRNA及蛋白表达水平降低,而DAPK的mRNA及蛋白表达水平升高,提示5-Aza-CdR可能通过沉默甲基转移酶而降低抑癌基因DAPK启动子区域的甲基化水平从而诱导其重新表达。

图4 Western blot法检测各实验组甲基转移酶的蛋白相对表达量
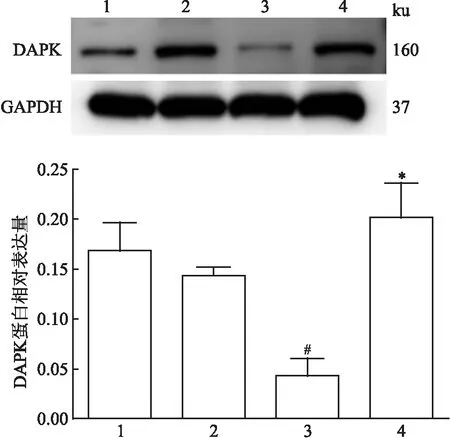
图5 Western blot法检测各实验组DAPK的蛋白相对表达量
综上所述,本研究结果表明DNMTs表达上调可能通过影响甲状腺乳头状癌细胞抑癌基因DAPK的过度甲基化,使其转录表达过程沉默,促进甲状腺乳头状癌的发生发展,5-Aza-CdR可以通过沉默甲基转移酶而诱导DAPK 的重新表达,进而发挥对甲状腺乳头状癌的防治作用。
