小菜蛾保幼激素受体PxMet-1和PxMet-2的原核表达、纯化及与保幼激素的结合模式
2021-01-12秦玉冬邹明民董诗杰刘莉莉尤民生
彭 露, 秦玉冬, 邹明民, 董诗杰,刘莉莉, 尤民生,*
(1. 福建农林大学, 闽台作物有害生物生态防控国家重点实验室, 福州 350002; 2. 福建农林大学应用生态研究所, 福州 350002;3. 福建农林大学, 教育部害虫生态防控国际合作联合实验室, 福州 350002;4. 福建农林大学, 福建省昆虫生态重点实验室, 福州 350002)
小菜蛾Plutellaxylostella属鳞翅目(Lepidoptera)菜蛾科(Plutellidae),是世界性的迁飞害虫,主要危害十字花科植物,如萝卜、薹菜、油菜、椰菜等(Ahujaetal., 2010)。研究证实,小菜蛾每年在全球范围内造成的损失和防治费约为40~50亿美元(Zaluckietal., 2012; Furlongetal., 2013),而每年在我国造成的损失和防治费则高达7亿美元(Lietal., 2016)。在生产上人们采用了包括化学防治和生物防治在内的各种防控方法,但效果仍不明显。因此,寻求快速有效的控制小菜蛾危害的新方法亟不可待。
保幼激素(juvenile hormone, JH)作为一种亲脂性的倍半萜类激素(Röller and Dahm, 1967),控制着昆虫各个生长发育阶段,对昆虫发育变态的转换起着重要作用,能直接作用于昆虫生殖发育过程(Wyatt and Davey, 1996; Feietal., 2005),也参与了昆虫其他生理活动,如迁飞、营养利用、表型变化以及级型分化等(Sunetal., 2013; Xuetal., 2013; Mirthetal., 2014)。虽然JH是调控昆虫生理过程最为重要的激素之一,但对其分子调控机制的研究仍然相对匮乏,主要受制于JH核受体的鉴定(周树堂等, 2012)。近年来,越来越多的证据显示,烯虫酯耐性(methoprene-tolerant, Met)蛋白是JH的核受体(Charlesetal., 2011; Jindraetal., 2013)。
Met属于basic-helix-loop-helix (bHLH)/Per-Arnt-Sim (PAS)转录因子家族成员(Ashoketal., 1998),包括一段碱性DNA结合域的氨基酸序列(basic region)、一个螺旋-环-螺旋结构(helix-loop-helix)、两个空间可变的PAS结合域(PAS-A, PAS-B)和一个C末端(PAC)。已有研究表明,Met在昆虫各个生理过程中具有重要作用,如控制昆虫变态发育(Konopova and Jindra, 2007)与翅型分化(Lozano and Belles, 2014),调控昆虫卵巢发育、卵子形成、胚胎发育,产卵量以及交配行为等(Bilenetal., 2013; Guoetal., 2014; Marchaletal., 2014; Smykaletal., 2014; 彭露等, 2019)。Met通常以非共价形式与自身形成同质二聚体存在于真核细胞中,在果蝇中发现了第一个Met与Met,以及Met与其同源蛋白Gce形成的同质二聚体(Godlewskietal., 2006)。然而当JH存在时,Met形成的同质二聚体需要解离,与该家族其他成员聚合成异质二聚体,才能形成一个具有活性的转录因子,从而传递JH调控信号(Charlesetal., 2011; Jindraetal., 2013)。不同种类昆虫以及同种昆虫中Met结合的bHLH-PAS家族成员类型可能并不相同,例如在家蚕Bombyxmori、蝗虫与赤拟谷盗Triboliumcastaneum中,在JH信号作用下,Met可与同家族的steroid receptor co-activator(SRC)形成异质二聚体调控JH通路下游基因的表达,从而调节其变态发育或生殖过程(Zhangetal., 2011; Kayukawaetal., 2012; Guoetal., 2014)。然而,埃及伊蚊AedesaegyptiMet与FISC(Ftz-F1-interacting steroid receptor coactivator)形成二聚体复合物调控下游基因表达(Lietal., 2011, 2014)。Shin等(2012)还发现,在JH信号作用下,埃及伊蚊Met蛋白与bHLH-PAS家族的Cycle蛋白形成异质二聚体,与kr-h1基因启动子上游的调控元件E-box-like基序结合,实现对kr-h1的表达调控,从而调节其生活节律。
迄今,对于Met蛋白的研究主要集中在模式昆虫中,在小菜蛾中仍为空白。本研究对小菜蛾Met蛋白PxMet-1与PxMet-2进行了原核表达与纯化,并利用分子对接技术解析了PxMet-1与PxMet-2与JH的结合模式,这将对筛选、鉴定及分析小菜蛾Met互作蛋白及其功能,深入阐明JH调控小菜蛾生殖发育的分子机理具有重要意义。
1 材料与方法
1.1 供试昆虫及饲养
供试昆虫为敏感品系小菜蛾,其原始种群于2004年采自福建省福州市晋安区新店镇菜地(26.08°N, 119.28°E),经过室内的长期连续继代培养,期间不使用任何农药,饲养环境为温度25±1℃、相对湿度(RH)70%~80%、光周期 16L∶8D,羽化后的小菜蛾成虫采用蜂蜜水喂养,并放在塑料瓶中进行交配产卵。孵化的小菜蛾幼虫在生长一周的萝卜Raphanussativus(福州立信种苗)苗上取食,萝卜苗种在人工气候室,室内温度为 25±1℃,相对湿度约为75%,期间不使用任何农药。
1.2 小菜蛾Met基因的克隆验证
从NCBI数据库(http:∥www.ncbi.nlm.nih.gov/)下载已经克隆鉴定的小菜蛾PxMet-1(GenBank登录号: MK697672)和PxMet-2(GenBank登录号: MK697673)开放阅读框(ORF)全长序列(彭露等, 2019),使用Primer Premier 5.0软件设计引物(表1),由尚亚生物技术(福州)有限公司合成。
选取5~8头初羽化小菜蛾雌成虫,置于灭菌后的2 mL离心管中,经过液氮处理后采用Promega的RNA提取试剂盒提取总RNA。取1 μL产物用分光光度计测定RNA的浓度和质量,并通过2%琼脂糖凝胶电泳检测RNA样品的完整性,把合格的RNA样品置于-80℃超低温冰箱冻存备用。提取的总RNA采用Vazyme公司的HiScript II Q RT SuperMix for qPCR(+gDNA wiper)试剂盒进行逆转录反应合成cDNA第1链,于-20℃保存备用。
以合成的cDNA为模板,使用Vazyme公司的Super-Fidelity DNA Polymerase高保真酶,分别以Met-1 F1/Met-1 R1和Met-2 F1/Met-2 R1为引物扩增PxMet-1基因序列和PxMet-2序列片段1; 随后用PxMet-2序列片段1连接pJET1.2载体的质粒为模板,以Met-2 F2/Met-2 R1为引物扩增获得PxMet-2序列片段2,最后用PxMet-2序列片段2连接pJET1.2载体的质粒为模板,以Met-2 F3/Met-2R1为引物扩增获得全长PxMet-2基因序列(表1)。反应体系: 2×Phanta Max Buffer 12.5 μL, cDNA模板1 μL, dNTP Mix(10 mmol/L)0.5 μL, 上下游引物(10 μmol/L)各1 μL, Super-Fidelity DNA Polymerase(1 U/μL)0.5 μL, 最后用ddH2O补足25 μL。PCR反应程序: 98℃预变性5 min; 98℃变性30 s, 55℃(PxMet-1)/65℃(PxMet-2)分别退火30 s, 72℃分别延伸1.5 min(PxMet-1)/2 min(PxMet-2),共34个循环; 72℃延伸10 min。 反应结束后,取5 μL PCR产物进行1%琼脂糖凝胶电泳(120 V, 20 min),利用试剂盒(OMEGA, 美国)纯化回收目的片段,把胶回收的产物利用pJET1.2克隆载体(50 ng/μL)试剂盒进行连接,并转化至50 μL大肠杆菌EscherichiacoliDH5α感受态细胞(天根),随后接种至带有氨苄抗生素的LB固体培养基中培养,37℃过夜培养,随机挑取多个单克隆进行PCR验证,鉴定阳性结果后送铂尚生物技术(福州)有限公司测序。

表1 本研究所用引物
1.3 序列分析与系统进化树构建
通过SnapGene对测序获得的序列与NCBI上小菜蛾Met进行比对;利用Expasy(https:∥web.expasy.org/cgi-bin/translate/dna2aa.cgi)预测开放阅读框;应用SMART(http:∥smart.embl-heidelberg.de/)鉴定PxMet-1和PxMet-2蛋白的保守结构域;通过同源建模的SWISS-MODEL(https:∥swissmodel.expasy.org/)和穿线法的I-TASSER(https:∥zhanglab.ccmb.med.umich.edu/I-TASSER/)构建蛋白三维模型。
1.4 PxMet-1和PxMet-2蛋白的原核表达
利用克隆获得的PxMet-1和PxMet-2全长序列,设计带有EcoR I和SacI酶切位点的PxMet-1特异性引物和带有XhoI和Hind III酶切位点的PxMet-2特异性引物(表1),并在下游引物末端加上His标签。利用Met-1-EcoRI F/Met-1-SacI R和Met-2-Xho I F/Met-2-Hind III R引物(表1),以pJET1.2-PxMet-1和pJET1.2-PxMet-2质粒为模板进行PCR扩增,反应体系和程序同1.2节。用对应的限制性内切酶酶切后回收,连接至pGEX-KG载体,把上述的连接产物pGEX-KG-PxMet-1和pGEX-KG-PxMet-2分别转化到大肠杆菌BL21(DE3)表达感受态细胞中,进行菌落PCR,以菌液为模板,用通用引物T7-F和T7-R(表1)进行菌液PCR验证。取含有重组质粒的保存菌液,按1%的接种量接种到新鲜的含有50 μg/mL Amp的LB液体培养基中37℃过夜活化;取活化菌液按1∶100比例加入到1 000 mL的上述培养基中,保持37℃,待OD600=0.6~0.8时加入不同浓度的IPTG进行诱导表达(PxMet-1: 0.3 mmol/L IPTG在16℃下诱导16 h; PxMet-2: 0.1 mmol/L IPTG在16℃下诱导16 h)。重组菌体经超声波破碎后(新芝超声破碎仪,频率200 Hz,超声破碎2 s,间歇4 s,总时间30 min), 4℃, 14 000 r/min, 30 min离心分别收集上清和沉淀。10% SDS-PAGE检测融合蛋白。
1.5 PxMet-1和PxMet-2融合蛋白的纯化与鉴定
使用AKTA pure 25蛋白纯化系统,并选择His和GST 标签进行纯化。pGEX-KG-PxMet-1与pGEX-KG-PxMet-2纯化分别使用His TrapTMHP 5 mL(GE Healthcare,美国)与GST TrapTMHP 5 mL(GE Healthcare,美国)柱子纯化。分别使用咪唑溶液(浓度梯度为0, 20, 150和500 mmol/L)和还原型谷胱甘肽溶液(20 mmol/L)洗脱PxMet-1与PxMet-2融合蛋白。洗脱出的PxMet-1与PxMet-2融合蛋白分别用30与50 kD的超滤管浓缩脱盐(Millipore,美国)。最后对纯化的蛋白进行SDS-PAGE检测和Western blot验证,Western blot验证分别使用His和GST标签蛋白抗体,纯化的蛋白用Solarbio的BCA蛋白浓度测定试剂盒测定融合蛋白浓度。
1.6 PxMet-1和PxMet-2与保幼激素的结合模式分析
把PxMet-1和PxMet-2序列放到在线同源建模网站预测,找到相似度最高的同源模板PDB,利用该模板到薛定谔软件中进行同源建模(Jacobsonetal., 2004),在ChemDraw软件中画出JH I, JH II和JH III 3种保幼激素的结构式,把其结构式小分子文件放到薛定谔软件中与构建的蛋白模型进行分子对接(Linetal., 2018)。参考已报道的赤拟谷盗Met与JH结合位点(Charlesetal., 2011),利用软件预测PxMet的分子对接口袋。
2 结果
2.1 PxMet-1和PxMet-2克隆验证
PCR克隆验证结果显示,克隆获得的PxMet-1和PxMet-2全长cDNA序列分别为1 575和2 100 bp(图1),与NBCI数据库记载的序列长度一致。比对分析显示,PxMet-1测序结果与原序列核苷酸一致性为100%,PxMet-2(GenBank登录号: MT996234)测序结果与原序列存在1个非同义突变,突变位点为第41位氨基酸,由甘氨酸(Gly)突变为丙氨酸(Ala)(图2),核苷酸序列一致性为99.9%。
2.2 PxMet-1和PxMet-2的三维结构
从SWISS-MODEL和I-TASSER预测的三维结构(图2)可以看出两种方法预测出的蛋白模型结构都相似,且PxMet-1与PxMet-2蛋白都包含典型的螺旋-环-螺旋结构(helix-loop-helix)。

图1 小菜蛾PxMet-1(A)和PxMet-2(B)基因克隆
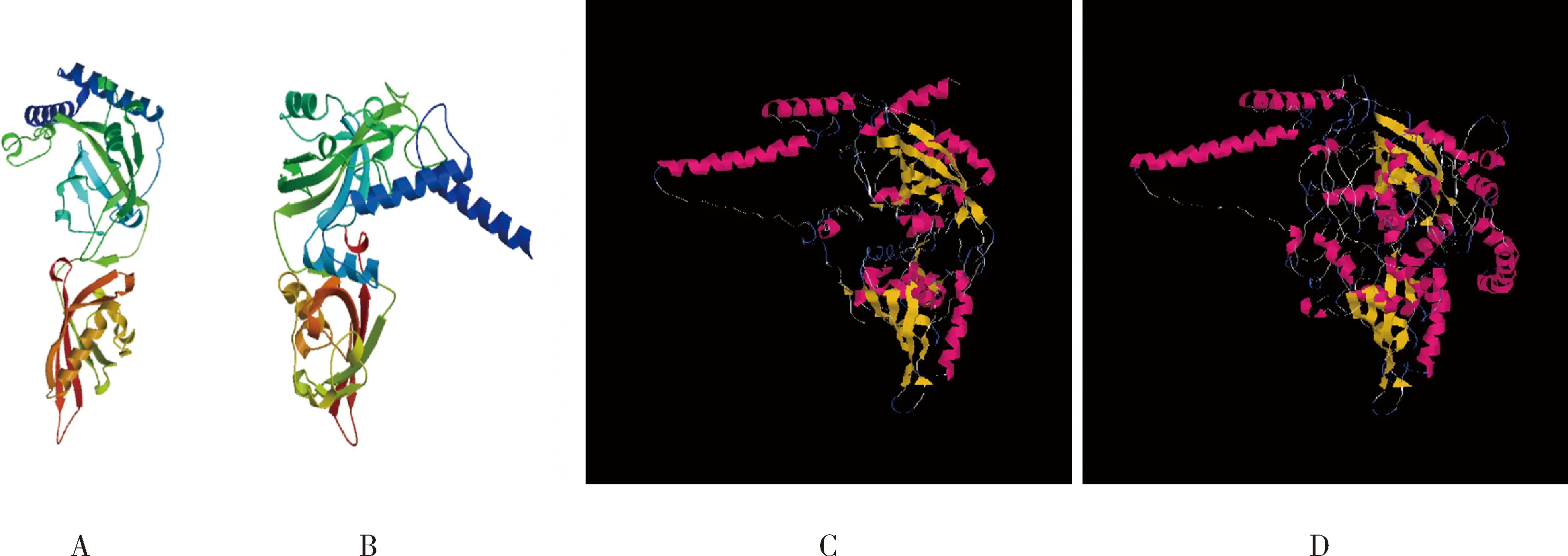
图2 小菜蛾Met蛋白三级结构预测
2.3 PxMet-1和PxMet-2的原核表达
菌液PCR检测结果显示,构建的pGEX-KG-PxMet-1和pGEX-KG-PxMet-2重组质粒均获得预期大小的条带,阳性克隆子测序结果也与构建的重组载体序列一致(图3)。
pGEX-KG-PxMet-1表达产物成熟肽部分的核苷酸序列含有2 325个碱基,编码774个氨基酸,记作PxMet-1融合蛋白,预测分子质量为89.2 kD;pGEX-KG-PxMet-2表达产物成熟肽部分的核苷酸序列含有2 859个碱基,编码952个氨基酸,记作PxMet-2融合蛋白,预测分子质量为106 kD;两个融合蛋白均包括GST和His标签蛋白。不同条件的诱导表达,结果显示,PxMet-1与PxMet-2融合蛋白分别在0.3和0.1 mmol/L IPTG 16℃诱导16 h表达量最高。SDS-PAGE电泳结果显示,pGEX-KG-PxMet-1与对照(pGEX-KG)相比在89.2 kD处多一条条带,且与PxMet-1融合蛋白大小一致;而pGEX-KG-PxMet-2与对照相比在106 kD处多一条条带,且与PxMet-2融合蛋白大小一致,表明构建的原核表达系统可以实现PxMet-1与PxMet-2融合蛋白的原核表达(图4: A)。
把收集的菌体用超声波破碎后分别取上清和沉淀进行SDS-PAGE表达检测,结果显示,上清和沉淀中均检测到对应大小的PxMet-1与PxMet-2融合蛋白条带(图4: B),说明两种蛋白在上清和沉淀中都有表达。我们选择上清中的蛋白进行纯化分析。
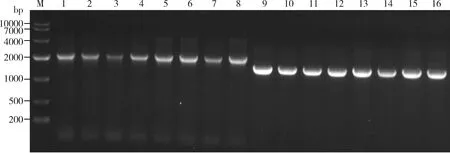
图3 重组质粒pGEX-KG-PxMet-1和pGEX-KG-PxMet-2转化大肠杆菌BL21菌液PCR
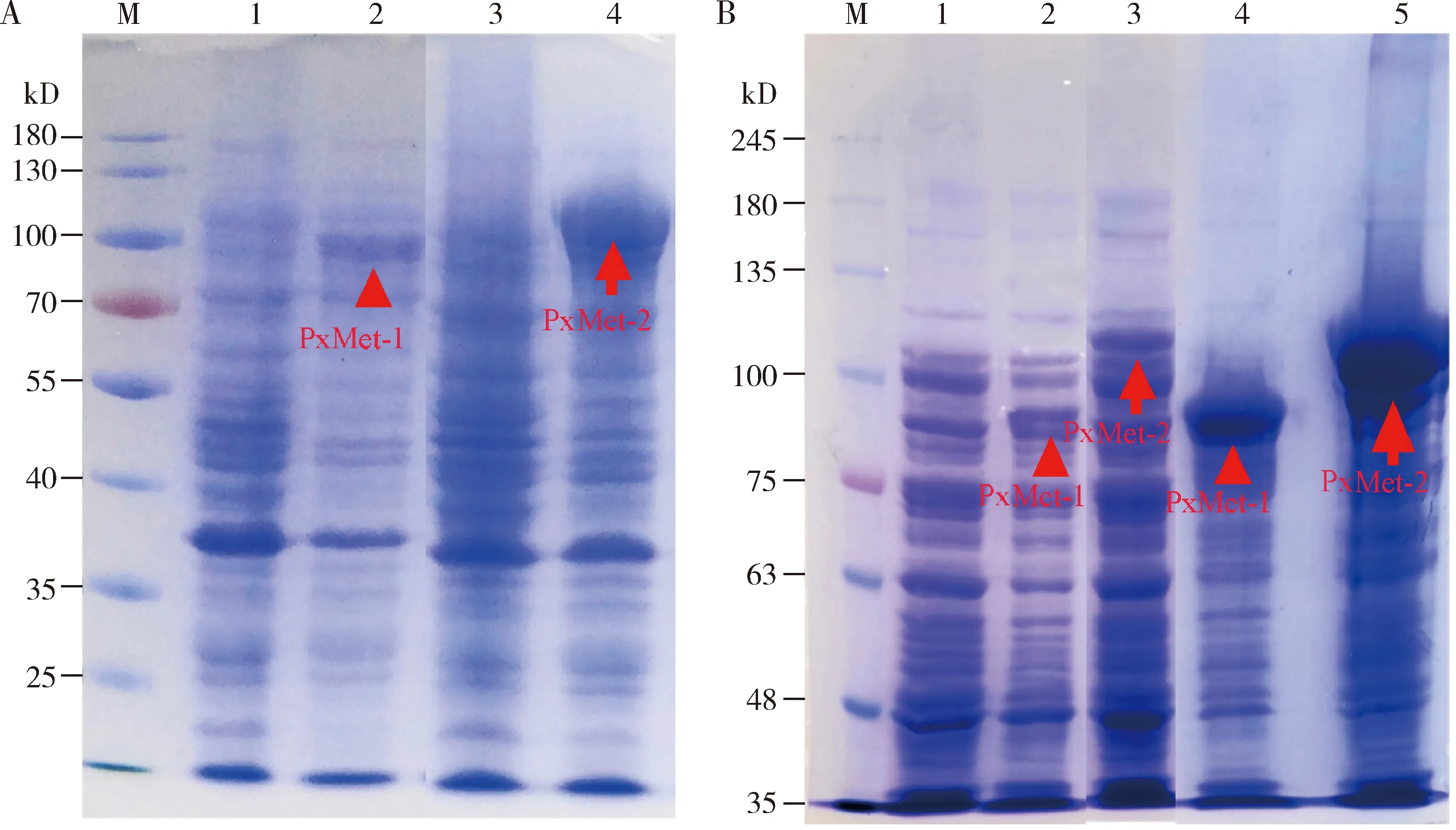
图4 小菜蛾融合蛋白PxMet-1和PxMet-2的诱导表达
2.4 PxMet-1和PxMet-2融合蛋白的纯化
PxMet-1融合蛋白使用HisTrapTMHP 5 mL柱子进行纯化,结果表明,不同浓度咪唑都能把PxMet-1融合蛋白洗脱下来,其中在150 mmol/L咪唑浓度下,被洗脱下来的融合蛋白纯度最高(图5: A)。PxMet-2融合蛋白使用GSTTrapTMHP 5 mL柱子进行亲和层析,结果显示,使用20 mmol/L还原型谷胱甘肽洗脱时,被洗脱下来的融合蛋白纯度最高(图5: B)。
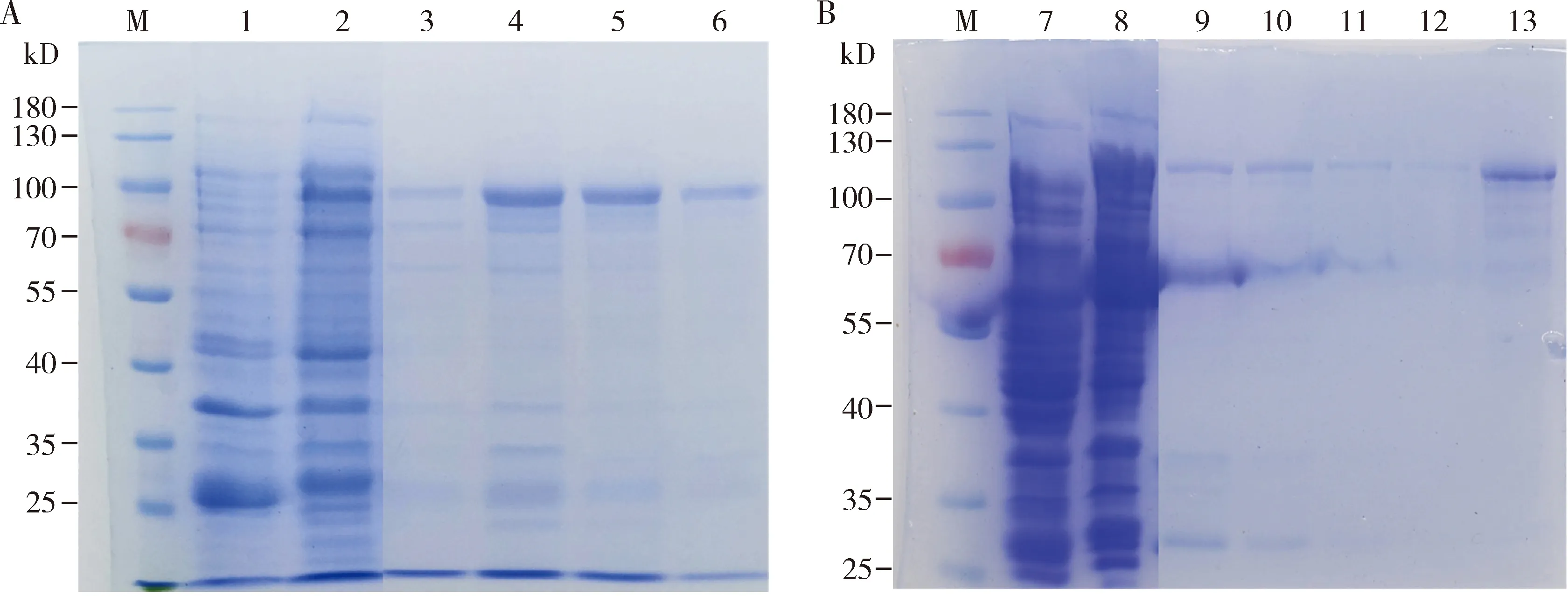
图5 小菜蛾PxMet-1(A)和PxMet-2 (B)融合蛋白纯化的SDS-PAGE检测
2.5 PxMet-1和PxMet-2融合蛋白的鉴定
纯化的融合蛋白进行SDS-PAGE检测和Western blot验证。SDS-PAGE结果显示,PxMet-1和PxMet-2分别纯化获得单一的目的蛋白条带,条带大小与预期的结果相符(图6: A, B);Western blot结果显示PxMet-1和PxMet-2融合蛋白分别在89.2与106 kD位置获得条带(图6: C, D),表明纯化获得的蛋白为PxMet-1和PxMet-2的融合蛋白。用BCA蛋白浓度测定试剂盒测定蛋白浓度,纯化的蛋白浓度都大于1 mg/mL。

图6 小菜蛾PxMet-1和PxMet-2融合蛋白SDS-PAGE (A, B)和Western blot (C, D)验证
2.6 PxMet-1和PxMet-2与JH的结合模式
分子对接口袋预测结果显示,PxMet-1与PxMet-2的分子对接口袋分别为: PxMet-1: 341Phe, 307Thr, 309His, 350Val, 354Leu和333Val; PxMet-2: 358Leu, 354Val, 311Thr, 313His, 392Thr, 337Val和345Phe。
随后我们选择了常见的JH I, JH II和JH III 3种分子与PxMet-1和PxMet-2分别进行分子对接。对接分数反映了小分子和靶标蛋白结合的强弱。结果显示,PxMet-1和PxMet-2与3种JH分子都存在结合作用,其中PxMet-1与JH II结合作用最强,结合分数为-10.746,而PxMet-2与JH I结合作用最强,其结合分数为-9.469。分子对接分析结果还显示,为PxMet-1和PxMet-2与JH存在相互作用位点(如图7和8中紫色箭头所示),所有位点均在对接口袋内,且位于PAS-B保守结构域,与已报道的赤拟谷盗Met与JH结合位点(Charlesetal., 2011)相同,推测PxMet蛋白同样也是小菜蛾JH分子的作用受体。
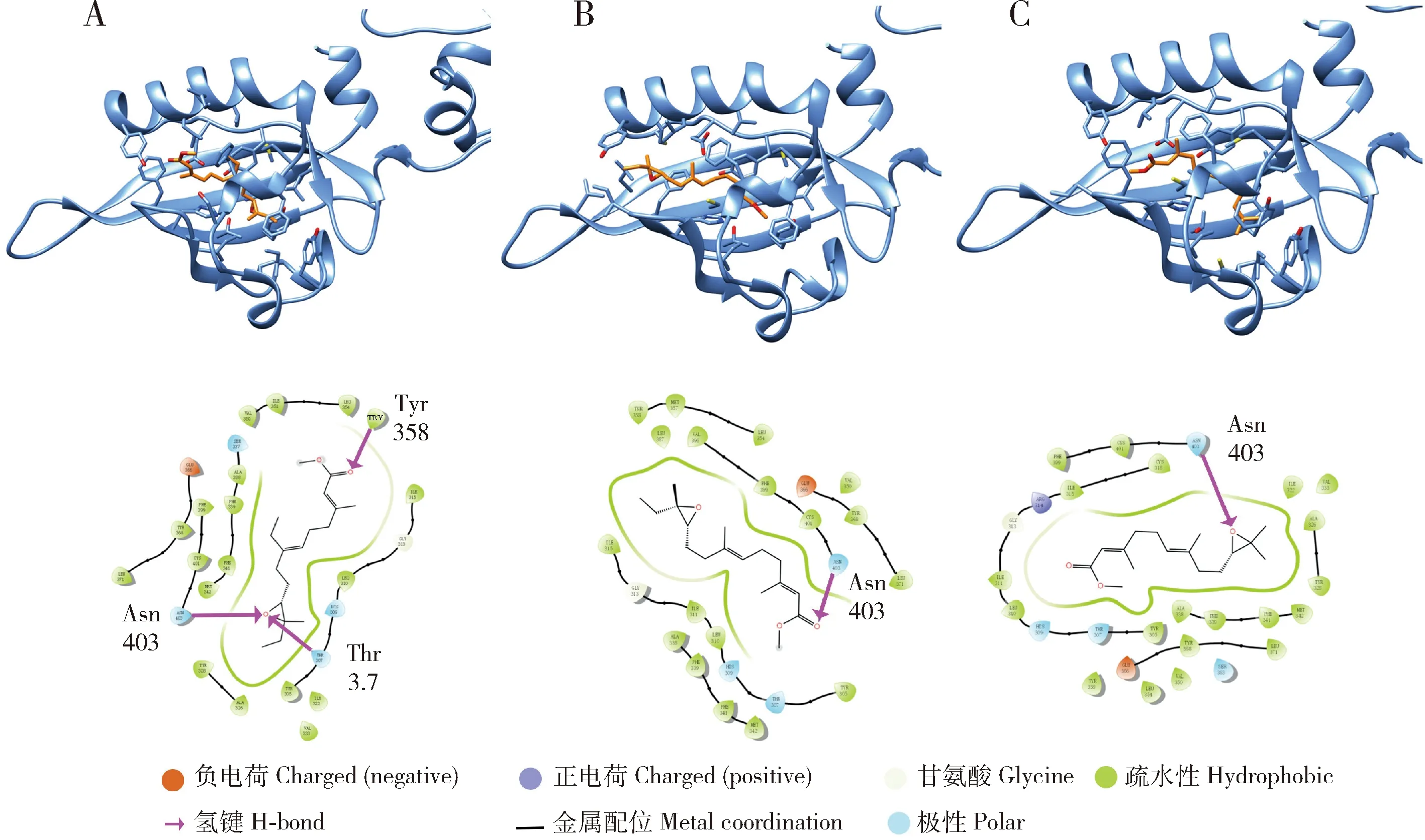
图7 分子对接分析小菜蛾PxMet-1与JH的结合模式
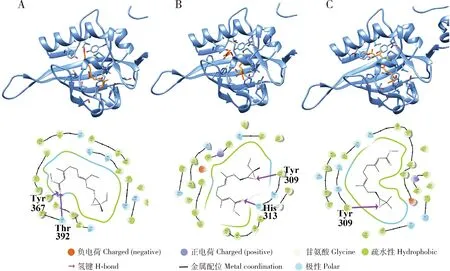
图8 分子对接分析小菜蛾PxMet-2与JH的结合模式
3 讨论
本研究通过克隆验证小菜蛾PxMet-1和PxMet-2基因,与NCBI数据库记载的序列相比对(彭露等, 2019),PxMet-1与原记载序列的核苷酸序列一致性为100%,PxMet-2仅在第41位氨基酸由Gly突变为Ala,与原记载序列的核苷酸序列一致性高达99.9%,说明我们获得的序列信息准确,可用于后续的载体构建。蛋白结构分析显示,PxMet-1和PxMet-2与其他已知昆虫Met蛋白一致,都具有该家族的保守结构域(Konopova and Jindra, 2007; Lietal., 2011; Suetsuguetal., 2013; Linetal., 2015),表明小菜蛾Met基因在进化过程较为保守。其中,bHLH结构域主要是真核生物的转录因子,具有与DNA结合的作用,并在生物的一系列生理过程中发挥着决定性作用;PAS蛋白主要参与K+通道信号传递,PAS结构域是一个信号敏感域,可以促进PAS蛋白之间或与其他核受体蛋白的相互作用,PAC结构域则与PAS结构域的折叠有关(Ashoketal., 1998; Miuraetal., 2005; Jindraetal., 2013),由此我们推测小菜蛾Met基因与其家族其他成员一样主要在转录调节中发挥作用。同时利用SWISS-MODEL与I-TASSER构建蛋白模型,结果显示,这两种方法构建的PxMet蛋白模型结构相似,都包含典型的螺旋-环-螺旋结构,说明我们构建的蛋白模型可信度较高,可以用于后续的蛋白结构与结合特性分析(Linetal., 2018)。
本研究构建了PxMet-1和PxMet-2蛋白的原核表达载体pGEX-KG-PxMet-1和pGEX-KG-PxMet-2,并转至大肠杆菌BL21(DE3)感受态细胞表达菌株,PxMet-1与PxMet-2分别通过0.3与0.1 mmol/L IPTG诱导表达。SDS-PAGE电泳结果显示,pGEX-KG-PxMet-1和pGEX-KG-PxMet-2分别在89.2与106 kD 处产生特异性条带,且符合推测大小,表明PxMet-1与PxMet-2融合蛋白已被成功表达,且在上清和沉淀中都有表达。最后分别利用HisTrapTMHP与GSTTrapTMHP柱亲和层析纯化获得高纯度PxMet-1与PxMet-2融合蛋白,为进一步的互作蛋白筛选与功能研究奠定了基础。
在PxMet与JH的结合模式分析过程中,我们选择了常见的JH I, JH II和JH III进行分子对接分析。我们发现,Met蛋白通过PAS-B结构域形成具有较高亲和力的口袋型来结合JH,这与其他的研究结果(Miuraetal., 2005; Charlesetal., 2011; Jindraetal., 2013)较一致,也与PAS结构域可以促进PAS蛋白之间或与其他核受体蛋白的相互作用结论一致,由此我们推测,PxMet-1与PxMet-2蛋白同样也是小菜蛾JH分子的作用受体。前期研究证实,PxMet-1与PxMet-2具有龄期表达偏好性,PxMet-1与PxMet-2分别在蛹期与成虫期相对高表达(彭露等, 2019)。Jindra等(2013)表明,JHⅠ和JHⅡ是鳞翅目特有的,幼虫咽侧体只分泌这两种化合物,而成年雌性咽侧体除了产生JHⅠ和JHⅡ外还产生JHⅢ。我们的研究发现,PxMet-1与JH II结合作用最强,PxMet-2与JHⅢ结合作用最强,说明PxMet-1与PxMet-2作用的时期,以及分子机制并不相同。
本研究进一步克隆验证了小菜蛾Met基因PxMet-1和PxMet-2的全长序列,解析了PxMet-1和PxMet-2的三维结构,并完成了PxMet-1和PxMet-2的原核表达与纯化,最后分析了PxMet-1和PxMet-2与JH的结合模式,为阐明JH调控小菜蛾发育与生殖过程的分子信号途径提供了初步的依据。PxMet-1与 PxMet-2的互作蛋白筛选,以及它们介导的分子调控机制仍有待我们进一步研究。
