Au@Fe3O4 固定化氯过氧化物酶研究*
2021-01-08高丰琴陈晓丽郭向宇
高丰琴,陈晓丽,郭向宇,牟 萱
(1.咸阳师范学院 化学与化工学院,陕西 咸阳 712000;2.陕西师范大学 化学化工学院,陕西 西安 710062)
生物酶因其独特的催化性能被广泛应用,生物酶的固定化也由于能提高生物酶的操作稳定性、对催化环境的耐受性及重复使用性等在很多研究领域中被持续关注[1]。在固定化酶研究方面,载体的选择关系着固定化的成败及固定化酶的使用效果。纳米金粒子因其具有独特的光学性质、化学活性、电学性质和良好的生物相容性等优点[2],且纳米金粒子易与蛋白分子中游离的氨基和巯基作用,可通过表面的疏水作用及静电作用等将蛋白固定在表面。这种生物快速固定化的特点使纳米金粒子在生物传感、固定化酶催化等诸多领域有着广泛的应用前景[3,4]。磁性Fe3O4纳米粒子由于其形状各向异性、易于磁场调节和独特的磁性能,同样有着广泛的应用前景。
但磁性Fe3O4的理化性质容易受到外界环境的影响(比如被酸碱破坏或被氧化变质等)而降低了其在使用过程中的稳定性。与此同时,磁性Fe3O4纳米粒子具有非常活跃的表面,可以方便地吸附贵金属,而且Fe3O4能有效地提高贵金属的稳定性和可重复使用性[5]。因此,在磁性Fe3O4纳米粒子上包覆一层金,可以改善其生物相容性和稳定性,防止氧化且使表面易于功能化[6]。
本文合成了具有磁性吸附性能和良好生物相容性的Au@Fe3O4复合载体材料,通过亲和素-生物素的特异性结合固定化氯过氧化物酶。通过优化Au@Fe3O4固定化酶时温度、时间和缓冲溶液pH 值条件,使固定化达到最大固载量。研究中以2-氯-5,5-二甲基-1,3-环己二酮的氯化反应为模型反应,考察固定化酶的重复使用性,为固定化酶的使用提供一定理论研究基础。
1 实验部分
1.1 试剂与仪器
氯过氧化物酶(陕西师范大学大分子科学陕西省重点实验室提供);2-氯-5,5-二甲基-1,3-环己二酮(Sigma-Aldrich 公司);生物素酰肼(苏州昊帆生物科技有限公司);链霉亲和素(北京索莱宝科技有限公司);FeCl3·6H2O、FeCl2·4H2O(天津市福晨化学试剂厂);盐酸羟胺、NaOH、K2HPO4、KH2PO4、HAuCl4(国药集团化学试剂有限公司);H3PO4、H2O2(西安化学试剂厂)。
UV-1750 型紫外可见分光光度计(岛津国际贸易上海有限公司);LSHZ-300 型冷冻恒温水浴振荡器(苏州市培英实验设备有限公司);D/Max2550VB+/PC 型 X 射线衍射仪(XRD)(日本理学公司)。
1.2 Au@Fe3O4 载体的制备
将 FeCl2·4H2O 和 FeCl3·6H2O 以 2.7∶1 的质量比溶解于蒸馏水中,通Ar 条件下向其中滴加NaOH溶液。反应1h 后,用超纯水反复洗涤固体,干燥研磨后得到 Fe3O4。取 8.0mg·mL-1的 Fe3O4种子悬浮液,加入0.1%的HAuCl4水溶液,振荡混合30min。然后加入0.2mol·L-1还原剂盐酸羟胺,反应1h 后经磁性分离即得到Au@Fe3O4复合纳米粒子。
1.3 Au@Fe3O4 固定化氯过氧化物酶
取0.25mg 金磁纳米粒子,加入1.0mg·mL-1链霉亲和素,加入pH 值为5.0 的K2HPO4-KH2PO4缓冲液1.0mL,超声10min 后即得到Au@Fe3O4固定化链霉亲和素。取2.7×10-7mol 的氯过氧化物酶(CPO)和1.90mg 的生物素酰肼溶于pH 值为 5.0 的缓冲溶液中配置成4.0mL 溶液,于室温中搅拌3h 后静置24h。得到的生物素标记CPO。
取0.25mg 上述已制备好的链霉亲和素功能化的Au@Fe3O4纳米粒子,向其中加入20μL 生物素标记的CPO,在冷冻恒温水浴振荡器中以200r·min-1反应一定时间,得到固定化CPO(Au@Fe3O4-CPO)。用紫外分光光度计测定固定化前后上清液在398nm的吸光度值,计算生物素标记CPO 在Au@Fe3O4纳米粒子表面的固载量。
1.4 固定化酶的重复使用性
CPO 酶活性通过催化2-氯-5,5-二甲基-1,3-环己二酮(MCD)生成2,2-二氯-5,5-二甲基-1,3-环己二酮(DCD)的氯化反应来测定[7]。Au@Fe3O4-CPO 固定化酶的重复使用性,用酶催化MCD 氯化反应来表征。对于固定化CPO 的催化活性,将第一次使用固定化酶的氯化活性看作是100%,并把以后每一次的活性与之相比,同样以残余活性来表示。每次反应完成后,将反应体系磁性分离,并将固定化酶催化剂继续用于下一次的氯化反应体系。
2 结果与讨论
2.1 Au@Fe3O4 纳米粒子的表征
图1a 为 Au@Fe3O4的 X-射线衍射分析(XRD)图谱,图1b 为Au@Fe3O4在pH 值为3.5 缓冲溶液中的稳定性。
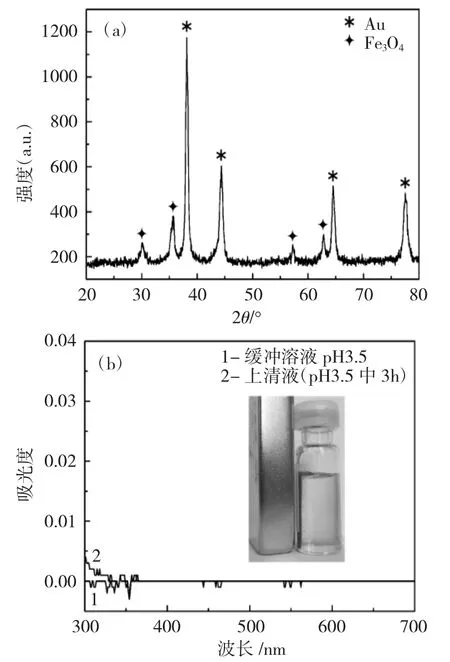
图1 Fe3O4 和 Au@Fe3O4 的 XRD(a)和 Au@Fe3O4在pH 值3.5 缓冲溶液中的稳定性(b)Fig.1 XRD patterns of Fe3O4 and Au@Fe3O4(a)and Au@Fe3O4 stability in pH 3.5 buffer solution(b)
由图 1a 可知,衍射角 2θ 分别为 38.1°、44.4°、64.5°和77.5°处出现的衍射特征峰,分别对应为Au的(111)、(200)、(220)和(311)晶面,与标准图谱数据(JCPDS 04-0784)基本一致,金壳层为立方结构,而复合材料中Fe3O4组分的各衍射峰30.1°、35.7°,57.2°和 62.8°,符合标准图谱数据(JCPDS 65-3107),表明合成载体组分是由Au 粒子和Fe3O4构成,且Au@Fe3O4载体材料中金的衍射峰强度强于Fe3O4,表明合成的Au@Fe3O4为核-壳型纳米复合材料[8]。
由图1b 可以看出,当施加外部磁场后,Au@Fe3O4被迅速吸引至磁铁处,可见Au@Fe3O4能从反应体系中快速分离。Au@Fe3O4在pH 值为3.5的缓冲液中振荡3h,磁性分离后测上清液的紫外吸收。由图1b 可知,上清液澄清,上清液和PBS 缓冲液的紫外吸收差别不大,表明Au@Fe3O4复合材料在pH 值为3.5 的酸性介质中比较稳定,可以作为固定化CPO 酶的优良载体。
2.2 酶固定化条件优化
由固定化温度条件探讨发现(图2a),在4~25℃范围内,温度的变化对固定化CPO 固载量的影响不是很大,这与生物素与链霉亲和素的特异性结合有关(Kd≈10-15M)[9]。
固定化时间上,生物素化CPO 能较快地与载体材料结合,由图2b 可知,Au@Fe3O4固定CPO 的最佳固定时间为40min,时间超过40min 后至60min内,固载量下降并不明显。由于固定化是在振荡器中进行的,如果固定时间过长的话,由于外界的机械振动CPO 容易从载体上脱落,从而导致固载量降低。但在本实验中,固定化过程是实现生物素与链霉亲和素的对接,这种特异性结合使得酶分子的脱落并不十分容易发生。
在固定化温度为10℃,固定化时间为40min 的条件下,只改变PBS 缓冲液的pH 值来进行氯过氧化物酶的固定化。
由图2c 中数据分析可知,pH 值对氯过氧化物酶的固定化的影响相对温度和反应时间比较显著。随着pH 值的变化,氯过氧化物酶的固载率有很大的差别,pH 值为3.0 时,固载量最大,此时的pH 值即为氯过氧化物酶的固定化的最佳pH 值。
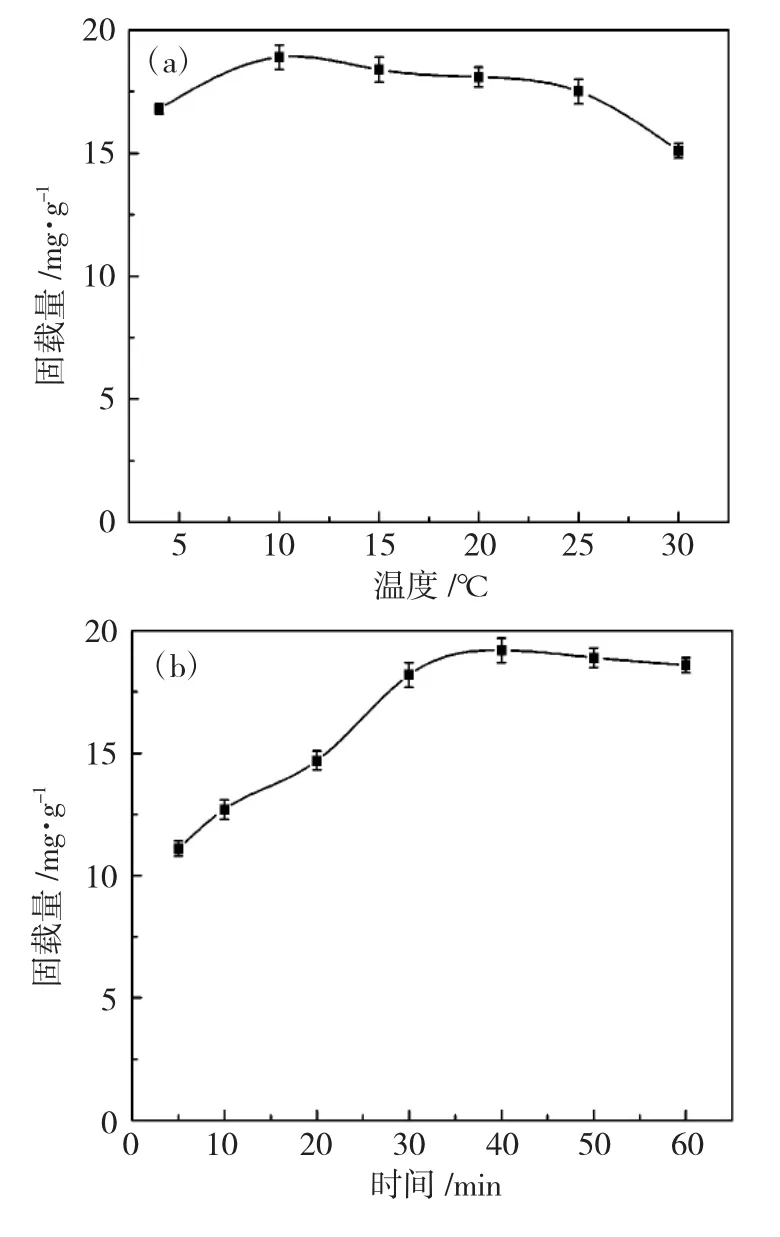
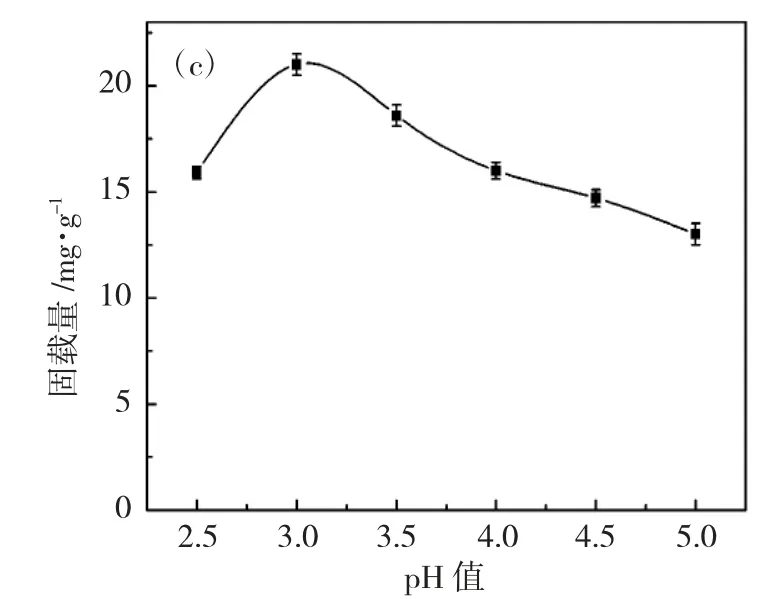
图2 Au@Fe3O4 固定化CPO 的条件Fig.2 Conditions for the immobilization of CPO with Au@Fe3O4
2.3 固定化酶的重复使用性
图3 是固定化CPO 催化MCD 氯化反应中的重复使用情况。
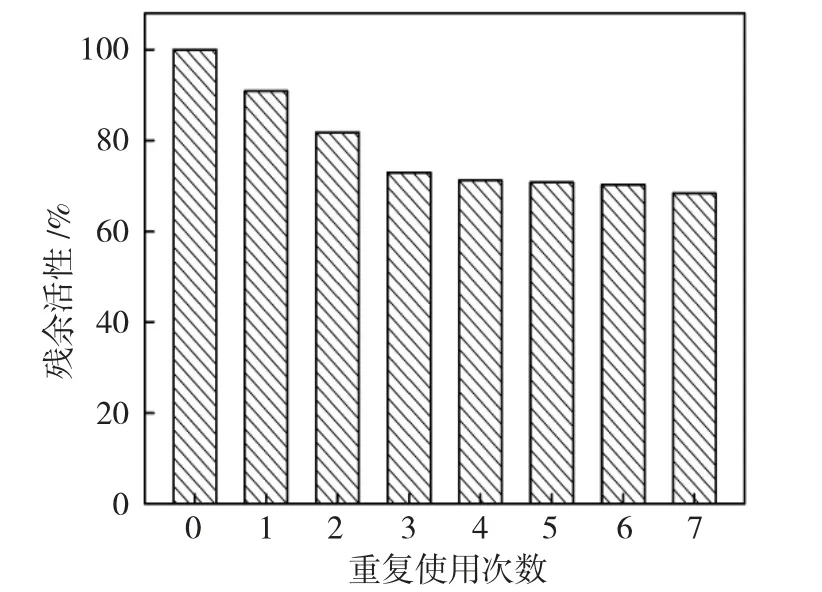
图3 固定化CPO 的重复使用次数Fig.3 Reusability of immobilized CPO
由图3 可以看出,Au@Fe3O4CPO 固定化酶的重复使用性较好,重复使用6 次酶残余活性保留仍在70%以上。这可能是由于亲和素-生物素特异性结合系统使CPO 的固定化较为牢固,固定化CPO 不容易发生脱附或泄漏,可达到多次重复使用的目的。
3 结论
合成了易于从液相反应体系中分离的Au@Fe3O4复合材料,将Au@Fe3O4作为磁性载体材料用于固定化氯过氧化物酶。通过单因素实验,优化得到Au@Fe3O4-CPO 的最佳固定条件为缓冲液pH 值为3.0、反应时间40min、温度10℃。固定化CPO 的表现出良好的重复使用性,重复使用6 次酶残余活性保留仍在70%以上。
