L-半胱氨酸对葡萄交链孢霉腐病的抑制作用
2020-12-31康慧芳乔勇进刘晨霞孙大鹏
康慧芳,乔勇进*,刘晨霞,张 怡,孙大鹏
(1.上海市农业科学院农产品保鲜加工研究中心,上海 201403;2.上海师范大学生命科学学院,上海 200234;3.上海农产品保鲜加工工程技术研究中心,上海 201403)
葡萄是一种高营养水果,果实富含大量的糖、有机酸、维生素、各种矿物质以及人体所需的氨基酸等,集食疗、医用、美容和商业价值于一身[1],深受广大消费者的青睐。然而葡萄是不耐贮藏的水果之一,果实皮薄、汁多、肉软,采后极易受病原微生物侵染[2],造成巨大的经济损失。其中,交链孢霉腐病是最为突出的采后病害之一,其主要致病菌为链格孢菌(Alternaria alternata),其对生态环境的适应能力强,生长繁殖快,严重影响寄主的质膜透性、酶活性、激素平衡及其他生理代谢过程,从而造成果实大量腐烂[3-4]。
目前,已有许多研究者将L-半胱氨酸应用于葡萄交链孢霉腐病的防治,例如那他霉素可以抑制葡萄采后交链孢菌引起的腐烂变质[5];二氧化硫可以抑制交链孢菌的孢子萌发、菌落生长及其所引起的葡萄腐烂率[6];臭氧处理可导致互隔交链孢菌菌丝的干瘪萎缩和孢子凹陷褶皱,导致其致病力减弱[7];芽孢杆菌发酵液产生的挥发性气体亦能明显抑制链格孢菌的生长[8];L-谷氨酸对番茄果实的交链孢霉腐病也有防治作用[9]。但现阶段仍然需要寻找更安全、更有效、更经济、更便捷的新型杀菌剂替代品来控制由交链孢霉腐病引起的采后果实烂果现象。
L-半胱氨酸是组成体蛋白质的氨基酸中唯一一种含有巯基的亲水性氨基酸[10],也是一种还原剂,能够通过改变蛋白质分子之间和内部的二硫键减弱蛋白质的结构,使蛋白质伸展开,具有多种药理功效[11],包括抗氧化和抗炎作用,在生物化学、医药、食品、饲料、化妆品等行业中已得到广泛应用[12],国内外需求量也逐年增长。Kyung等研究表明S-甲基-L-半胱氨酸亚砜能够有效清除芸苔属蔬菜中的氧自由基,具有杀菌作用[13]。Zhou Xiran等认为L-半胱氨酸是一种非竞争性的有效抑制剂,能够有效抑制黄果梨多酚氧化酶(polyphenol oxidase,PPO)的活性,防止梨汁加工过程中的酶褐变反应[14]。廖春丽等研究表明,L-半胱氨酸对马铃薯、苹果和甘薯PPO活性抑制作用明显,且随着L-半胱氨酸浓度增大,酶活力降低幅度越大[15]。Hamza等研究表明L-半胱氨酸对氧化组织损伤具有保护作用,能够提高脂质的水平,增加酶的抗氧化活性,降低脂质过氧化程度[16]。但关于L-半胱氨酸应用于葡萄交链孢霉腐病的研究还鲜有报道。本研究旨在探讨L-半胱氨酸处理对离体链格孢菌的抑制作用及抑菌机理,并在葡萄果实上接种验证,为L-半胱氨酸处理在葡萄贮藏保鲜中的应用提供理论依据。
1 材料与方法
1.1 菌株、材料与试剂
葡萄链格孢菌来源于华东师范大学生命科学学院,于PDA培养基中4 ℃冰箱保存。
‘巨峰’葡萄购自上海市奉贤区嘉园路87号水果店,挑选色泽、大小一致,且无机械损伤、无病虫害的果实,购买当天装在水果泡沫箱中运回(4.0±0.5)℃的冷库中预冷并贮藏保存。
L-半胱氨酸、乙酸、无水乙酸钠、领苯二酚、过氧化氢、愈创木酚、吐温-80、马铃薯葡萄糖琼脂(potato dextrose ager,PDA)培养基、无水乙醇、聚乙二醇、聚乙烯吡咯烷酮、Triton X-100 国药集团化学试剂有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒 南京建成科技有限公司。
1.2 仪器与设备
酶标仪 美国安马西亚公司;HVE-50高压蒸汽灭菌锅 日本托米公司;CA-1480超净工作台 上海上净净化设备有限公司;D37520 Osterode高速冷冻离心机德国Biofuge公司;水浴锅 上海一恒科技有限公司;电热恒温鼓风干燥箱 上海益恒实验仪器有限公司;打浆机 广东美的生活电器制造有限公司;SPX-250B-Z生化培养箱 上海博迅实业有限公司医疗设备厂;血球计数板 上海求精生化仪器有限公司;倒置显微镜 日本奥林巴斯有限公司。
1.3 方法
1.3.1 孢子悬浮液的制备
将在冰箱保存的链格孢菌取出,于25 ℃ PDA培养基上培养7 d,用含0.05%吐温-80的无菌水冲洗平板洗下孢子,并用血球计数板调整至浓度为1.0×106个/mL的孢子悬浮液备用。
1.3.2 实验处理
1.3.2.1 离体实验
将PDA经灭菌后冷却至45 ℃左右,加入量的L-半胱氨酸混匀,制成L-半胱氨酸质量浓度为0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0、2.2、2.4、2.6、2.8 g/L和3.0 g/L的PDA培养基,以不加入任何药剂的PDA培养基为对照组。每组处理设置3 个重复,平板凝固后,移液枪取20 μL菌悬液滴在PDA培养基中央,室温条件下放置4 h后放入25 ℃的生化培养箱中培养,每天测定一组数据,直至对照组菌落长满培养皿。
1.3.2.2 活体接种实验
选择外观整齐、无病虫害和机械损伤的葡萄果实,先用自来水将果面冲洗干净,然后用体积分数2%次氯酸钠溶液浸泡2 min,接着用体积分数75%乙醇溶液浸泡1 min,再用无菌水冲洗3 次,晾干后用无菌剪刀剪下葡萄果实(保留果梗)。无菌接种针在葡萄赤道部刺深约3 mm,滴入10 μL菌悬液,室温(25±1)℃条件下放置4 h后,以离体菌菌落生长的研究结果为依据,选取质量浓度分别为1.6、2.0、2.4、2.8 g/L的无菌L-半胱氨酸溶液用移液枪摄入10 μL至上述针刺部位,并于室温(25±1)℃条件下放置4 h,之后放置在25 ℃培养箱中贮藏。每3 d测定葡萄果实病斑直径和病斑率,直至病原菌布满果面,其他指标在贮藏结束时测定。每个处理组取50 粒葡萄,设置3 个重复。
1.3.3 指标测定
1.3.3.1L-半胱氨酸对离体链格孢菌菌落生长的抑制作用
用十字交叉法统计每天链格孢菌的菌落直径,并计算第6天的菌落生长抑制率,具体计算见公式(1)。

1.3.3.2 链格孢菌菌丝形态的观察
分别在含不同质量浓度的L-半胱氨酸的PDA培养基上滴20 μL浓度为1.0×106个/mL的链格孢菌菌悬液,以不加任何药剂为对照处理。室温下放置2 h待菌悬液晾干,然后放置在25 ℃的恒温培养箱中培养。24 h后用无菌刀在中央位置取2 cm×2 cm×2 cm的培养基小块,制成玻片在倒置显微镜下观察并拍照,每一个玻片取不同的7 个视野观察并拍照,每组设置3 个重复。
1.3.3.3 链格孢菌芽管伸长抑制率的测定
按1.3.3.2节相同方法取2 cm×2 cm×2 cm的培养基小块,在倒置显微镜下观察并用显微镜上的测量尺测量每一组芽管的长度并记录。芽管伸长抑制率计算见公式(2)。

1.3.3.4 链格孢菌孢子萌发抑制率的测定
将1.0×106个/mL链格孢菌菌悬液接种到L-半胱氨酸的PDA培养基,25 ℃恒温培养箱培养6 d后,用直径为0.6 cm的打孔器在培养皿边缘取3 个菌碟,无菌水洗下孢子并用托马计数池进行计数,每组处理重复3 次,通过公式(3)计算孢子萌发抑制率。

1.3.3.5 葡萄果实发病率、质量损失率和落果率的测定
病斑直径采用十字交叉法测定,取平均值;病斑直径若大于0.5 mm则确定为发病,发病率计算见公式(4)。在贮藏前后称果实质量,并按公式(5)计算果实的质量损失率。统计果梗的腐烂程度,果梗发生霉变为腐烂,未发生霉变为正常,果梗腐烂率的计算见公式(6)。另外,果实在贮藏期会出现落果现象,即果梗和果实发生分离的现象,落果率计算见公式(7)。

1.3.3.6 抗性酶活力的测定
过氧化物酶(peroxidase,POD)活力测定采用愈创木酚法[17];PPO活力的测定采用邻苯二酚比色法[17];丙二醛含量、CAT活力、SOD活力采用试剂盒测定。
1.4 数据统计与处理
所有实验数据采用Microsoft Excel 2007软件计算标准偏差,并用Origin 8.0软件作图,用SPSS 17.0软件进行差异显著分析(方差分析),P<0.05为差异显著,P<0.01为差异极显著,P>0.05为差异不显著。
2 结果与分析
2.1 L-半胱氨酸处理对链格孢菌菌落生长的影响
由表1可以看出,与对照组相比,各质量浓度L-半胱氨酸处理对链格孢菌菌丝生长均有不同程度的抑制作用,且在0~2.8 g/L范围内,随着L-半胱氨酸质量浓度的增加,对链格孢菌菌丝生长的抑制效果逐渐增强,其中2.8 g/LL-半胱氨酸处理组菌丝生长抑制率最大,L-半胱氨酸质量浓度超过2.8 g/L后,其对链格孢菌菌丝生长的抑制效果减弱。另外,对照组链格孢菌菌丝基本长满培养基表面,菌丝颜色较深,偏向暗褐色,且随着L-半胱氨酸质量浓度的增大,链格孢菌菌落直径减小,其中2.8 g/LL-半胱氨酸处理组的菌饼直径最小。培养第6天时,与其他各组比较,2.8 g/LL-半胱氨酸处理组菌落直径仅为0.25 cm,抑制率最高(95.96%)。由此表明L-半胱氨酸能够有效抑制链格孢菌菌丝生长,其中2.8 g/LL-半胱氨酸处理的效果最好。

表1 L-半胱氨酸对链格孢菌菌落生长的抑制作用Table 1 Inhibitory effects of L-cysteine on colony growth of Alternaria alternate
2.2 L-半胱氨酸处理对链格孢菌孢子萌发及芽管伸长的抑制作用
将链格孢菌菌悬液滴入含有不同质量浓度L-半胱氨酸的PDA培养基中恒温培养24 h后,于倒置显微镜下观察,含0.4~1.0 g/LL-半胱氨酸的PDA培养基中可以清晰观察到链格孢菌孢子萌发且有芽管伸长现象,而L-半胱氨酸质量浓度大于1.0 g/L的PDA培养基中均未明显观测到孢子萌发及芽管伸长。由图1可知,L-半胱氨酸对链格孢菌的孢子萌发具有显著抑制作用,0.4、0.6、0.8 g/L和1.0 g/LL-半胱氨酸处理组的孢子萌发抑制率分别为6.73%、11.68%、21.64%和37.87%,1.0 g/LL-半胱氨酸处理组孢子萌发抑制率显著高于其他处理组(P<0.05),说明高质量浓度L-半胱氨酸对链格孢菌的孢子形成抑制率效果显著。由图2可知,与对照组相比,不同质量浓度(0.4~1.0 g/L)的L-半胱氨酸对链格孢菌芽管伸长均有不同程度的抑制作用。其中,1.0 g/L的L-半胱氨酸处理组芽管长度仅为16.31 μm,抑制率高达81.30%,显著高于其他各组(P<0.05)。由此可得,L-半胱氨酸质量浓度越高,对链格孢菌芽管伸长的抑制效果越好。

图1 L-半胱氨酸质量浓度对链格孢菌孢子萌发的抑制效果Fig.1 Inhibitory effect of L-cysteine on spore germination of A.alternata

图2 L-半胱氨酸质量浓度对链格孢菌芽管伸长的抑制效果Fig.2 Inhibitory effect of L-cysteine on germ tube elongation of A.alternate
2.3 L-半胱氨酸处理对链格孢菌菌丝形态的影响


图3 链格孢菌经L-半胱氨酸处理后倒置显微镜观察结果Fig.3 Inverted microscopic observation of A.alternate treated with L-cysteine
将培养24 h的各处理组培养基置于倒置显微镜下观察,质量浓度高于1.0 g/L的L-半胱氨酸处理组均未清晰观察到链格孢菌菌丝的形态,而质量浓度低于1.0 g/L的L-半胱氨酸处理组均能不同程度观察到菌丝形态的变化。如图3所示,与对照组相比,经L-半胱氨酸培养的链格孢菌菌丝密集程度下降,且随着L-半胱氨酸质量浓度的增加,菌丝密集程度下降越明显,经0.8、1.0 g/LL-半胱氨酸处理的链格孢菌菌丝表面粗糙且出现沟壑。说明L-半胱氨酸处理对链格孢菌菌丝造成了损伤,且高质量浓度L-半胱氨酸可以更明显抑制链格孢菌菌丝生长。
2.4 L-半胱氨酸处理对接种链格孢菌后葡萄病害和贮藏品质的影响
如图4所示,贮藏到第15天时,对照组果实表面被一层灰色菌丝覆盖,病斑直径显著大于各处理组(P<0.05),且能明显看出病斑边缘软化腐烂以及果梗表面有菌丝环绕的现象,而2.8 g/L处理组果实感染病害的程度很小,只能看到少量的菌丝出现,且葡萄果实保持色泽鲜亮,果梗紧紧衔接果实,没有出现脱落及病害现象。由此说明,高质量浓度L-半胱氨酸处理能够有效抑制葡萄交链孢霉腐病的感染。

图4 L-半胱氨酸处理15 d后葡萄交链孢霉腐病的发病情况Fig.4 Morbidity of Alternaria alternata rot at 15 days after L-cysteine treatment
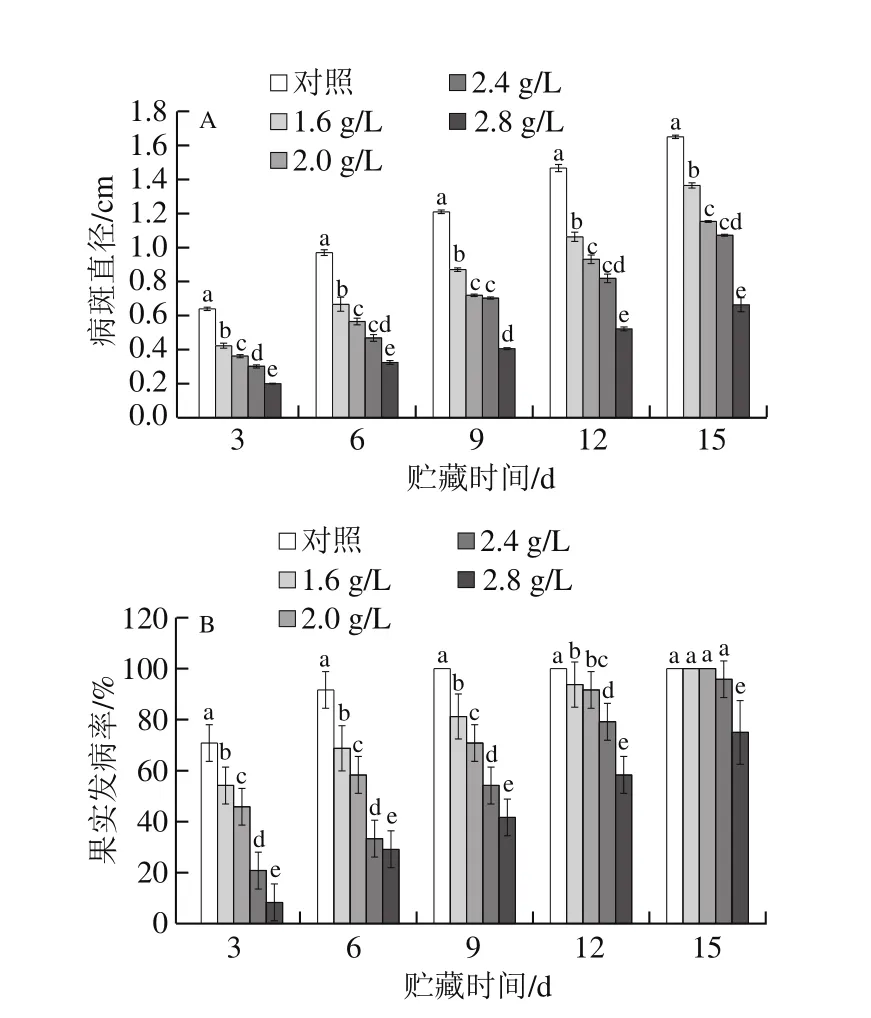
图5 L-半胱氨酸对葡萄交链孢霉腐病病斑直径(A)和发病率(B)的影响Fig.5 Effect of L-cysteine on lesion diameter (A) and incidence (B) of Alternaria alternata
由图5A可知,葡萄果实病斑直径随贮藏时间的延长而迅速扩展,呈逐渐上升的趋势。接种链格孢菌第3天开始,各处理组病斑直径均显著低于对照组(P<0.05),其中2.8 g/LL-半胱氨酸处理组的病斑直径最小,在第15天时仅为0.66 cm,显著低于其他各组(P<0.05),说明质量浓度为2.8 g/L的L-半胱氨酸处理的抑制效果最好。
如图5B所示,巨峰葡萄接种链格孢菌后逐渐开始染病,接种第3~6天,各L-半胱氨酸处理组的发病率显著低于对照组(P<0.05),接种第15天,对照组和1.6、2.0 g/LL-半胱氨酸处理组的发病率均达到100%,而质量浓度为2.8 g/LL-半胱氨酸处理组仅为75%,显著低于其他各组(P<0.05),综上说明质量浓度为2.8 g/L的L-半胱氨酸能显著降低葡萄采后交链孢霉腐病的发病率。

图6 L-半胱氨酸处理对葡萄贮藏品质的影响Fig.6 Effect of L-cysteine treatment on storage quality of grapes
由图6可以看出,不同质量浓度的L-半胱氨酸均能显著抑制果实品质的下降,且2.8 g/LL-半胱氨酸处理的效果最好,该组的果梗腐烂率、落果率、质量损失率分别仅为20.83%、4.2%、2.54%,对照组果实质量损失率达到5.25%。
2.5 L-半胱氨酸处理对接种链格孢菌的葡萄果实中MDA含量的影响

图7 L-半胱氨酸处理对葡萄果实中MDA含量的影响Fig.7 Effect of L-cysteine treatment on MDA content of grape fruit
如图7所示,接种链格孢菌后,葡萄果实内的MDA含量均呈上升趋,这是由于果实损伤导致。经L-半胱氨酸处理的果实MDA含量均低于对照组,经2.8 g/LL-半胱氨酸处理的葡萄果实在第15天MDA含量仅为41.39 nmol/g,显著低于其他处理组(P<0.05),说明高质量浓度的L-半胱氨酸处理能够有效减缓果实内部自由基对细胞膜的损伤。
2.6 L-半胱氨酸处理对接种链格孢菌的葡萄果实POD和PPO活力的影响
由图8A可知,各组葡萄在贮藏过程中POD活力均呈上升趋势,其中2.8 g/LL-半胱氨酸处理组急剧上升,且总体上显著高于其他各组(P<0.05),在接种的第15天达到1.60 U/g,是对照组的3.56 倍,说明2.8 g/LL-半胱氨酸能够促使果实保持较高的POD活力。
由图8B可知,接种链格孢菌后,各组葡萄果实的PPO活力在前6 d上升较快,基本为直线上升趋势,6~9 d略微下降后又逐渐上升,其中2.8 g/LL-半胱氨酸处理组的PPO活力贮藏期间一直显著高于其他各组(P<0.05),在接种第15天为2.00 U/g,是对照组的1.87 倍;综上说明高质量浓度的L-半胱氨酸能够更快诱导果实PPO活力的上升,并促使PPO活力保持在较高水平。
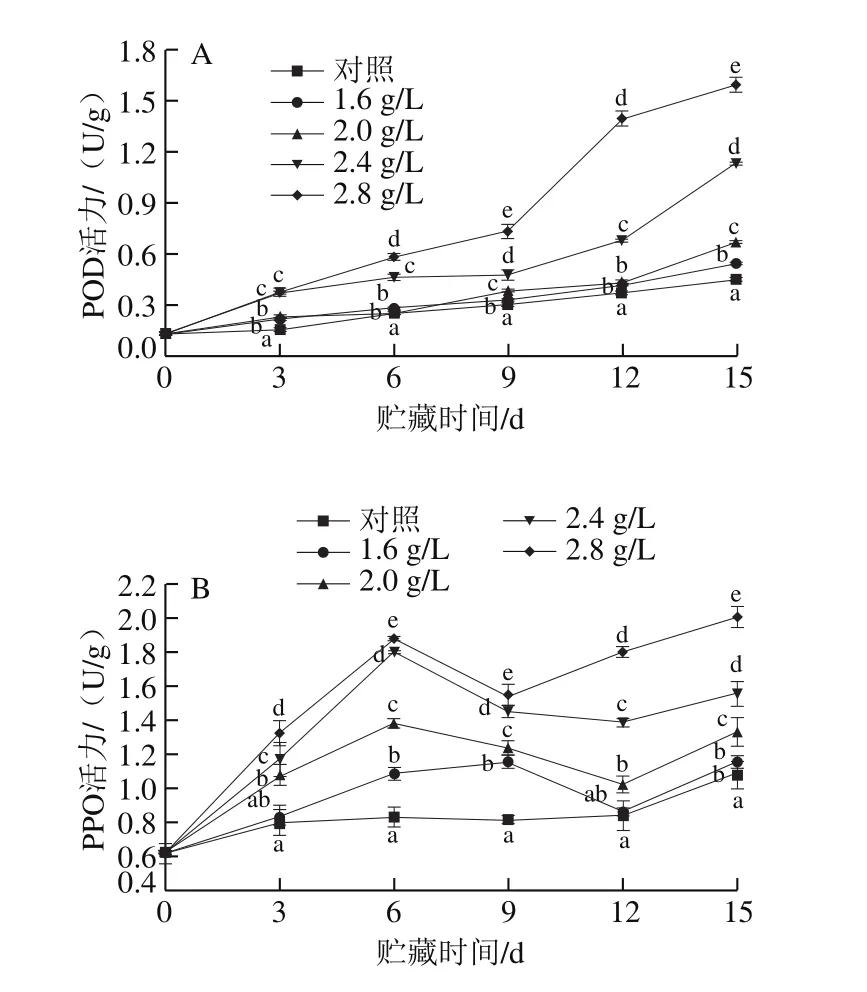
图8 L-半胱氨酸处理对葡萄果实中POD(A)和PPO(B)活力的影响Fig.8 Effect of L-cysteine treatment on peroxidase (A) and polyphenol oxidase (B) activities of grape fruit
2.7 L-半胱氨酸处理对接种链格孢菌的葡萄果实CAT和SOD活力的影响
SOD是浆果中普遍存在的抗氧化酶类,它能将超氧阴离子歧化为过氧化氢和氧气,从而起到清除活性氧、维持活性氧平衡、保护细胞膜结构的作用[18-19]。如图9A所示,接种链格孢菌后,各组葡萄果实SOD活力在贮藏期间均出现了不同程度的升降变化,且都在第6天时达到了高峰,但2.8 g/LL-半胱氨酸处理组果实中的SOD活力始终保持最高水平,第6天时达到61.95 U/g,显著高于其他各组(P<0.05),贮藏期第15 天时,L-半胱氨酸处理组的SOD活力达到48.57 U/g,是对照组的1.47 倍。综上说明,高质量浓度的L-半胱氨酸能保持葡萄较高的SOD活力。
CAT是果实后熟衰老中的保护性酶类,它能催化果蔬体内积累的H2O2分解,从而减少H2O2对果蔬组织造成的伤害[20-21]。由图9B可知,接种链格孢菌后,各组葡萄果实CAT活力前期(0~6 d)均呈先下降后上升的趋势,第6天时,2.8 g/LL-半胱氨酸处理组CAT活力显著高于其他各组(P<0.05),达到0.89 U/g。贮藏6 d后,各组CAT活力开始缓慢下降,其中对照组下降速度最快,而2.8 g/LL-半胱氨酸处理组下降速度相对较慢,第15天时,2.8 g/L处理组的CAT活力仍最高(0.59 U/g),是对照组的3.11 倍。由此表明,质量浓度为2.8 g/L的L-半胱氨酸能够有效促进H2O2的清除效率。

图9 L-半胱氨酸处理对葡萄果实SOD(A)和CAT(B)活力的影响Fig.9 Effect of L-cysteine treatment on superoxide dismutase (A) and catalase (B) activities of grape fruit
3 讨 论
研究不同质量浓度L-半胱氨酸对离体链格孢菌的抑制效果,结果表明L-半胱氨酸的质量浓度越大,抑菌效果越好。令阳等[22]研究发现L-半胱氨酸处理可以显著延缓褐腐菌孢子的萌发,抑制菌丝体生长,增加褐腐菌菌丝体胞外电导率和核酸物质的释放量,破坏褐腐菌孢子细胞膜的完整性。本实验采用菌丝生长速率法和孢子萌发法测定了不同质量浓度L-半胱氨酸对链格孢菌的影响,结果表明,高质量浓度L-半胱氨酸能够显著抑制链格孢菌的菌丝生长和芽管伸长,延缓孢子萌发,培养24 h后,1.0 g/LL-半胱氨酸处理组的芽管长度仅为16.31 μm,芽管伸长抑制率高达81.30%,而质量浓度高于1.0 g/L的L-半胱氨酸处理组均未能清晰观察到链格孢菌孢子的萌发状态,且培养到第6天,2.8 g/LL-半胱氨酸组的菌落生长抑制率高达95.96%。另外,从菌丝生长形态来看,1.0 g/LL-半胱氨酸处理组的链格孢菌菌丝密集程度很小,在显微镜下菌丝内部细胞质凝集,菌丝空洞化、发黑变粗、萎缩,原生质体渗漏,而高于1.0 g/LL-半胱氨酸处理组均未观察到菌丝形态的变化。综上表明,相比对照组,2.8 g/LL-半胱氨酸处理组孢子萌发的时间最晚,且培养到第6天,菌落直径才仅为0.25 cm,由此可得2.8 g/LL-半胱氨酸组能够有效抑制葡萄链格孢菌的离体菌的生长。
SOD、CAT、POD以及与电子传递相关的PPO在果实体内组成了一个有效的活性氧自由基清除系统,当病原菌侵染浆果后,其能有效维持自由基在植物体内产生和清除的动态平衡,保持膜结构的完整性,增强果实抵抗病害的能力[23-24]。孔维宝[25]、张恒[26]等研究表明PPO催化多酚类化合物氧化形成的相应醌类物质能迅速杀死侵入点周围的细胞,增强组织的抗氧化能力,抑制果实病变腐烂。本研究表明,经L-半胱氨酸处理的葡萄在接种链格孢菌后能够保持较高的PPO活力,其中2.8 g/LL-半胱氨酸处理组的PPO活力最高,这与Jia Haifeng等[27]研究草莓果实中PPO基因过表达对真菌感染过程的影响结果相似,说明高质量浓度的半胱氨酸能够有效抑制葡萄浆果贮藏期间PPO活力的降低。POD作为病原真菌抗氧化防御系统的主要组分,能够清除来源于植物体产生的过氧自由基,增强植物体的抗性能力[28-29]。本实验应用不同质量浓度的L-半胱氨酸处理链格孢菌,结果发现,各处理组果实在贮藏过程中POD活力上升,其中2.8 g/LL-半胱氨酸处理组的POD活力最高,说明2.8 g/LL-半胱氨酸能够有效促进POD活力的上升。且2.8 g/LL-半胱氨酸处理能够有效减缓果实内部自由基对细胞膜的损伤,贮藏到第15天时,该处理组果实MDA含量显著低于其他处理组(P<0.05)。另外,CAT作为果实中的一种防御系统,能有效清除细胞内的氧自由基,减缓细胞衰老[30],本实验应用不同质量浓度的L-半胱氨酸溶液处理接种链格孢菌后的葡萄,结果表明2.8 g/LL-半胱氨酸处理组中的CAT活力在贮藏期间均处于最高水平。果实内SOD可减少因氧自由基对细胞造成的损害,并及时修复受损细胞,2.8 g/LL-半胱氨酸处理组的SOD活力显著高于其他各组。综上表明接种链格孢菌的果实经2.8 g/LL-半胱氨酸溶液处理后能够有效增强果实抗性,抵抗病害发生。
综上,L-半胱氨酸处理能有效抑制离体链格孢菌的菌落生长、芽管伸长以及孢子萌发,并对链格孢菌菌丝造成损伤,其中对离体链格孢菌抑制效果最好的是质量浓度为2.8 g/L。L-半胱氨酸处理能降低接种链格孢菌的葡萄的发病率和病斑直径,降低果实MDA的积累,维持了较高的PPO和POD活力,能有效维持活性氧自由基在植物体内产生和清除的动态平衡,增强果实抵抗链格孢菌的侵染能力,其中效果最好的质量浓度为2.8 g/L。
