河南省部分地区猪圆环病毒2型全基因组的克隆与序列分析
2020-12-31朱前磊杨海波赵美雪张利平陈红英
朱前磊,宋 丹,杨海波,赵美雪,张利平,刘 敏,陈红英
(1.河南省动物疫病预防控制中心,河南 郑州 450008;2.河南农业大学 动物医学院,河南 郑州 450002)
猪圆环病毒(Porcine circovirus, PCV)属于圆环病毒科圆环病毒属成员,是目前发现的最小的动物病毒之一[1]。根据致病性、抗原性和核酸序列的差异,将PCV分为PCV-1和PCV-2,PCV2又分为PCV2a、PCV2b、PCV2c和PCV2d[2,3],2003年以后PCV2b逐渐变为优势流行毒株[4]。PCV-1基因组全长1 759 bp,毒株间的核酸序列同源性大于99%。PCV-2全长1 768 bp或1 767 bp,毒株间的核酸序列同源性大于96%。PCV-1和PCV-2的核酸序列同源性小于80%。虽然PCV1对猪无致病性,但在生猪及猪源细胞中的污染面很广。
PCV2是引起仔猪断奶后多系统衰竭综合征(Post-weaning multisystemic wasting syndrom,PMWS)、猪皮炎肾病综合征(Porcine dermatitis nephro-pathy syndrome,PDNS)和新生仔猪A2型先天性震颤的主要病原[5]。从2000年首次检出PCV2病原以来,我国相继发现PCV2的感染现象。河南省是养猪大省,近年来PCV2在猪场中污染面非常广。为了解河南省不同地区猪场PCV2的变异情况,本试验从河南省5个疑似患有PWMS的猪场采集病料样本,先用PCR方法进行PCV2的检测,对阳性样本进一步进行PCV2扩增、全基因组测序及序列分析,本试验对河南省PCV2分子流行病学的研究和猪圆环病毒病的预防与控制具有一定的意义。
1 材料与方法
1.1 质粒、菌种和病料
pMDTM18-T Vector Cloning Kit购自TaKaRa公司。大肠杆菌DH5α购自北京天根生化科技有限公司。5份疑似PCV2感染猪的脾脏组织分别来自河南省淮阳、濮阳、鹤壁、开封、原阳的猪场,分别命名为HY、PY、HB、KF和YY,于-20℃冻存。
1.2 酶和试剂
ExTaq DNA聚合酶、限制性内切酶EcoRI和SalI等购自TaKaRa公司。DNA提取试剂盒购自江苏天隆科技信息有限公司。
1.3 引物设计
依据GenBank发布的PCV2全基因组序列(登录号:HQ650833),用Primer 5.0软件设计一对特异性引物(P1/P2),扩增PCV2基因部分片段;设计一对特异性引物(P3/P4),扩增PCV2全基因组。引物由上海生物工程技术有限公司合成。引物序列为:
上游引物P1:5′-CGG ATA TTG TAG TCC TGG TCG-3′
下游引物P2:5′-ACT GTC AAG GCT ACC ACA GTCA-3′
上游引物P3:5′-TAT CCG CGG GCT GGC TGA ACT TTT GAA-3′
下游引物P4:5′-GTG CCG CGG AAA TTT CTG ACA AAC GTT-3′
1.4 病料的PCR检测
将疑似病料解冻,将组织块放入2 mL Ependorf管中,用组织研磨机研磨,取上清液200 μL,提取DNA。用特异性引物(P1/P2)扩增PCV2基因部分片段,PCR反应体系为:DNA模板3 μL, 上、下游引物(P1/P2)各0.5 μL,Premix Taq酶12.5 μL,去离子水8.5 μL。扩增程序为:95 ℃预变性5 min,94 ℃变性1 min,54 ℃退火45 s,72 ℃延伸1 min,30个循环,最后72 ℃延伸10 min,4 ℃ 10 min。琼脂糖凝胶电泳检测PCR结果。检测结果阳性的样本进行全基因组扩增。
1.5 PCV2全基因组扩增
利用引物P3/P4扩增PCV2全基因组。50 μL PCR反应体系为:DNA模板6 μL,上、下游引物(P3/P4)各1 μL,Premix Taq酶25 μL,去离子水17 μL。扩增程序为:94 ℃预变性5 min,94℃变性1 min,60 ℃退火45 s,72 ℃延伸2 min,35个循环,最后72 ℃延伸10 min,4 ℃ 10 min。琼脂糖凝胶电泳检测PCR结果。核酸扩增阳性的样本进行DNA的回收。
1.6 PCV2全基因组的克隆与测序
将回收纯化的PCR产物连接至pMDTM18-T载体上,获得重组质粒。对重组质粒进行PCR和酶切鉴定。选择酶切和PCR鉴定均为阳性的重组质粒进行测序。
1.7 基因组序列分析
将测序基因组进行Blast比对,确定其是否为PCV2基因组,若是PCV2基因组,用DNAstar软件将所测基因组与GenBank上的其它PCV2毒株的基因组(表1)进行比对,分析它们之间的同源性并构建遗传进化树。
2 结果
2.1 疑似病料的PCR检测结果
以疑似病料的DNA为模板,以P1/P2为引物,PCR扩增结果如图1所示。结果出现5条约470 bp左右的条带,说明5个疑似病料的检测结果均为PCV2阳性。
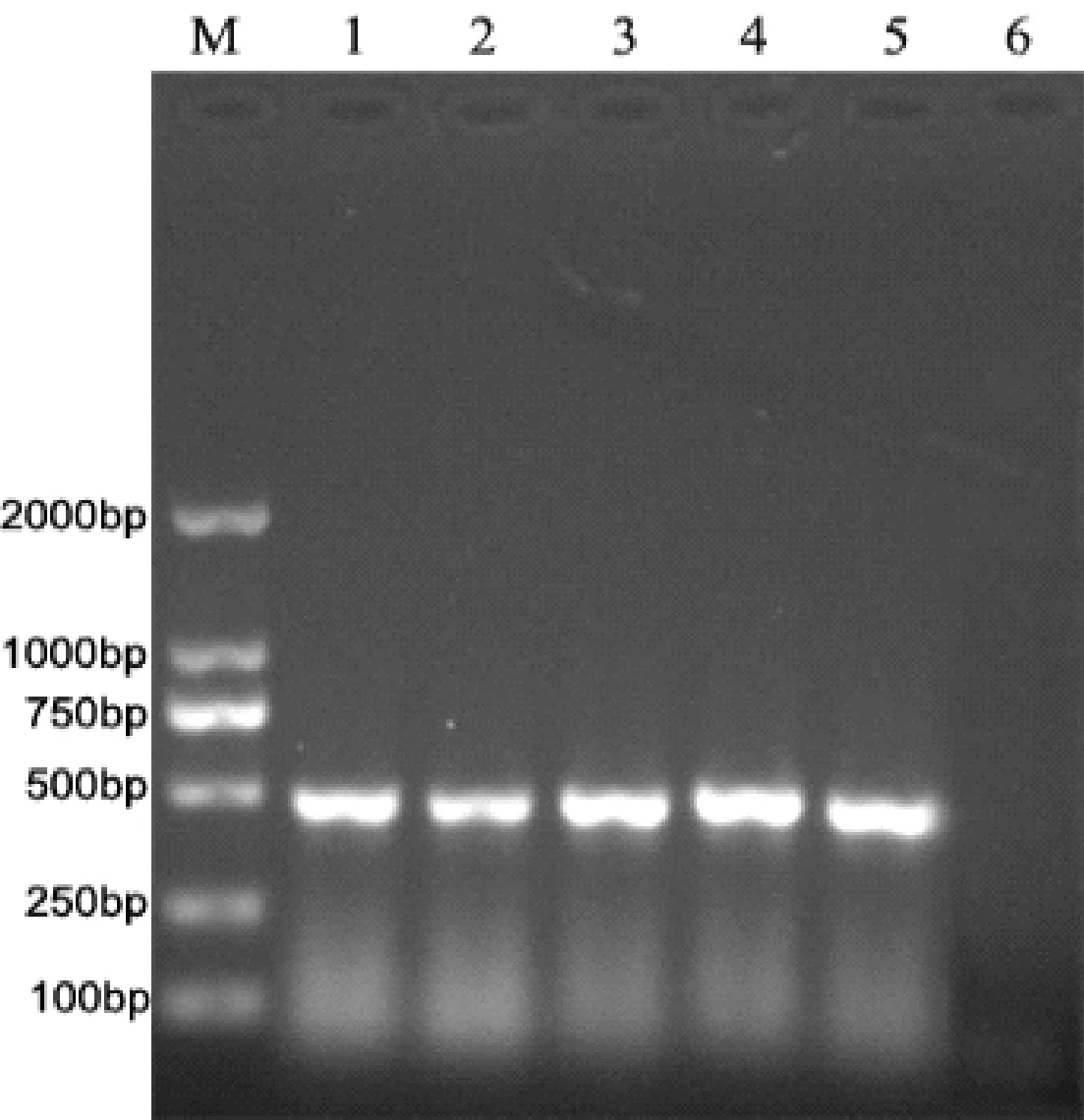
图1 病料中PCV2的PCR检测结果
2.2 全基因组的PCR扩增结果
PCV2全基因组的PCR扩增结果如图2所示。5个病料样本均扩增出约1 800 bp左右的条带。

图2 PCV2 DNA的PCR扩增结果
2.3 重组质粒PCR鉴定
重组质粒PCR鉴定结果如图3所示,5个病料样本均扩增出约1 800 bp左右的条带。
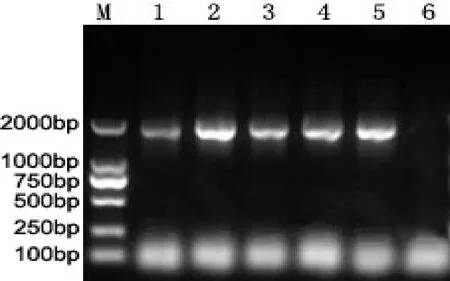
图3 重组质粒PCR鉴定
2.4 重组质粒的酶切鉴定
重组质粒经EcoRI和SalI酶切后,电泳出现一条约2 600 bp和一条约1 400 bp的特异性条带(图4电泳2道)。重组质粒经SalI酶切,出现一条约4 500 bp的条带(图4电泳3道)。
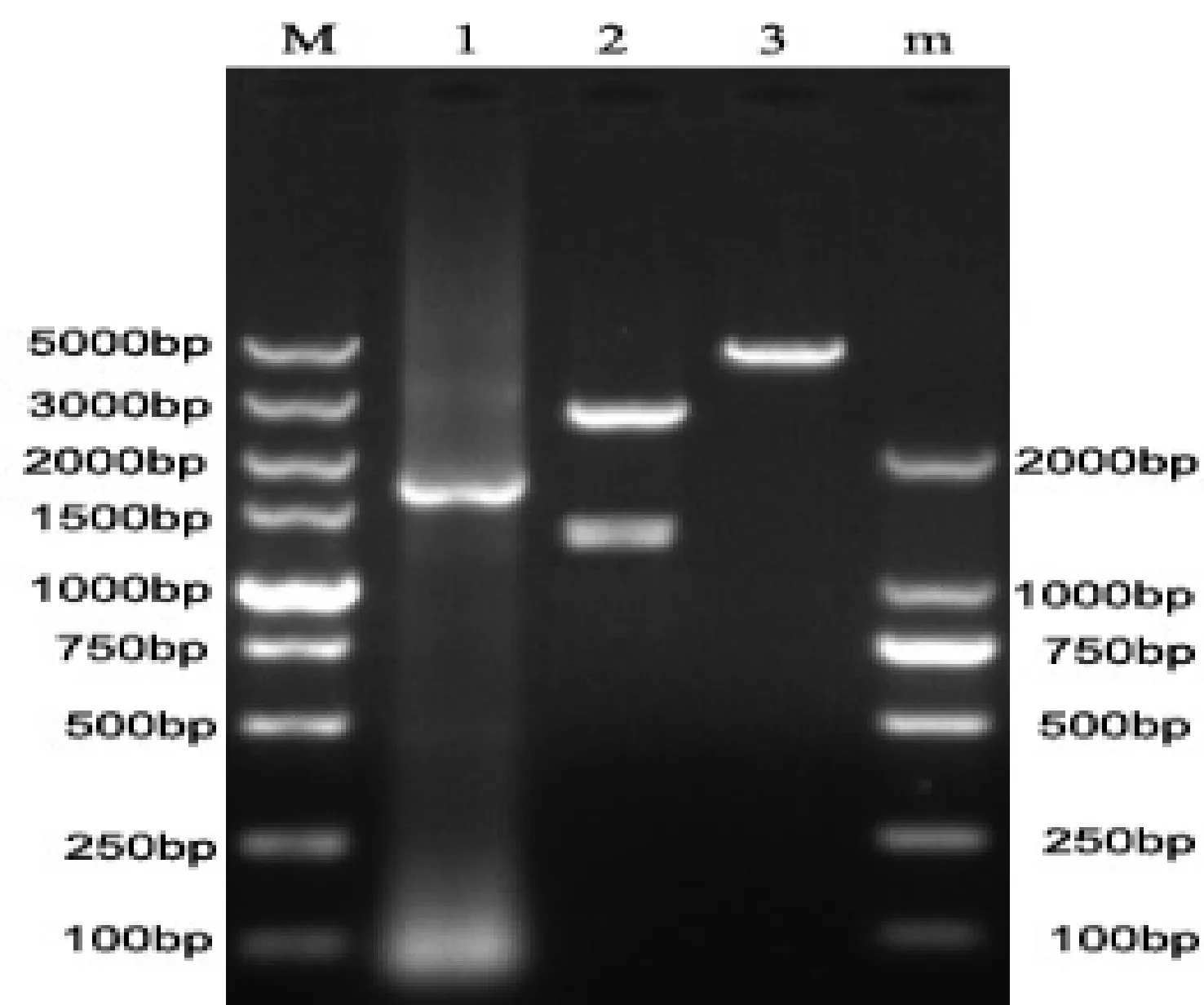
图4 重组质粒的限制性内切酶酶切鉴定
2.5 PCV2全基因组序列测定及分析
2.5.1 序列测定及分析
测序结果表明,5个毒株全基因组长度均为1 767 bp。5个毒株基因组序列的同源性为96.1%~99.9%,其中PY毒株与HY毒株基因组序列的同源性最高(99.9%)(图5)。所测的5个毒株基因组序列与GenBank中其它河南省参考毒株(表1)基因组序列的同源性为95.6%~99.8%,KF毒株与JZS-1毒株基因组序列的同源性最高(99.8%)(图5)。

图5 河南部分地区PCV2全基因组同源性分析

表1 序列对比与分析所参照的河南各地区其它圆环病毒毒株
2.5.2 系统进化树分析
在分析毒株同源性的基础上进一步绘制了系统进化树,如图6所示。PCV2毒株形成两大分支,在PCV2的大分支中又有许多小分支,其中PY和HY在一个大分支,KF、YY和HB在另一个大分支上。
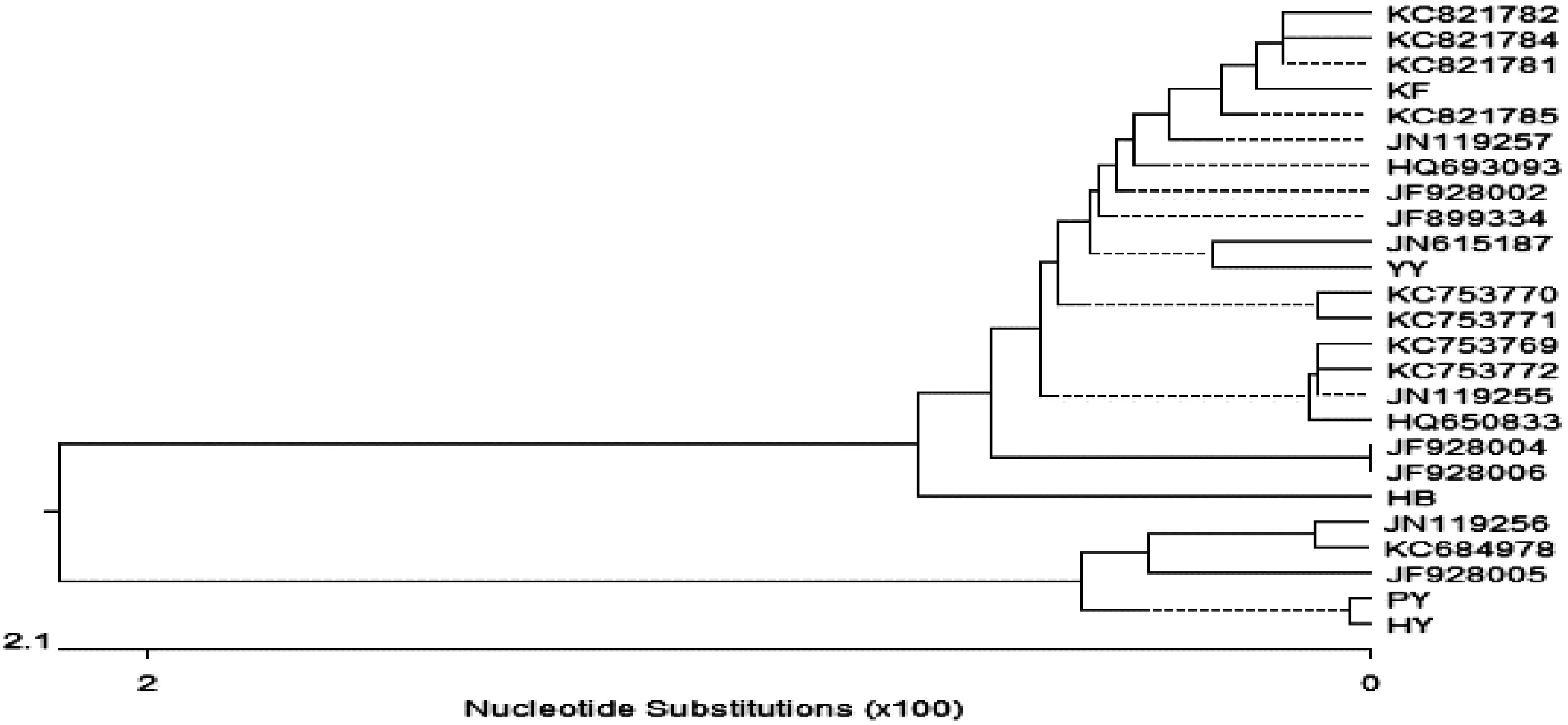
图6 河南部分地区PCV2基因组进化树图
3 讨论
PMWS是近年来影响养猪业的主要疾病之一,PCV2是引起该病的主要病原[6]。PCV2无论在生猪或病死猪中的检出率都非常高,因此对该病的防控已迫在眉睫。本研究对河南省部分猪场圆环病毒基因组序列进行分析,对本地PCV2流行毒株基因遗传变异的研究和候选疫苗的研制具有重要的意义[7]。
本研究先对疑似病料进行检测以确定是否感染,然后进行全基因扩增,这样全基因扩出的机率更高。本研究成功扩增5株PCV2全基因组序列,大小均为1 767 bp。所扩增的5个毒株基因序列的同源性介于96.1%~99.9%,其中 PY毒株与HY毒株基因序列的同源性最高(99.9%)。这5个毒株与GenBank其它河南省参考毒株基因序列的同源性为95.6%~99.8%,KF毒株与JZS-1毒株基因序列的同源性最高(99.8%)。由此可见,PCV2毒株的核苷酸序列都有较高的同源性,说明PCV2毒株间的亲缘关系很近,PCV2病毒进化速度较慢。
