黄芪多糖生物活性检测模型的建立
2020-12-31马发顺崔梦如时志琪梁秀丽宋玉伟元雪浈
马发顺,崔梦如,时志琪,梁秀丽,宋玉伟,元雪浈
(1.安阳工学院生物与食品工程学院,河南 安阳 455000;2.河南省兽用生物制品研发与应用国际联合实验室,河南 安阳 455000;3.河南省兽药饲料监察所,河南 郑州 450000)
黄芪多糖(Astragalus polysaccharides, APS)是中草药黄芪的主要活性成分之一。APS具有抗肿瘤、调节细胞免疫功能、抗炎等作用[1-3]。张敬芳等[4]的研究发现APS可降低患糖尿病大鼠的血糖水平,王岩岩等[5]发现APS对患糖尿病大鼠肾小管的损伤具有良好修复作用。Chen 等[6]研究显示APS能使小鼠脾指数和胸腺指数升高。陈茜等[7]研究表明APS可显著提高蛋鸡的脾指数和法氏囊指数。Lin等[8]发现APS可通过提高机体IgA、IgG、IgM的含量从而提高机体免疫力。左兆云等[9]的研究发现APS能提高鸡蛋品质。甄玉国等[10]发现在断奶仔猪日粮中添加APS可显著降低料肉比。上述关于APS的研究多集中于对免疫功能、动物生产性能等方面的影响,关于APS生物活性检测方面的研究较少[11]。拟采用线性和非线性回归方法构建检测模型,并从中选出最优模型,作为APS生物活性检测时的参考。
1 材料与方法
1.1 材料
1.1.1 试验动物
128只昆明鼠(18~20 g)购自河南省实验动物中心。使用独立送排风隔离笼具(IVC)和EVC笼具进行分笼饲养。所用饲料为SPF级全价饲料,由河南省实验动物中心提供。
1.1.2 试验仪器和药品
电子分析天平(型号为AB204-N)购自上海双旭电子有限公司。无菌注射器(规格为1mL)购自河南曙光健士医疗器械集团股份有限公司。黄芪多糖注射液(规格为100mL:1g)由河南省兽药厂提供。生理盐水(规格为250mL)购自河南科伦药业有限公司。
1.2 方法
1.2.1 试验设计
采取独立试验设计。8种APS样品均设试验组和对照组,小鼠完全随机分组,每组8只,共128只。试验组每只小鼠每天注射APS注射液0.5 mL,对照组小鼠每天每只注射等量生理盐水,试验期7 d。最后一次注射后24 h将小鼠处死,称取体重(w)、脾脏重(s)和胸腺重(t)等。
1.2.2 数据分析
由称取的体重和脾脏重计算脾指数(y),脾指数=脾脏重(mg)/体重(g),按照2015版兽药典规定,试验组与对照组脾指数之差大于或等于2为合格,否则为不合格。数据以“平均值±标准差”表示。采用t检验法进行试验组与对照组间的差异显著性比较。使用DPS v 7.05进行相关和回归分析。分别进行试验组与对照组体重(w)、脾脏重(s)和胸腺重(t)间的相关分析,并分别建立检测模型。
2 结果与分析
2.1 APS生物活性检测结果
8种APS样品生物活性检测结果见表1。按照标准判断,所检测样品A、B、C合格,其余不合格。所检测样品A、B、C试验组和对照组脾指数差异极显著(P<0.01),其余检测样品试验组和对照组脾指数差异不显著(P>0.05),脾指数差异显著性检验支持APS样品生物活性检测检测结果。
2.2 体重(w)、脾脏重(s)和胸腺重(t)间的相关性
试验中所有试验组和对照组各指标间的相关系数见表2。由表2可知,试验组脾指数(y1)与脾脏重(s1)间存在极显著正相关(P<0.01),胸腺重(t1)与体重(w1)间存在显著正相关(P<0.05);对照组脾指数(y2)与脾脏重(s2)间存在极显著正相关(P<0.01),其余各指标间相关性均不显著(P>0.05)。
2.3 检测模型的建立
2.3.1 试验组检测模型
以体重(w1)、脾脏重(s1)和胸腺重(t1)为自变量,以脾指数(y1)为依变量,建立的直线模型为:y1=6.6956-0.2615w1+0.0388s1+1.6301×10-3t1;建立的二次多项式模型为:y1=-0.923 6+0.058 1w1+0.086 1s1-6.902 3×10-3t1-2.033 7×10-3w1·s1+6.618 8×10-5s1·t1。
直线模型和二次多项式模型拟合度R2分别为0.9978和0.9999。两模型中自变量与依变量间的偏相关系数和通径系数如表3所示。
由表3可知,直线模型中w1、s1与y1间的偏相关系数均达到极显著水准(P<0.01),而t1与y1间偏相关系数不显著(P>0.05),从3个自变量对依变量通径分析来看,s1的通径系数最大。二次多项式模型中各项偏相关系数均达到极显著水准(P<0.01),从自变量对依变量的通径分析来看,s1通径系数绝对值最大,其次是w1·s1项。对试验组建立的直线模型和二次多项式模型进行比较,二次多项式型模型比直线模型R2值大,拟合误差更小,且自变量对依变量的偏相关系数显著性更高,所以二次多项式模型更优。
2.3.2 对照组检测模型
以体重(w2)、脾脏重(s2)和胸腺重(t2)为自变量,以脾指数(y2)为依变量建立的直线模型为:
y2=3.8439-0.1442w2+0.0365s2+1.0468×10-3t2;
建立的二次多项式模型为:
y2=-0.763 3+0.080 7s2+1.407 6×10-3w22+5.732 3×10-5t22-1.615 8×10-3w2·s2-3.001 5×10-4w2·t2。
直线模型和二次多项式模型拟合度R2分别为0.998和0.9999。两模型中自变量与依变量间的偏相关系数和通径系数见表4。
由表4可知,直线模型中w2、s2与y2间的偏相关系数均达到极显著水准(P<0.01),而t2与y2间偏相关系数不显著(P>0.05);从3个自变量对依变量通径分析来看,s2的通径系数最大。二次多项式模型中各项偏相关系数均达到极显著水准(P<0.01);从通径分析来看,s2通径系数绝对值最大,其次是w2·s2项。直线模型与二次多项式模型比较来看,二次多项式模型的R2值大于直线模型,拟合误差小,且各自变量的偏相关系数显著性更高,所以二次多项式模型更优。

表4 对照组自变量与依变量间偏相关系数和通径系数
2.4 检测模型的验证
将各样品试验组和对照组的测量值分别代入优化模型,所得拟合值及差值见表5。根据y1与y2的差值判断APS生物活性是否合格,差值大于等于2为合格,小于2为不合格。根据模型计算的8种样品试验组与对照组的脾指数拟合值及差值与实际检测结果完全相同,可见,按照现行的判断标准所建立的2个模型是可行的。
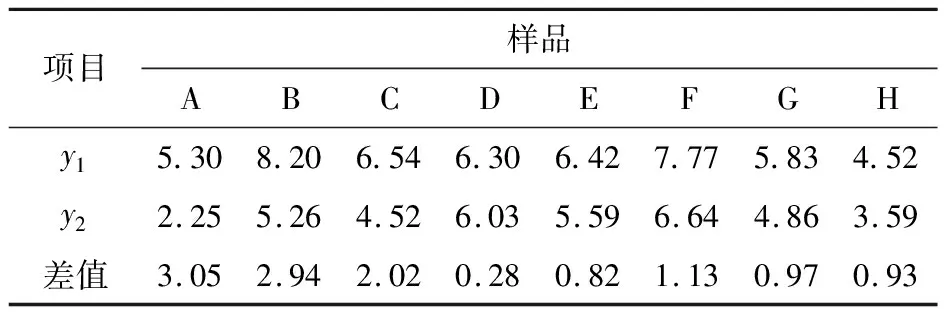
表5 样品试验组与对照组的脾指数拟合值及差值
3 讨论与结论
从8种样品的各指标测定结果来看,数据变异程度较大,试验组与对照组的差异显著无明显的规律性。原因可能是:①在试验设计时没有考虑小鼠的性别因素;②试验动物的个体差异较大,试验虽然遵照随机原则但不能完全消除动物的个体差异;③试验的样本量不是特别充足。今后,在进行APS生物活性检测时,应遵守重复、随机、局部控制原则进行试验设计,并尽可能增加样本量,以降低试验误差。
从相关分析来看,试验组和对照组均是脾脏重与脾指数间存在极显著的正相关(P<0.01),而胸腺重与脾指数间相关不显著(P>0.05),在直线回归分析时偏相关系数也证实了变量间的相关关系。各变量间的相关分析结果与元雪浈等[12]的研究结果相吻合。通径分析表明,无论试验组还是对照组,直线模型中脾脏重对脾指数的影响最大,二次多项式模型中脾脏重及体重与脾脏重的互作项对脾指数的影响较大。
本研究经过优化获得的试验组和对照组的二次多项式检测模型拟合度均高于直线模型,也高于元雪浈等[12]建立的直线模型,说明二次多项式模型更适合于APS生物活性检测。按照2015版兽药典的APS检测方法,若把胸腺重也纳入到检测模型中,可提高检测的准确性和灵敏性。从试验数据代入模型验证情况看,胸腺重的纳入更能证明模型的可靠性。
通过试验建立了APS生物活性检测模型,试验组为y1=-0.923 6+0.058 1w1+0.086 1s1-6.902 3×10-3t1-2.033 7×10-3w1·s1+6.618 8×10-5s1·t1;对照组为y2=-0.763 3+0.080 7s2+1.407 6×10-3w22+5.732 3×10-5t22-1.615 8×10-3w2·s2-3.001 5×10-4w2·t2。二次多项式型模型更适用于临床APS的生物活性检测。
