红花CtMYB44基因核心片段的克隆与序列分析
2020-12-31连瑞丽李宇伟卢婷婷李利红姬向波唐桂芬伊立阳孙宇峥
连瑞丽,李宇伟,卢婷婷,赵 丽,李利红,姬向波,2,唐桂芬,伊立阳,孙宇峥,王 霞
(1.河南牧业经济学院 动物医药学院,河南 郑州 450046;2.河南牧业经济学院 实验研究中心,河南 郑州450046;3.河南省非常规饲料资源创新利用重点实验室,河南 郑州 450046;4.郑州市世纪公园,河南 郑州 450000)
红花(CarthamustinctoriusL.),又名草红花,为菊科红花属草本植物,主产于河南、湖北、四川、云南、浙江等地,其中以产地为四川的川红花和产地为河南的怀红花名气大、质量好[1]。红花中含的有效成分主要有红花黄色素、红花醌苷、新红花苷、红花苷和红花油等,其中红花黄色素是红花的主要有效成分,属于黄酮类化合物,具有抑制血栓形成、修复血管内皮损伤、抗氧化等多种药理作用[2,3]。
MYB转录因子是植物中最常见的一类转录因子,从单子叶植物玉米提取出转录因子以来,人们开始加大了对转录因子的研究[4-6]。研究发现多个MYB家族转录因子参与植物的生长调控[7-9]。MYB转录因子广泛参与调控黄酮类物质的合成[10-12],如拟南芥AtMYB11、AtMYB12通过调控查尔酮合成酶基因和查尔酮异构酶基因的表达来调控黄酮类物质的合成[13-15]。虽然近几年有人逐渐开展红花转录组的测序工作[16-18],但迄今为止关于红花中MYB转录因子的研究较少。本研究对红花MYB转录因子的基因进行扩增和克隆,并对克隆序列进行测序和生物信息学分析,为进一步解析红花中黄酮类化合物合成的调控机制奠定基础[19,20]。
1 材料与方法
1.1 试验材料
本试验所用红花采集于河南牧业经济学院中药材园。大肠杆菌DH5ɑ由河南牧业经济学院实验研究中心提供。逆转录试剂盒购自普洛麦格(北京)生物技术有限公司。植物总RNA提取试剂盒、DNA胶回收试剂盒和pGEM-T Easy载体购自天根生物科技(北京)有限公司。
1.2 主要试验仪器
PCR仪购自北京东胜创新生物科技有限公司。EPS-100核酸电泳仪和Invitrogen E-Gel Imager凝胶成像仪购自上海天能科技有限公司。超微量紫外分光光度计购自赛默飞世尔科技(中国)有限公司。台式高速离心机购自湖南湘立科学仪器有限公司。
1.3 试验方法
1.3.1 引物合成
根据NCBI发布的红花MYB基因序列(GemeBank登录号为KY554784),设计红花CtMYB44基因核心序列简并引物P1和P2,用于红花CtMYB44基因核心序列的扩增[19,20]。
P1:5’-TTTACAATCGCTGG(A/T)CC-3’
P2:5’-AATC(A/T/C)CTCACTTCGTTCTT-3’
1.3.2 红花花瓣总RNA的提取、分析与反转录
选取新鲜红花花瓣,按照RNA提取试剂盒的说明书提取红花花瓣总RNA,利用核酸分析仪对提取的总RNA进行纯度和浓度分析,每个样品3个重复。按照反转录试剂盒的操作说明,进行cDNA链合成,反转录后的cDNA保存于-20 ℃备用。
1.3.3 RT-PCR扩增与产物回收
PCR反应程序为94 ℃预变性5 min,94 ℃变性60 s,56 ℃退火45 s,72 ℃延伸90 s,34个循环,72 ℃最终延伸7 min。1%琼脂糖电泳检测PCR扩增产物,回收单一DNA片段(按照天根生物科技公司的DNA胶回收试剂盒说明进行)。
1.3.4 阳性克隆的筛选与测序
将1.2.3纯化回收的单一DNA片段与pGEM-T载体连接,然后转化大肠杆菌感受态DH5α中,涂布在LB固体培养基上,37 ℃倒置于培养箱,培养过夜,挑取PCR鉴定符合条件的菌落进行质粒提取,送至尚亚生物技术有限公司测序。
1.2.5 生物信息学分析
通过在线工具ExPASy(http://www.expasy.org/)预测氨基酸序列。使用NCBI(https://www.ncbi.nlm.nih.gov/)BLAST功能进行序列比对,选出与红花CtMYB44基因同源性较高的8种植物的9条MYB序列,包括红花(Carthamustinctorius)、猴面花(Erythrantheguttatus)、野草莓(Fragariavesca)、野大豆(Glycinesoja)、苹果(Malusdomestica)、白梨(Pyrusbretschneideri)、三裂叶薯(Ipomoeatriloba)、醉蝶花(Tarenayahassleriana),下载它们的基因序列,利用MEGA 7.0软件进行多序列比对并构建系统进化树。利用ScanProsite(http://prosite.expasy.org/scanprosite/)在线进行氨基酸序列保守结构域分析。
2 结果与分析
2.1 总RNA的提取及质量分析
总RNA的质量分析结果如下:OD260/OD280平均比值为2.10,260/230平均比值为1.86,总RNA平均浓度为561.3 ng/μL,表明RNA的纯度和浓度都符合要求(图1)。
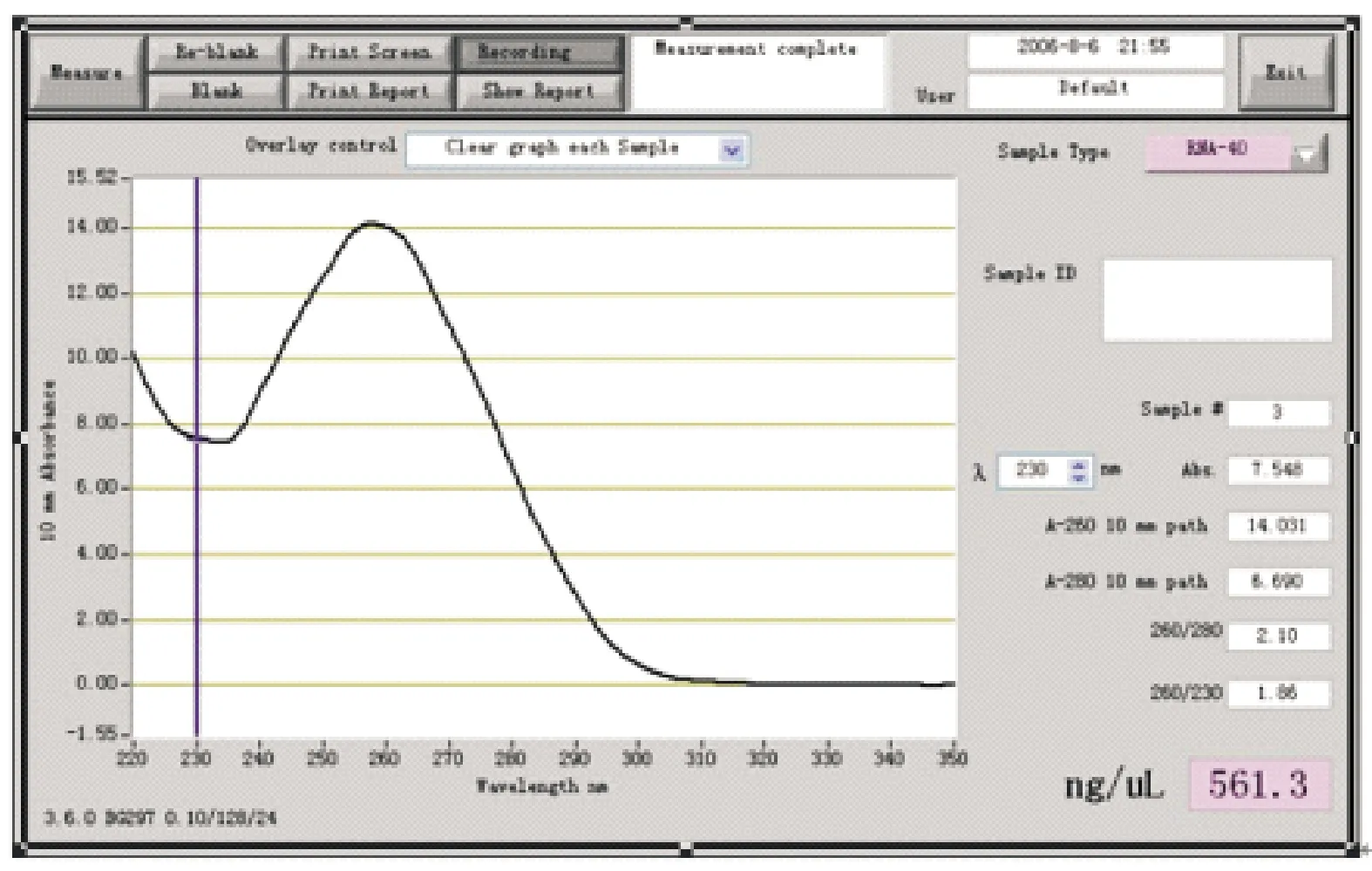
图1 红花总RNA质量分析
2.2 红花CtMYB44基因序列的RT-PCR扩增
以新鲜红花花瓣提取的总RNA为模板逆转录生成cDNA,然后以cDNA为模板进行红花CtMYB44核酸序列的PCR扩增。琼脂糖凝胶电泳检测发现在750 bp附近可见清晰条带(图2),推测此条带可能是目的片段。
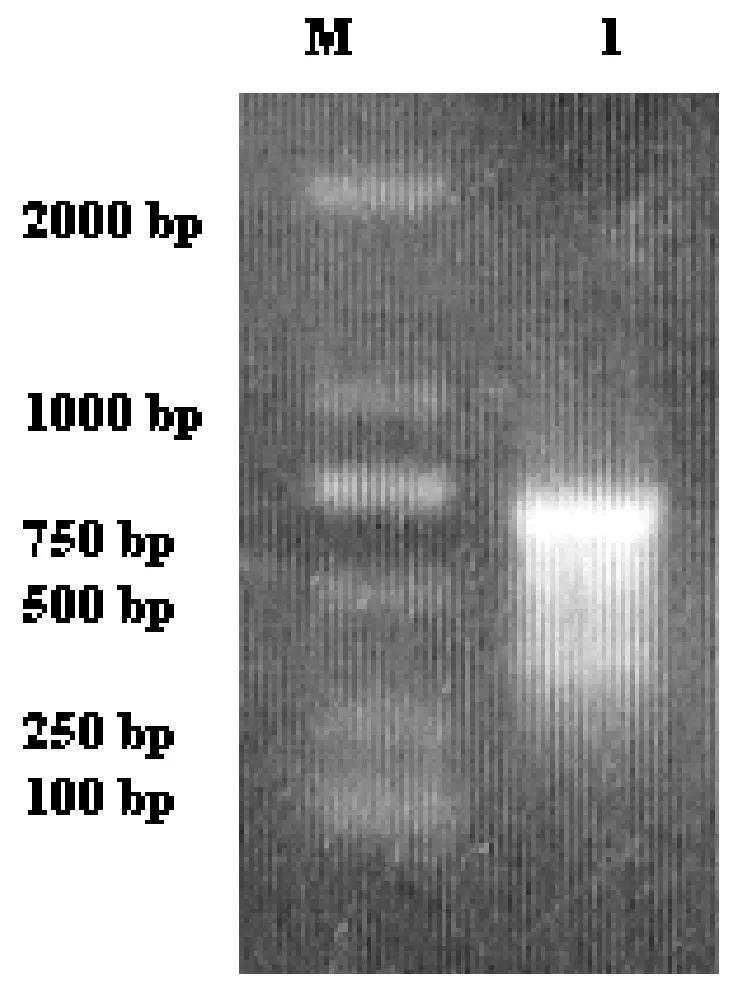
图2 红花CtMYB44核心片段的RT-PCR扩增结果
2.3 序列测定结果
将菌落PCR检测为阳性的克隆提取质粒并测序,序列全长为723 bp,编码241个氨基酸残基,命名为CtMYB44(图3)。

图3 红花CtMYB44 cDNA片段的核苷酸序列及预测的氨基酸序列
2.3.2 同源序列比对及保守结构域分析
将红花CtMYB44的核苷酸序列进行相似性分析,发现其与NCBI发布的红花(Carthamustinctorius)MYB-1和MYB-2相似性分别为98.21%和99.51%,与三裂叶薯(Ipomoeatriloba)、猴面花(Erythrantheguttatus)、野草莓(Fragariavesca)、野大豆(Glycinesoja)、苹果(Malusdomestica)、白梨(Pyrusbretschneideri)、醉蝶花(Tarenayahassleriana)相似性都在80%以上。
利用MEGA 7.0软件将CtMYB44与上述基因序列进行多重比对,发现本试验克隆片段与已发现的MYB基因核酸序列具有高度保守区域(图4)。功能结构域预测分析表明CtMYB44氨基酸序列中含有典型DNA结合区域HTH(螺旋—转角—螺旋)结构,属于转录因子MYB超家族成员(图5)。

图4 红花CtMYB44与其他植物MYB基因的同源序列比较

图5 红花CtMYB44保守域分析
2.3.3 进化分析
将红花CtMYB44的核苷酸序列与红花(Carthamustinctorius)、三裂叶薯(Ipomoeatriloba)、猴面花(Erythrantheguttatus)、野草莓(Fragariavesca)、野大豆(Glycinesoja)、苹果(Malusdomestica)、白梨(Pyrusbretschneideri)、醉蝶花(Tarenayahassleriana)的MYB基因序列利用MEGA 7.0构建系统进化树,结果显示CtMYB44与红花(Carthamus tinctorius)的MYB-1、MYB-2亲缘关系最近,其次为猴面花(Erythrantheguttatus)和三裂叶薯(Ipomoeatriloba),与苹果(Malusdomestica)和白梨(Pyrusbretschneideri)亲缘关系较远(图6)。
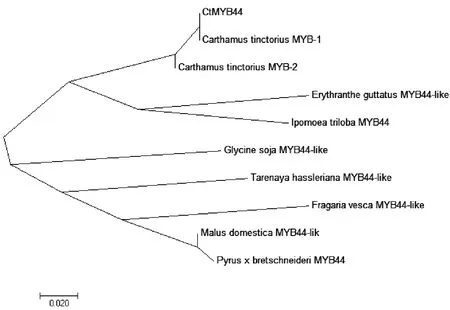
图6 红花CtMYB44与其他植物MYB基因的同源性分析
3 讨论
转录因子是一类能与启动子结合并调控下游基因表达的特殊蛋白,通过与相关蛋白的相互作用来调控细胞在转录水平上的表达,从而实现对植物生理的调控,常见的转录因子有MYB、WRKY、bZIP、AP2和NAC等。MYB转录因子是植物最大的转录因子家族之一,根据其蛋白的重复结构域数量可以分为4R-MYB、3R-MYB、4R-MYB和R2R3-MYB等4类,植物中绝大多数是R2R3-MYB转录因子[18,21]。
本实验以红花花瓣为实验材料,成功提取并克隆了红花CtMYB44基因核心片段,全长723 bp,编码241个氨基酸残基。通过同源性分析及进化关系分析发现本研究克隆的CtMYB44基因与之前发布的红花基因(MF156605.1和MF156606.1)相似性分别为98.21%和99.51%,与三裂叶薯(Ipomoeatriloba)、猴面花(Erythrantheguttatus)等MYB核酸序列的相似性也达80%以上,充分证明红花CtMYB44基因核心序列与已知MYB基因具有很高的相似性。保守结构域分析发现其含有MYB典型DNA结合区域,说明该序列是红花MYB基因家族的一员。
由于红花CtMYB44并不是全长基因,无法推测完整编码氨基酸序列,所以难以判断CtMYB44编码产物属于MYB基因家族中的哪种类型,后续研究将进一步验证CtMYB44转录因子是否参与调控红花黄酮类成分的合成。本研究结果丰富了红花MYB基因的核酸数据库,为进一步深入研究红花MYB基因的功能奠定基础。
