肝细胞生长因子激酶抑制剂在乳腺癌上皮-间充质转化及细胞增殖侵袭中的作用△
2020-12-30刘海旺张宏旭刘燃郝美玲李春辉
刘海旺,张宏旭,刘燃,郝美玲,李春辉#
承德医学院附属医院1病理科,2乳腺科,3麻醉科,河北 承德 067000
乳腺癌是女性常见的恶性肿瘤之一,其发病率逐年上升,按性别估算的10种主要肿瘤类型中,乳腺癌在女性中发病率居第一位,病死率居第二位[1]。已知肝细胞生长因子(hepatocyte growth factor,HGF)及其受体c-MET的信号转导与胚胎发育、组织细胞修复密切相关,而HGF/c-MET信号转导的异常调节与肿瘤的发生、发展及恶性生物学行为密切相关,包括肿瘤细胞的侵袭、转移、上皮-间充质转化(epithelial-mesenchymal transition,EMT)以及血管生成等[2]。HGF是c-MET的配体,c-MET可以通过自身突变、过表达等途径激活其配体HGF的作用,促使相应的信号转导级联反应,进而对人体生物学和生化功能产生影响[3]。EMT促进肿瘤细胞的侵袭、迁移和抑制凋亡,在肿瘤侵袭转移中起着重要作用。多个因子如蜗牛家族转录抑制因子1(Snail family transcriptional repressor 1,Snail1)、蜗牛家族转录抑制因子2(Snail family transcriptional repressor 2,Snail2)、上皮钙黏蛋白(E-cadherin,E-cad)和波形蛋白(Vimentin),它们在转录和翻译等水平诱导EMT[4]。本研究旨在研究HGF/c-MET激酶抑制剂在乳腺癌EMT及细胞侵袭中的潜在机制,进而了解激酶抑制剂在体内外的作用机制,从而为乳腺癌患者的治疗提供一定的理论依据。
1 材料与方法
1.1 材料
乳腺癌MCF-7细胞购自中国医学科学院基础医学细胞中心。c-MET和E-cad引物均由上海生工公司设计。E-cad、Snail、神经型钙黏蛋白(N-cadherin,N-cad)单克隆抗体均购自Santa Cruz公司,β-actin鼠单克隆抗体和辣根过氧化酶(horseradish peroxidase,HRP)标记的兔抗鼠二抗均购自北京中杉金桥生物技术公司。胎牛血清(fetal bovine serum,FBS)和RPMI-1640培养基均购自Hy-Clone公司,Transwell小室购自美国康宁公司,RNA提取试剂盒、反转录试剂盒、荧光定量试剂均购自TaKaRa试剂公司,CCK-8试剂盒购自武汉博士德生物公司,PHA-665752小分子抑制剂购自selleck公司,TBST、RIPA裂解液和电化学发光(electrochemiluminescence,ECL)试剂盒均购自上海碧云天生物技术公司。
1.2 实验方法
1.2.1 细胞培养 在37℃、5%CO2条件下培养乳腺癌MCF-7细胞,加入适量含10%FBS的RPMI-1640培养基,细胞每2天换液一次,然后按1∶3比例传代。培养至对数生长期,用0.25%胰蛋白酶消化处理并制备成单细胞悬液,用于后续实验。实验分组包括:空白组(单独培养基)、对照组(培养基+DMSO)、研究组(培养基+0.1 μmol/L PHA-665752组,培养基+0.5 μmol/L PHA-665752组,培养基+1.0 μmol/L PHA-665752组)。
1.2.2 CCK- 8法检测细胞增殖能力 将乳腺癌MCF-7细胞制备成单细胞悬液分别接种于96孔板,每孔100 μl,培养12 h后分为研究组和对照组,继续孵育24 h后,在上述培养基孔中加入终浓度为10%的CCK-8试剂,在37℃培养箱中继续孵育2 h。酶联免疫检测仪于450 nm波长下检测各孔吸光度(A)值,并绘制肿瘤细胞生长曲线。细胞活力(%)=(研究组A值-空白组A值)(/对照组A值-空白组A值)×100%。
1.2.3 Transwell实验检测细胞侵袭能力 将基膜基质原液和预冷的无血清RPMI-1640培养液按1∶3比例配置上室凝胶液,取50 μl凝胶液均匀覆盖于Transwell小室底部。取处于对数生长期的MCF-7细胞,调整细胞密度为3×105/ml,吸取100 μl细胞悬液置于上室孵育24 h,再取出Transwell小室,按照说明书进行固定、染色,膜的下室表面细胞即为侵袭细胞,显微镜观察染色细胞,每张片子选取5个视野,统计细胞数目算出平均值,每组设置3个平行小室,重复3次,以穿膜细胞数评价其侵袭能力。
1.2.4 实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction, qRT-PCR)检测mRNA相对表达量 收集培养皿中的细胞,用Trizol试剂提取乳腺癌MCF-7细胞总RNA。逆转录生成cDNA,用于后续PCR扩增,以β-actin作为内参基因,PCR参数设置:95℃30 s,95℃5 s,60℃30 s,72℃ 10 s,40个循环,结果以荧光阈值循环数(Ct)值输出,依据 2-△△Ct公式[5],计算目的基因相对于内参基因的相对表达量,再进行数据统计分析,每组进行3次实验,取均值。所有上述步骤严格按照说明书操作,引物序列详见表1。

表1 c-MET、E-cad、 β-actin基因的引物序列
1.2.5 蛋白质印迹法(Westernblot)检测蛋白相对表达量 采用蛋白提取试剂盒提取研究组和对照组乳腺癌MCF-7细胞的总蛋白,采用紫外分光光度计测定提取的蛋白质浓度,再经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphatepolyacryl amide gel electrophoresis,SDS-PAGE),转膜至甲醇预处理过的聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),再用脱脂牛奶封闭,滴加兔抗人E-cad、N-cad和Snail一抗(1∶500),4℃孵育过夜,加入TBST洗膜,加入HRP标记的二抗(1∶1000)孵育1 h,ECL显示,收集影像,采用凝胶图像处理系统软件分析各组条带灰度值,依据相对灰度值进行统计学分析。
1.3 统计学分析
采用SPSS 17.0软件进行数据分析,计量资料以均数±标准差(±s)表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 c-MET抑制剂PHA-665752对乳腺癌MCF- 7细胞增殖的影响
CCK-8法检测结果显示,分别用0.1、0.5、1.0 μmol/L PHA-665752剂量处理 12、24、48 h后,c-MET激酶抑制剂剂量依赖性地抑制乳腺癌细胞MCF-7的增殖能力(F=53.367、116.219、44.758,P<0.05)。与对照组比较,0.1 μmol/L PHA-665752处理48 h后细胞活力降低(P<0.05);与0.1 μmol/L PHA-665752组比较,0.5 μmol/L PHA-665752处理24、48 h后细胞活力均降低(P<0.05);与0.5 μmol/L PHA-665752组比较,1.0 μmol/L PHA-665752处理12、24、48 h后细胞活力均降低(P<0.05)。(表2)

表2 不同时间点各组乳腺癌MCF- 7细胞活力的比较(%)
2.2 乳腺癌MCF-7细胞侵袭能力的比较
Transwell检测结果显示,0.5 μmol/L PHA-665752研究组MCF-7细胞处理24 h后侵袭细胞数为(24.33±1.53),少于对照组的(93.00±5.57),差异有统计学意义(P<0.05)。(图1)
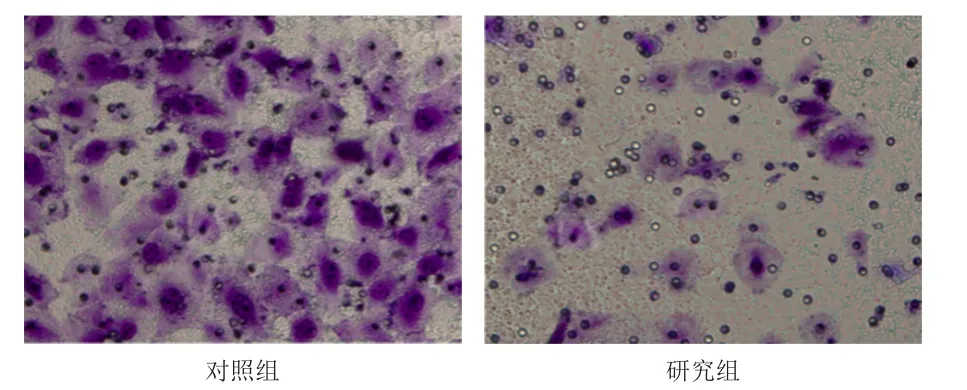
图1 Transwell法检测 0.5μmol/LPHA-665752研究组与对照组乳腺癌MCF- 7细胞的侵袭能力(结晶紫染色,×100)
2.3 c-MET、E-cad mRNA相对表达量的比较
处理12 h时,对照组与0.5 μmol/L PHA-665752组乳腺癌MCF-7细胞c-MET、E-cadmRNA相对表达量比较,差异均无统计学意义(P>0.05)。处理24 h时,0.5 μmol/L PHA-665752组乳腺癌MCF-7细胞c-METmRNA相对表达量低于对照组,E-cadmRNA相对表达量高于对照组,差异均有统计学意义(P<0.05)。(表3)
表3 不同时间点两组细胞c-MET、E-cad mRNA相对表达量的比较(± s)
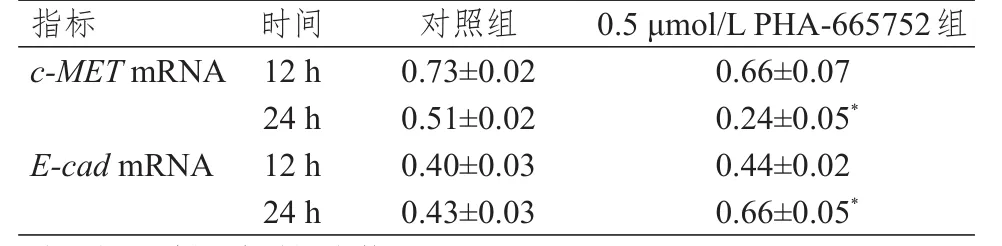
表3 不同时间点两组细胞c-MET、E-cad mRNA相对表达量的比较(± s)
注:*与同时间对照组比较,P<0.05
指标c-MET mRNA E-cad mRNA 12 h 24 h 12 h 24 h 0.73±0.02 0.51±0.02 0.40±0.03 0.43±0.03 0.66±0.07 0.24±0.05*0.44±0.02 0.66±0.05*时间 对照组0.5 μmol/L PHA-665752 组
2.4 EMT相关蛋白表达情况的比较
通过形态学观察,与对照组相比,0.5 μmol/L PHA-665752组MCF-7细胞处理24 h后较密集、细胞未拉长,未出现EMT形态特点。Western blot结果显示,0.5 μmol/L PHA-665752组 MCF-7细胞E-cad蛋白表达水平高于对照组,N-cad、Snail蛋白表达水平均低于对照组,差异均有统计学意义(P<0.05)。(图2、表4)

图2 Western blot法检测对照组与0.5μmol/L PHA-665752组乳腺癌MCF- 7细胞中E-cad、N-cad、Snail蛋白表达情况
表4 0.5 μmol/L PHA-665752组与对照组乳腺癌MCF-7细胞中Snail 、N-cad 、E-cad 蛋白表达水平的比较(±s)
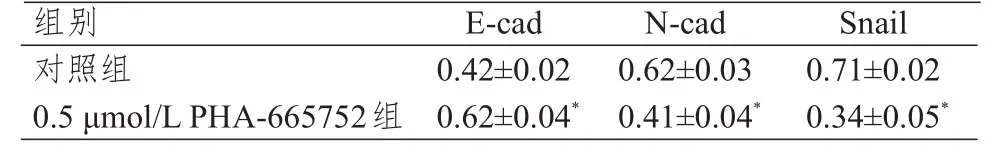
表4 0.5 μmol/L PHA-665752组与对照组乳腺癌MCF-7细胞中Snail 、N-cad 、E-cad 蛋白表达水平的比较(±s)
注:*与对照组比较,P<0.05
组别对照组0.5 μmol/L PHA-665752组E-cad 0.42±0.02 0.62±0.04*N-cad 0.62±0.03 0.41±0.04*Snail 0.71±0.02 0.34±0.05*
3 讨论
乳腺癌是全世界发病率位居前列的肿瘤,也是女性中最常见的恶性肿瘤,每年新增病例209万例(占女性癌症总数的24.2%),每年因肿瘤导致60万患者死亡[6]。乳腺触诊结合高频超声筛查乳腺癌并进行跟踪随访发现,城镇妇女乳腺癌发病率明显高于农村妇女[7]。c-MET基因位于7号染色体上,由50 kD的胞外α链和140 kD的一个跨膜β链通过二硫键相连形成异二聚体,受体具有自身磷酸化活性特点[8]。c-MET是HGF的细胞表面受体,其蛋白表达与乳腺癌组织学分级和淋巴结转移有关,c-MET在乳腺癌中过表达可能参与乳腺癌的进展[9]。Motomura等[10]研究提示c-MET和PKCλ共同参与了乳腺癌的进展,并导致乳腺癌预后不良。研究证实,结肠癌转移相关基因(metastasis-associated in colon cancer protein 1,MACC-1)与 c-MET共同参与乳腺癌细胞增殖、浸润及血管生成,与组织分化程度、浸润程度、淋巴结转移及临床分期显著相关[11]。本研究中,与对照组比较,使用c-MET激酶抑制剂后c-METmRNA表达受到抑制,E-cadmRNA表达升高,说明c-MET激酶抑制剂PHA-665752可以有效抑制HGF/c-MET信号通路。
当肿瘤发展到一定阶段,细胞侵袭和浸润能力会随着肿瘤的恶性转化而增强。EMT在肿瘤细胞浸润过程中起重要的作用。Tavakolian等[12]研究表明乳腺癌细胞侵袭转移相关的特征与EMT有紧密联系,E-cad的表达下调也能显著增强乳腺癌侵袭转移能力,而给予外源性E-cad则能够抑制乳腺癌的转移;Vimentin表达的增加与肿瘤的侵袭转移呈正相关。周珏等[13]表明E-cad的表达缺失或下调使细胞间的黏附力下降,促使连环蛋白发生易位,从而激活相关的下游信号分子诱导N-cad等的产生,E-cad下调及N-cad的高表达与肿瘤分化差、高侵袭性密切相关。本研究Western blot结果显示,与对照组相比,使用c-MET激酶抑制剂后E-cad蛋白表达水平升高,N-cad和Snail蛋白表达水平下降,说明当上皮细胞间黏附能力得到了一定程度的恢复,上皮细胞的侵袭性和迁移能力显著下降。同时也证明了抑制HGF/c-MET信号通路后乳腺癌EMT及细胞侵袭转移受到显著抑制,且随着抑制剂浓度的增加,EMT及细胞侵袭转移的抑制程度显著增加,表明在一定程度内细胞的EMT及细胞侵袭转移能力与HGF/c-MET信号通路有关。
综上所述,利用c-MET激酶抑制剂影响HGF/c-MET信号通路可以有效抑制乳腺癌EMT及细胞的侵袭和转移,其作用机制可能与降低c-MET、N-cad和Snail蛋白表达,升高E-cad蛋白表达有关。但调控HGF/c-MET信号通路的相关小分子抑制剂较多,在后续的实验中希望可以深入研究c-MET抑制剂对其他信号通路及与HGF/c-MET之间交互机制的作用。
