人表皮生长因子受体 2阳性乳腺癌患者程序性死亡受体配体 1和免疫组化标志物表达与新辅助化疗疗效的关系
2020-12-30陆娟冯晨露赵旭林
陆娟,冯晨露,赵旭林
南阳市第一人民医院肿瘤科,河南 南阳 473000
乳腺癌是女性常见的恶性肿瘤,发病率居中国恶性肿瘤第2位,病死率居中国恶性肿瘤第5位[1]。随着人们生活水平的提高和生活方式的改变,乳腺癌的发病年龄趋于年轻化,且呈逐年递增趋势,已经成为严重威胁人类健康的主要公共卫生问题之一[2]。乳腺癌的分子分型包括三阴性、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性、Luminal A型、Luminal B型,约25%的乳腺癌患者为HER2阳性乳腺癌患者,HER2阳性乳腺癌通常表现出组织学分级高、分化程度低、增殖能力强、转移能力强等恶性生物学行为,往往预后不良[3]。新辅助化疗是HER2阳性乳腺癌理想的治疗手段之一,能够改善患者的生存情况,但患者对化疗的敏感性仍是临床难点[4]。因此,寻找预测新辅助化疗疗效的生物学标志物对HER2阳性乳腺癌个体化治疗方案的选择具有重要意义。程序性死亡受体配体1(programmed cell death 1 ligand 1,PDCD1LG1,也称 PD-L1)是一种跨膜糖蛋白,能够阻止淋巴结中抗原特异性T细胞聚积,抑制淋巴结CD8+T细胞增生[5]。拓扑异构酶Ⅱα(topoisomeraseⅡα,TopoⅡα)是一种蛋白酶,与DNA复制、转录、修复、代谢等密切相关,是蒽环类药物作用靶点之一[6]。细胞核增殖相关抗原Ki-67是一种能够反映细胞增殖状态的核抗原,与肿瘤增殖、浸润、侵袭、转移等过程相关[7]。研究报道,Ki-67、TopoⅡα、PD-L1在乳腺癌中异常表达,并与乳腺癌发生及进展密切相关[8-10]。但Ki-67、TopoⅡα、PD-L1在HER2阳性乳腺癌中的表达情况与新辅助化疗疗效的关系尚不清楚,本研究对其进行了探讨,以期为HER2阳性乳腺癌的早期诊断、预后评估提供理论依据,现报道如下。
1 资料与方法
1.1 一般资料
收集2016年8月至2017年8月于南阳市第一人民医院确诊的HER2阳性乳腺癌患者的病历资料。纳入标准:①符合《中国抗癌协会乳腺癌诊治指南与规范(2015版)》中关于HER2阳性乳腺癌的诊断标准;②女性,单侧浸润性导管癌;③既往未接受手术、放疗、化疗、靶向治疗、内分泌治疗等抗肿瘤治疗;④接受了新辅助化疗,方案包括环磷酰胺+表柔比星+5-氟尿嘧啶(CEF)方案、紫杉醇+表柔比星(ET)方案以及抗HER2药物;⑤依从性好。排除标准:①合并心、肝、肾功能障碍;②病历资料不齐全;③合并血液系统疾病;④合并其他恶性肿瘤;⑤合并自身免疫性疾病。根据纳入和排除标准,本研究共纳入93例HER2阳性乳腺癌患者,其年龄为25~75岁,平均年龄为(43.6±9.8)岁;≥60岁27例,<60岁66例;月经状态:未绝经18例,绝经75例;肿瘤直径:≤2 cm 41例,>2 cm 52例;有淋巴结转移者55例,无淋巴结转移者38例;组织学分级:1~2级24例,3级69例;TNM分期:Ⅰ~Ⅱ期33例,Ⅲ~Ⅳ期60例。收集所有HER2阳性乳腺癌患者的乳腺癌组织及其相应的癌旁正常组织(距肿瘤组织边缘>5 cm)。
1.2 检测方法
1.2.1 主要仪器及试剂KD-1508A型组织切片机购自浙江省金华市科迪仪器设备有限公司,二甲苯购自上海继锦化学科技有限公司,柠檬酸钠缓冲液购自上海高创化学科技有限公司,磷酸盐缓冲液(phosphate buffered saline,PBS)购自上海广锐生物科技有限公司,山羊血清购自上海联迈生物工程有限公司,兔抗人Ki-67单克隆抗体购自北京博奥森生物技术有限公司,兔抗人TopoⅡα单克隆抗体购自北京绿源伯德生物科技有限公司,兔抗人PD-L1单克隆抗体购自苏州派普泰克生物科技有限公司,羊抗鼠免疫球蛋白G(immunoglobulin G,IgG)购自北京博尔西科技有限公司,二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒购自上海邦奕生物科技有限公司,苏木素购自安徽永纯生物技术有限公司,梯度乙醇购自上海百由生物科技有限公司,中性树脂固封剂购自南昌雨露实验器材有限公司,CX40型显微镜购自宁波舜宇仪器有限公司。
1.2.2 免疫组织化学染色 采用免疫组织化学染色法检测Ki-67、TopoⅡα、PD-L1在乳腺癌组织及癌旁正常组织中的表达情况。具体方法:采用KD-1508A型组织切片机将其制作成厚度为4 μm的蜡块连续切片,二甲苯脱蜡,柠檬酸钠缓冲液抗原修复,PBS漂洗,内源性过氧化物酶灭活,加山羊血清封闭,滴加稀释比例为1∶200的兔抗人Ki-67单克隆抗体、稀释比例为1∶200的兔抗人TopoⅡα单克隆抗体、稀释比例为1∶200的兔抗人PD-L1单克隆抗体,4℃孵育过夜,PBS漂洗,滴加稀释比例为1∶1000的羊抗鼠IgG,37℃孵育20 min,PBS漂洗,使用DAB显色试剂盒进行显色5 min,苏木素复染,梯度乙醇脱水,中性树脂固封剂封固。由两位病理科医师使用CX40型显微镜观察阳性细胞率和着色程度。
1.2.3 免疫组织化学染色结果判定 Ki-67、TopoⅡα、PD-L1主要定位于细胞核,阳性细胞呈棕黄色或棕褐色颗粒状。依据阳性细胞所占百分比和染色强度进行评分,将二者评分之积作为最终得分,0~3分判定为阴性,>3分判定为阳性。Ki-67、TopoⅡα、PD-L1均阳性判定为Ki-67、TopoⅡα、PD-L1共表达,否则为Ki-67、TopoⅡα、PD-L1非共表达[10]。
1.3 观察指标
比较Ki-67、TopoⅡα、PD-L1在乳腺癌组织及癌旁正常组织中的阳性表达情况。采用Miler and Payne(MP)治疗反应评价系统评价新辅助化疗(不包括靶向治疗)的疗效,其中,1~2级判定为无效,3~5级判定为有效[3]。
1.4 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示;计数资料以例数或率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 Ki-67、TopoⅡ α、PD-L 1在乳腺癌组织及癌旁正常组织中的表达情况
免疫组化染色结果显示,Ki-67、TopoⅡα、PD-L1主要定位于细胞核,阳性细胞呈棕黄色或棕褐色颗粒状(图1)。Ki-67、TopoⅡα、PD-L1在乳腺癌组织中的阳性表达率分别为67.74%(63/93)、58.06%(54/93)、35.48%(33/93),分别明显高于癌旁正常组织中的12.90%(12/93)、9.68%(9/93)、5.38%(5/93),差异均有统计学意义(χ2=58.112、48.606、25.929,P<0.01)。
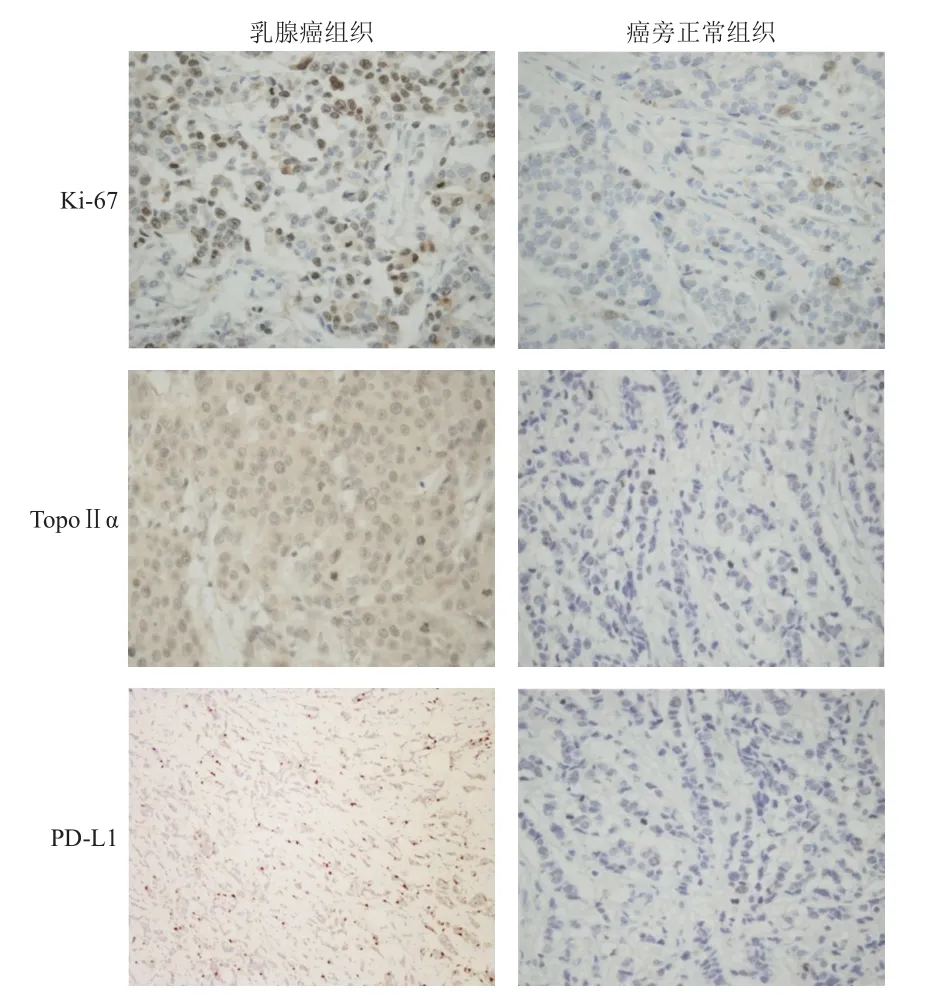
图1 Ki-67、TopoⅡ α、PD-L 1在乳腺癌组织及癌旁正常组织中的表达情况(免疫组织化学染色,×200)
2.2 不同临床特征乳腺癌患者乳腺癌组织中Ki-67、TopoⅡ α、PD-L 1表达情况的比较
不同年龄、月经状态、肿瘤直径乳腺癌患者乳腺癌组织中Ki-67、TopoⅡα、PD-L1的阳性表达率比较,差异均无统计学意义(P>0.05)。组织学分级为3级、TNM分期为Ⅲ~Ⅳ期、有淋巴结转移的乳腺癌患者乳腺癌组织中Ki-67的阳性表达率均高于组织学分级为1~2级、TNM分期为Ⅰ~Ⅱ期、无淋巴结转移的乳腺癌患者,差异均有统计学意义(χ2=10.065、18.810、12.205,P<0.05)。组织学分级为3级、TNM分期为Ⅲ~Ⅳ期、有淋巴结转移的乳腺癌患者乳腺癌组织中TopoⅡα的阳性表达率均高于组织学分级为1~2级、TNM分期为Ⅰ~Ⅱ期、无淋巴结转移的乳腺癌患者,差异均有统计学意义(χ2=5.618、9.893、11.885,P<0.05)。组织学分级为3级、TNM分期为Ⅲ~Ⅳ期、有淋巴结转移的乳腺癌患者乳腺癌组织中PD-L1的阳性表达率均高于组织学分级为1~2级、TNM分期为Ⅰ~Ⅱ期、无淋巴结转移的乳腺癌患者,差异均有统计学意义(χ2=6.172、10.665、13.990,P<0.05)。(表1)

表1 不同临床特征乳腺癌患者乳腺癌组织中Ki-67、TopoⅡ α、PD-L 1的阳性表达情况( n=93)
2.3 乳腺癌组织中Ki-67、TopoⅡ α、PD-L 1表达情况与新辅助化疗疗效的关系
不同Ki-67、TopoⅡα、PD-L1表达情况乳腺癌患者的新辅助化疗疗效比较,差异均无统计学意义(P>0.05);Ki-67、TopoⅡα、PD-L1共表达的乳腺癌患者新辅助化疗有效的比例明显高于Ki-67、TopoⅡα、PD-L1非共表达的乳腺癌患者,差异有统计学意义(χ2=7.341,P<0.01)。(表2)
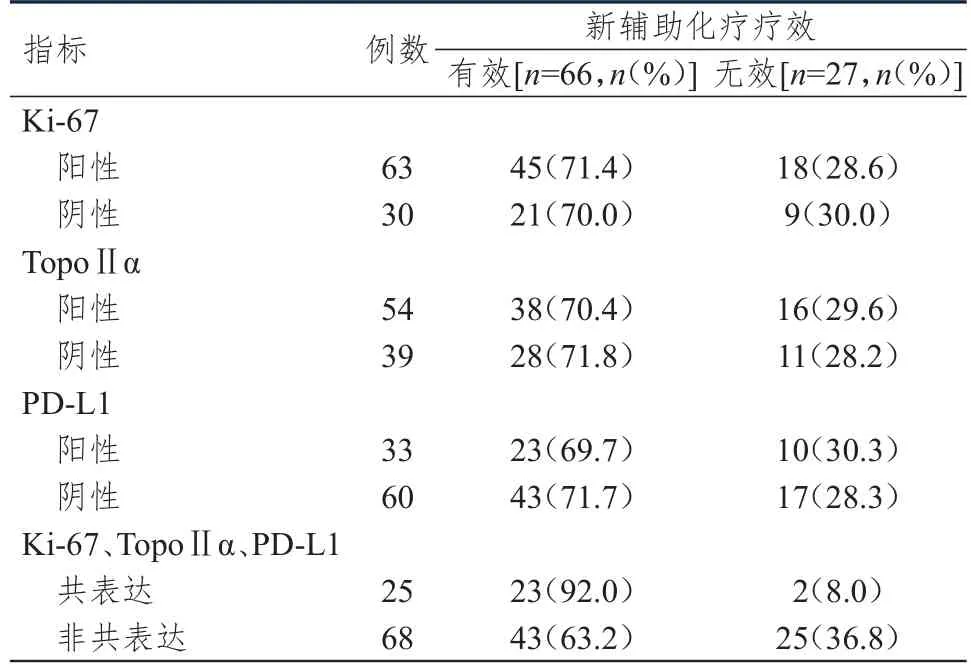
表2 不同Ki-67、TopoⅡ α、PD-L 1表达情况乳腺癌患者的新辅助化疗疗效( n=93)
3 讨论
乳腺癌是一种高度异质性的恶性肿瘤,已成为危害妇女健康的常见恶性肿瘤。据调查,中国每年新增乳腺癌患病病例约26.9万,乳腺癌死亡病例约7.1万[11-13]。HER2阳性乳腺癌约占全部乳腺癌的25%,该分型的乳腺癌分化程度低,增殖、扩散、转移能力高,多预后不良。新辅助化疗是HER2阳性乳腺癌综合性治疗中的重要手段之一,对患者病情具有一定的改善作用,但HER2阳性乳腺癌细胞对化疗的耐药性仍是临床亟待解决的难题。HER2阳性乳腺癌的发生、发展是一个多因素、多阶段、多基因的生物学过程,其分子生物学机制复杂,因此,寻找预测HER2阳性乳腺癌患者新辅助化疗疗效的生物学标志物对改善患者预后具有重要临床指导意义。
PD-L1又称B7同源体1(B7 homolog 1,B7-H1)或表面抗原分化簇274(cluster of differentiation 274,CD274),是免疫球蛋白超家族单体型Ⅰ型跨膜糖蛋白,大小为40 kD,由CD274基因编码,由胞内区、胞外区、跨膜区组成,广泛表达于单核细胞、自然杀伤细胞、B淋巴细胞、血管内皮细胞和巨噬细胞。PD-L1能够与细胞程序性死亡受体1(programmed cell death 1,PDCD1,也称PD-1)结合,传导抑制性信号,阻止淋巴结中抗原特异性T细胞聚积,抑制淋巴结CD8+T细胞增生[14-16]。有研究显示,PD-L1在恶性黑色素瘤、卵巢癌、非小细胞肺癌等恶性肿瘤中的表达上调,提示PD-L1与恶性肿瘤的发病及病情进展有密切联系[17]。本研究发现,PD-L1在HER2阳性乳腺癌中的阳性表达率高,且与HER2阳性乳腺癌患者的淋巴结转移、组织学分级、TNM分期情况有关,提示PD-L1与HER2阳性乳腺癌的发生、发展有关。TopoⅡα是一种蛋白酶,存在于原核生物和真核生物中,能够调节DNA空间构象,参与DNA的复制、转录、修复、重组、代谢,是蒽环类化疗药物作用靶点之一。本研究发现,TopoⅡα在HER2阳性乳腺癌中的阳性表达率高,这与Shuai[18]的研究结果一致,结果显示,其表达情况与HER2阳性乳腺癌患者的淋巴结转移、组织学分级、TNM分期情况有关,提示TopoⅡα与HER2阳性乳腺癌的发生、发展有关。核抗原Ki-67与细胞有丝分裂密切相关,在有丝分裂中可维持DNA规则结构,还与核糖体RNA转录有关,能反映细胞的增殖状态。Ki-67表达上调高则提示细胞增殖活跃。本研究显示Ki-67在HER2阳性乳腺癌中呈高表达,这与相关研究的结果[19]一致,其表达水平与HER2阳性乳腺癌患者淋巴结转移、组织学分级、TNM分期情况有关,提示Ki-67与HER2阳性乳腺癌发生、发展相关。本研究显示Ki-67、TopoⅡα、PD-L1共表达的乳腺癌患者新辅助化疗疗效有效比例明显高于Ki-67、TopoⅡα、PD-L1非共表达的乳腺癌患者,提示Ki-67、TopoⅡα、PD-L1联合检测有助于预测HER2阳性乳腺癌患者新辅助化疗疗效,从而指导HER2阳性乳腺癌患者个体化治疗。
综上所述,Ki-67、TopoⅡα、PD-L1在HER2阳性乳腺癌中的阳性表达率高,其表达情况与HER2阳性乳腺癌患者的淋巴结转移情况、组织学分级、TNM分期及新辅助化疗疗效有关。但本研究纳入的病例数量较少,研究时间较短,且其机制尚不清楚,故有待进一步研究。
