典型钙/镁基吸附剂对二氧化硒吸附特性研究
2020-12-30于梦竹黄亚继朱志成樊聪慧程好强
于梦竹, 王 海, 黄亚继, 朱志成, 樊聪慧, 董 璐, 程好强
(1.东南大学 能源热转换及其过程测控教育部重点实验室, 江苏 南京 210096;2.国电电力股份有限公司浙江分公司, 浙江 宁波 315043)
煤中痕量重金属元素随燃煤过程释放进入大气中对生态环境影响巨大[1-5]。尽管痕量元素硒(Se)是人体所需营养元素,但过量的摄入会影响人体健康甚至引起硒中毒[6,7]。燃煤电厂是Se的主要排放源之一[8],煤中痕量元素Se在燃煤过程中主要以二氧化硒(SeO2)形式[9,10]随烟气进入大气中,美国环保署(EPA)已于2011年提出对燃煤电厂的Se排放进行监管[11]。在中国,不同煤种中Se的含量约为0.12-56.7 μg/g,明显高于其他国家煤种中的含量(0.2-10 μg/g)[12]。随着中国燃煤电厂大气污染物排放标准越来越严格,针对Se等痕量重金属元素排放的监管将会得到更多关注。前人对燃煤过程中Se的释放进行研究[13-19],在300-800 ℃随温度升高煤中Se的释放速率迅速增加[12],815 ℃下挥发率超过97%[9],同时随着烟气温度逐渐降低,气态SeO2将凝结并附着在飞灰表面,进而与飞灰中Ca、Fe等组分结合[20-22]。由于Se与同族元素S表现出相似的化学性质,针对烟气中SeO2的捕集常与烟气脱硫相结合,前人的研究表明[21,23-26],脱硫剂对烟气中SeO2具有一定的吸附作用。以石灰石-石膏法为代表的钙基脱硫技术是最常用的脱硫方式之一[14,27],因此,钙基吸附剂也成为SeO2吸附的研究焦点。李玉忠等[28]研究表明,CaO在300-700 ℃下可以有效捕集SeO2。Ghoshdastidar等[29]使用石灰石对SeO2的吸附进行研究,结果表明,CaO对SeO2的吸附产物主要为亚硒酸钙(CaSeO3);高温不利于吸附反应的进行,因此,吸附剂不建议采用炉内喷射。Agnihotri等[30]研究了Ca(OH)2、高岭土、Al2O3、CaCO3对SeO2的吸附特性。结果表明,Ca(OH)2的吸附效果较为优异,且Ca(OH)2对SeO2的吸附实质是Ca(OH)2分解后产生的CaO对SeO2的吸附。Lou等[31]利用CaO在中温段对SeO2吸附进行研究。结果表明,在240-800 ℃氮气气氛下,SeO2在CaO表面的吸附与温度的升高呈正相关;H2O的参与对CaO表面氧空位的影响是促进SeO2在CaO表面吸附的主要原因。Xu等[32]研究表明CaO-ZnO复合材料对Se的吸附效果优于传统CaO吸附剂。
前人对以CaO组分为主的钙基脱硫剂对Se的捕集进行了深入研究,但除钙基脱硫技术外,以氧化镁(MgO)组分为基础的脱硫技术近年来也得到广泛应用[27],而针对镁基吸附剂对Se的捕集效果研究报道较少。且前人的研究通常将SeO2与吸附剂放置于反应器中从室温较为缓慢加热至指定吸附温度,与处于实际燃烧炉膛内部时的升温速率有较大区别。此外,近年来天然矿物因其来源广、价格低等优势在重金属吸附中得到广泛关注[33-36],但其对Se的吸附研究报道相对较少。为实现SeO2与吸附剂的迅速升温,本研究使用U型管形反应器进行吸附反应,对矿物吸附剂的主要组分CaO、CaCO3与MgO及天然矿物方解石、白云石对Se的吸附进行探索,并对矿物煅烧得到的CaO吸附效果进行研究。
1 实验部分
1.1 实验样品
实验所用氧化钙(CaO)、碳酸钙(CaCO3)与氧化镁(MgO)购于上海阿拉丁生化科技股份有限公司,均为分析纯;天然方解石与白云石分别产自广西、安徽。CaCO3与方解石置于马弗炉中经800 ℃煅烧3 h获得的吸附剂依次记为C-sor与F-sor。使用比表面积测定仪(BET,麦奇克拜尔BELSORP-max)对样品的比表面积与孔径进行分析,结果如表1所示。

表1 样品的比表面积、孔容与孔径
1.2 热分析实验
SeO2熔点约为340-350 ℃,并于315 ℃时发生升华,使用同步热分析仪(TG-DSC,耐驰STA 449F3)对SeO2与不同样品进行热分析。取20 mg样品在N2气氛下以加热速率10 ℃/min升至指定温度,结果见图1。由图1可知,SeO2于200 ℃开始失重,约350 ℃全部分解。CaCO3的失重主要是由于受热分解引起的,约从610 ℃开始到820 ℃结束。方解石与白云石的失重规律与CaCO3相似,迅速分解主要发生在700-900 ℃,但在大量分解前存在缓慢的微量失重过程。

图1 样品TG-DSC曲线
1.3 吸附实验
使用两段式管式炉对SeO2的吸附特性进行研究,实验装置示意图见图2。取(200±0.2)mg筛分至40-60目的吸附剂置于吸附反应区的石英砂芯上,吸附反应温度500-800 ℃。取(200±0.2)mg固态SeO2放置坩埚中置于挥发区,SeO2挥发温度设置为500 ℃。吸附实验前样品置于105 ℃干燥12 h。当挥发温度与吸附温度均升至指定温度后,盛载SeO2与吸附剂的石英管进入炉膛中,固态SeO2与吸附剂被迅速加热。使用40 mL/min N2作为载气将SeO2蒸气引入吸附反应区,SeO2全部穿过吸附剂层,与吸附剂充分混合。吸附反应时间20 min。
实验前对该实验装置进行气密性检查与质量平衡测试,结果表明,Se回收率可达98%以上。实验完成后将吸附产物取出冷却至室温收集消解,利用电感耦合等离子体发射光谱仪(ICP-OES,安捷伦5100)对硒含量进行测定。不同吸附剂对硒捕集能力Cs(mg/g)的评价如方程(1)所示:
(1)
式中,mSe(mg)与ms(g)分别代表吸附产物中含硒量与实验所用吸附剂质量。
1.4 样品分析
吸附产物的成分通过X射线衍射仪(XRD,布鲁克D8 advance)分析,扫描角度为10°-90°,Cu-Kα靶,40 kV-40 mA,扫描速率8(°)/min。样品的微观形貌通过扫描电子显微镜(SEM, 蔡司Merlin Compact)分析。通过X射线光电子能谱仪(XPS,赛默飞Escalab 250Xi+)测定吸附产物表面的化学价态。
2 结果与讨论
2.1 不同矿物组分对SeO2吸附特性研究

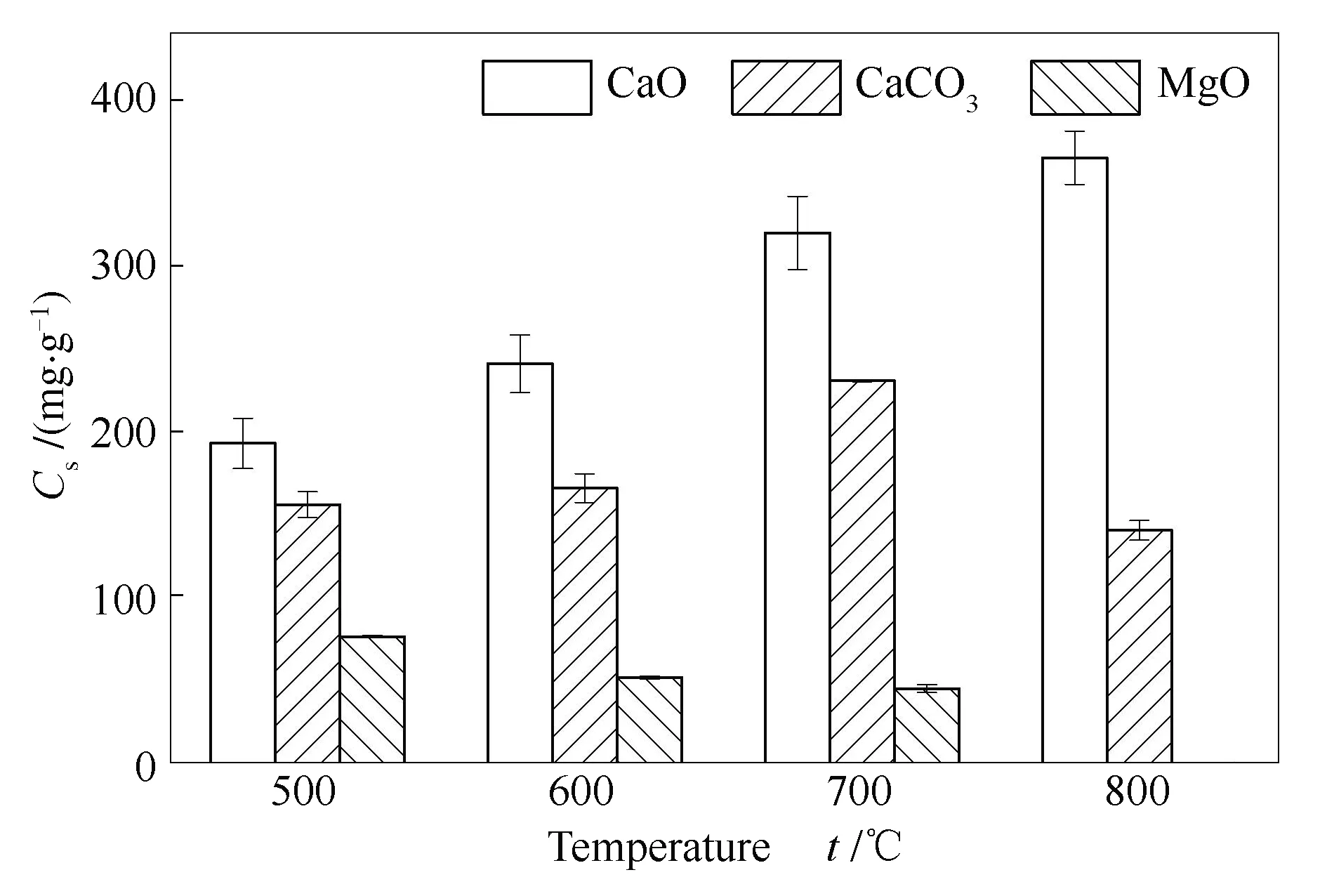
图3 不同吸附剂对Se的吸附量

图4 CaO吸附产物的XRD谱图
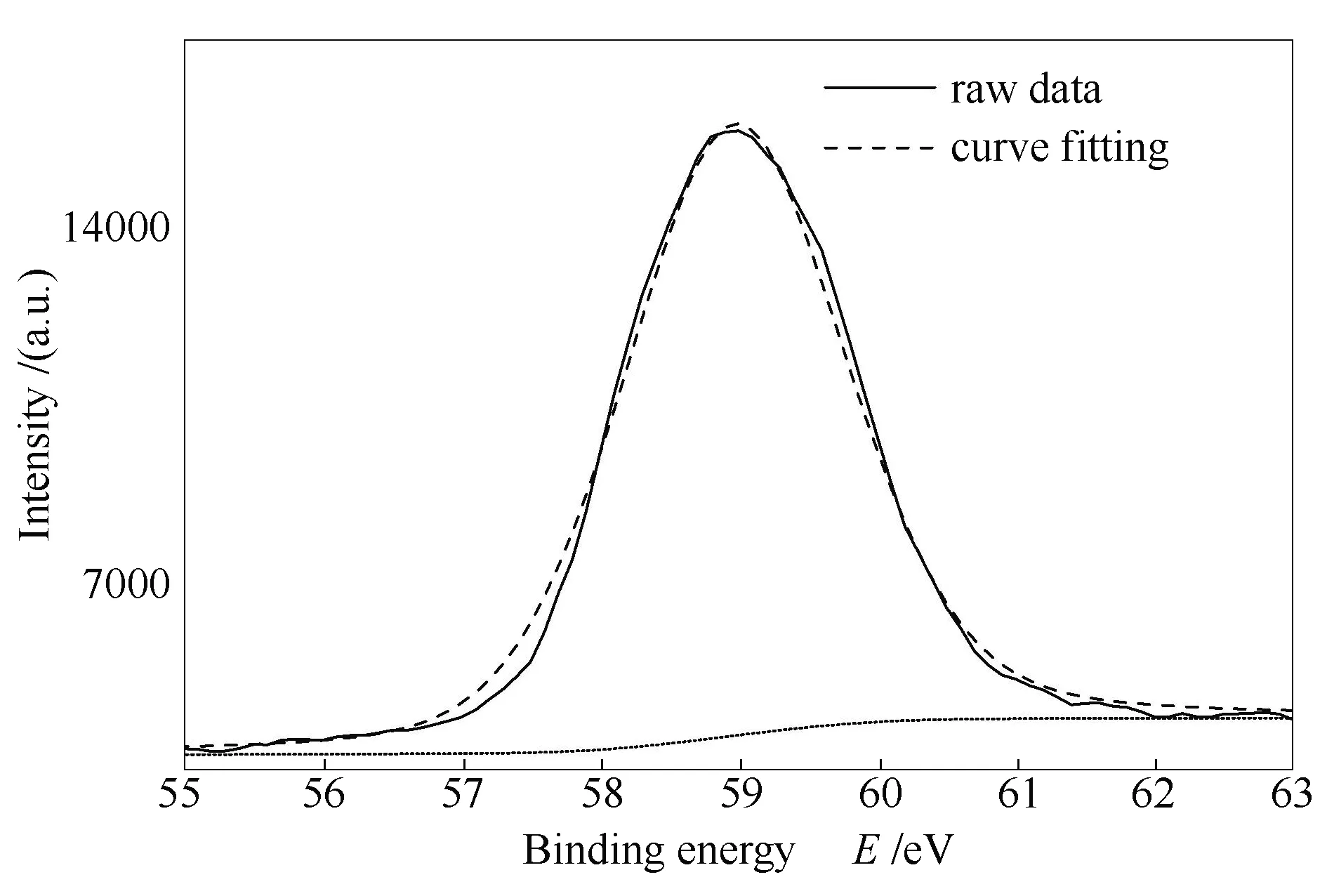
图5 CaO吸附产物的XPS谱图
CaO + SeO2→CaSeO3
(2)
CaO及700 ℃下CaO吸附产物形貌分析见图6,CaO以层片状结构为主,吸附SeO2后CaO表面变粗糙,出现熔融状。这与前人的研究成果基本一致[11],吸附SeO2而发生熔融粗糙的表面有利于多层SeO2的吸附,从而促进CaO对Se的吸附效果。对吸附产物进行热稳定性分析,如图7所示。由图7可知,吸附产物随温度升高缓慢失重,在810 ℃时发生迅速失重。缓慢失重可能是由于SeO2的多层吸附引起的[11],多层吸附的SeO2还未从物理吸附转变为化学吸附,因此,吸附产物在随温度升高的过程中逐渐脱离,缓慢失重,当温度超过800 ℃时,化学吸附产物CaSeO3发生分解,样品迅速大量失重[24,29]。

图6 CaO吸附产物的SEM照片
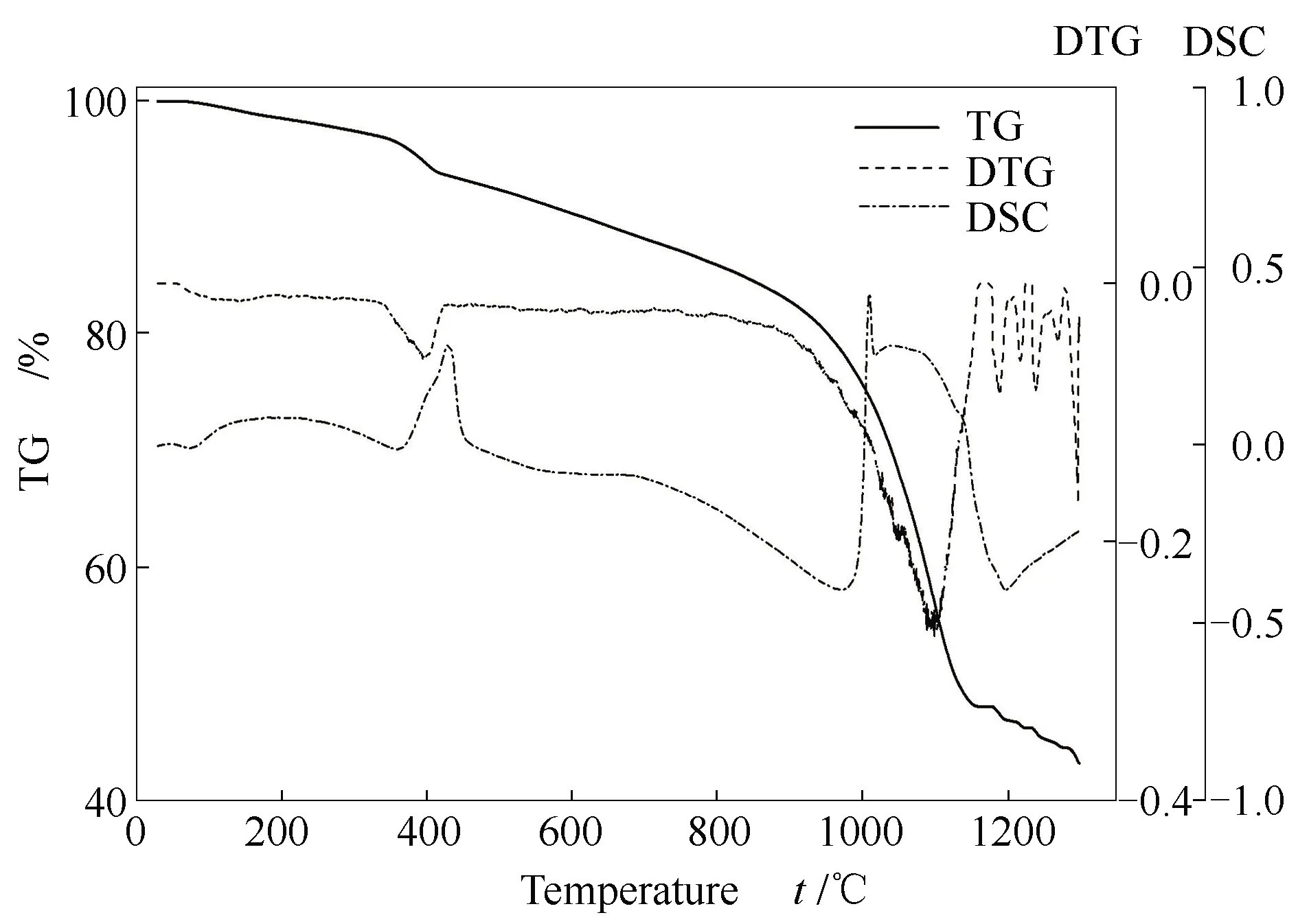
图7 吸附产物的TG-DSC曲线
单位质量CaCO3对Se的吸附量低于单位质量CaO,这是由于CaCO3中对Se起吸附作用的有效成分仍为CaO[14]。CaCO3对Se的吸附量随温度升高先增高后降低,700 ℃时对Se的吸附量最高可达233 mg/g,这可能与CaCO3受热分解过程有关。在较低吸附温度下,CaCO3未发生分解,此时除物理吸附外,SeO2可能通过与CaCO3发生反应置换出CO2的方式,吸附在CaCO3表面[28]。根据图1中TG曲线所示约620 ℃时CaCO3开始分解,因此,当吸附温度升高至700 ℃,CaCO3发生分解对Se的吸附效果增强。CaCO3及其吸附产物XRD谱图见图8。
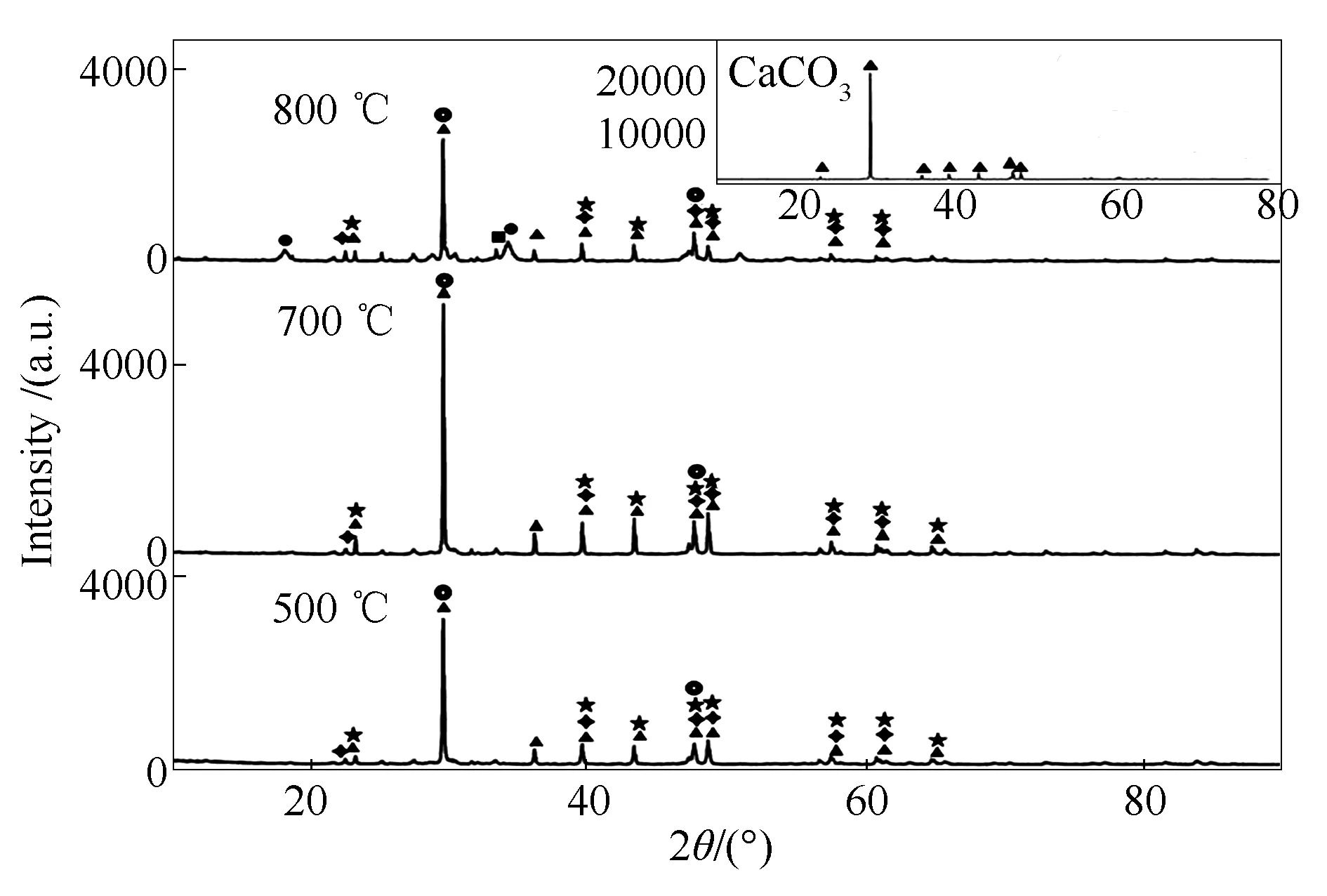
图8 CaCO3吸附产物的XRD谱图
由图8可知,吸附产物在800 ℃时出现微弱的CaO衍射峰与CaSeO3衍射峰。与CaO相比,20°-30°衍射峰相对较弱。对700 ℃下吸附产物进行XPS分析,结果见图9,可知吸附产物仍主要以CaSeO3为主。
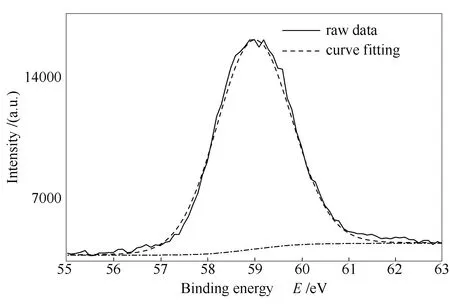
图9 CaCO3吸附产物的XPS谱图
图10为CaCO3及其吸附产物SEM照片。由图10可知,CaCO3表面以块状结构为主,700 ℃下吸附产物表面的块状结构显著减少,表面熔融状增多。此时CaCO3结构发生塌陷且表面的孔隙明显减少,呈现与CaO相似的表面形貌,这与图1(b)中CaCO3的TG-DSC失重规律一致。600 ℃后CaCO3会发生迅速分解,此时CaCO3随CO2脱离产生吸附组分CaO,由于CO2的作用产生较多孔隙可使SeO2与CaO相结合。然而,随吸附温度继续升高,吸附效果降低,这可能是由于温度过高导致CaCO3表面迅速塌陷发生烧结[14],阻碍了内部还未参与反应的CaCO3向外扩散,导致CaCO3对Se的吸附效果降低。

图10 CaCO3吸附产物的SEM照片
CaCO3吸附产物的热稳定性见图11。由图11可知失重过程主要分为三个阶段。700 ℃前存在缓慢的轻微失重,700 ℃后开始大量分解至850 ℃左右结束,这可能是由于吸附产物中存在未完全分解的CaCO3引起的,这与XRD测试结果一致,在700 ℃下吸附产物存在明显的CaCO3衍射峰。第三段失重从约850 ℃开始,发生大量失重,这主要是CaSeO3分解引起的,相比于CaO吸附产物,CaCO3吸附产物分解温度略有后移,这表明CaCO3吸附产物热稳定性相对较好。
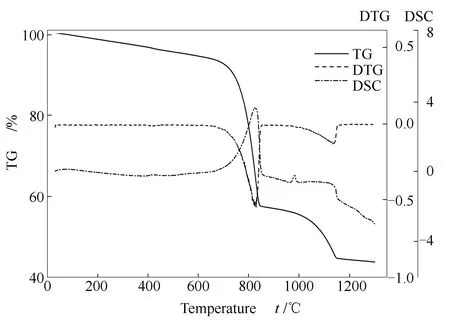
图11 吸附产物的TG-DSC曲线

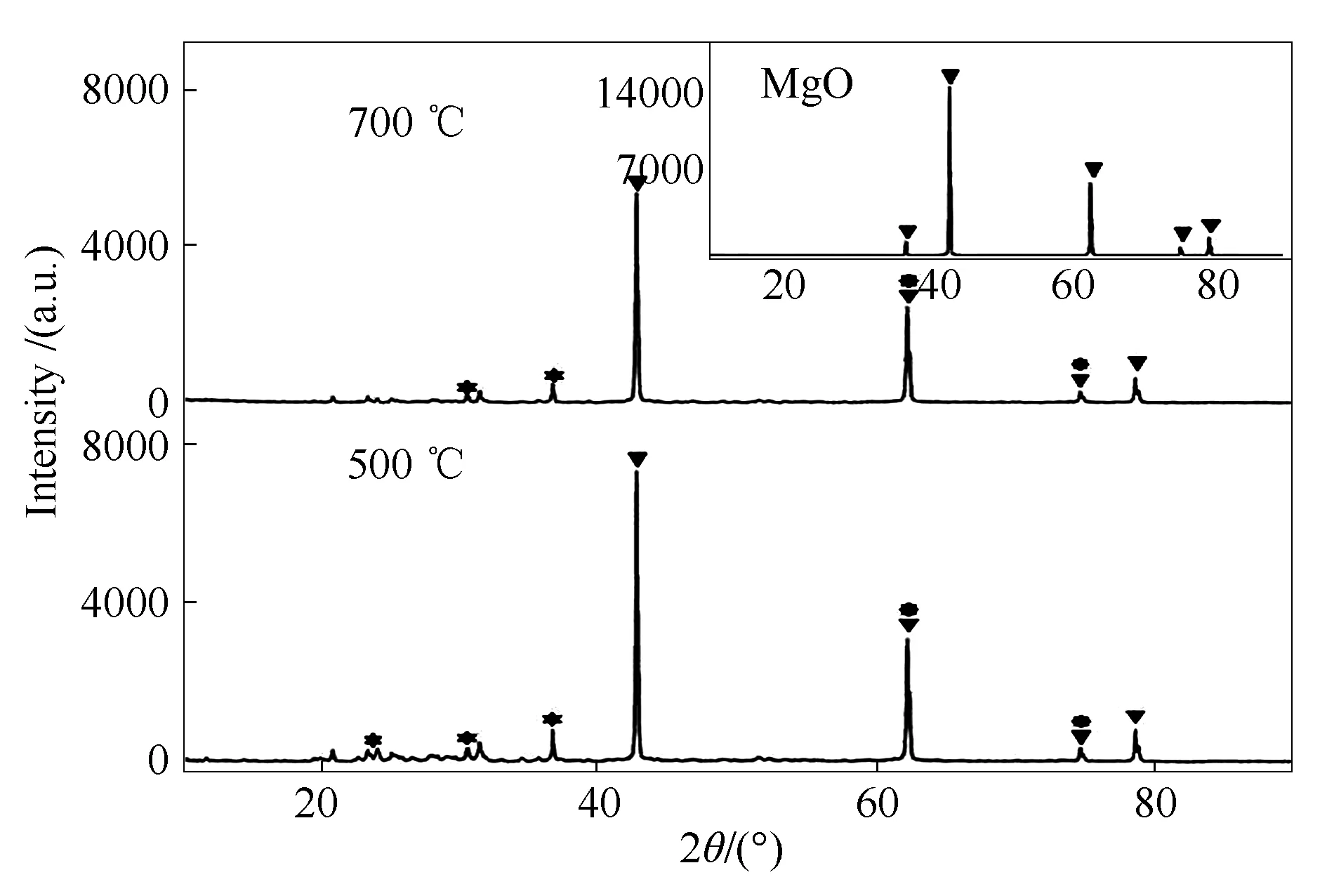
图12 MgO吸附产物的XRD谱图
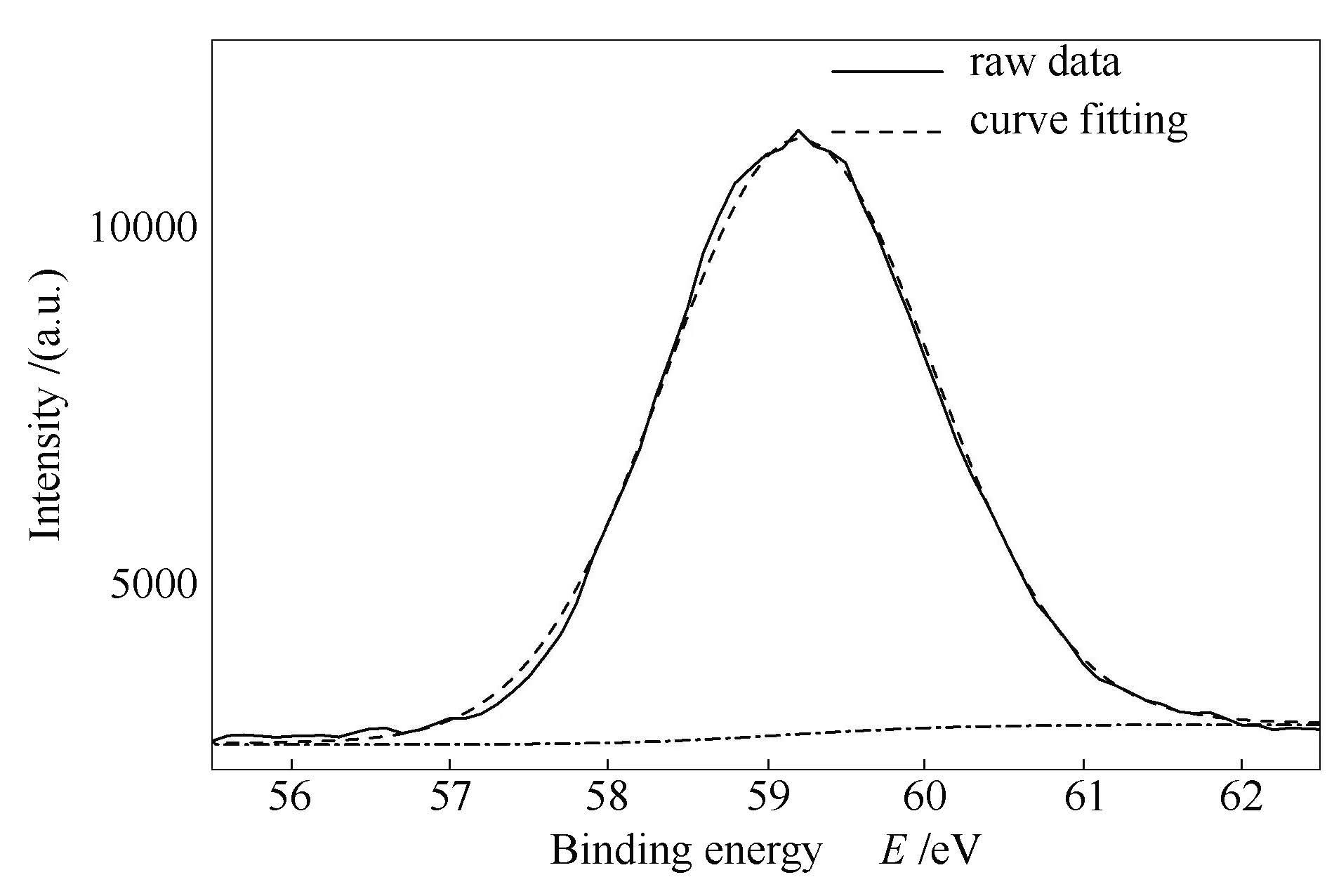
图13 MgO吸附产物的XPS谱图
MgO + SeO2→MgSeO3
(3)
MgO在700 ℃的吸附产物热稳定性分析见图14。由图14可知,MgO对Se吸附产物受热持续失重,在580 ℃时迅速失重,770 ℃时吸附产物大部分发生分解。因此,MgO对Se的吸附效果在500 ℃时最佳,当温度持续升高,MgO的吸附能力迅速减弱。这表明MgO与SeO2的吸附可能以物理吸附为主,且与CaO相比,MgO上的氧活性位点对Se的吸附作用较弱。此外,还可能与MgSeO3热稳定性相对较差有关。

图14 MgO吸附产物的TG-DSC曲线
2.2 天然矿物对SeO2吸附特性研究
单位质量天然矿物在不同实验温度下对Se的捕集能力见图15。由图15可知,碳酸盐矿物方解石对Se的吸附效果随温度变化规律与CaCO3类似,但吸附能力优于CaCO3,这可能与样品的比表面积等物理性质有关。在吸附过程中SeO2先物理吸附到吸附剂表面再转化为化学吸附[11],因此,吸附剂的物理性质对Se的吸附至关重要。从表1中可以看出,方解石与CaCO3的平均孔径相近,但方解石的比表面积与孔容明显高于CaCO3,由于吸附剂表面对SeO2的吸附作用在吸附过程中起主导作用,因此,方解石的吸附效果略优于CaCO3,且最大吸附量277.2 mg/g同样出现在700 ℃。
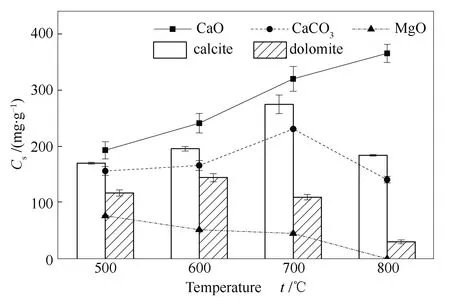
图15 不同矿物对Se的吸附量
此外,与CaCO3表面不均匀的块状结构相比,方解石的表面形貌结构呈相对均匀的棒状结构。方解石在700 ℃下吸附产物表面棒状结构同样发现明显的熔融态,但结构塌陷的程度明显低于CaCO3,因此,CaCO3受高温的影响更显著,CaCO3在800 ℃时的吸附效果降低较多。图17为方解石及其吸附产物的XRD谱图。从图17中可以看出,与CaCO3吸附产物谱图不同,方解石的吸附产物在20°-30°出现大量的衍射峰,与CaO的吸附产物XRD谱图相似。

图16 方解石吸附产物的SEM照片

图17 方解石吸附产物的XRD谱图
与方解石晶体结构相似的白云石(CaMg(CO3)2)是一种化学成分为钙、镁的碳酸盐矿物,根据ICP-OES结果,白云石中钙镁物质的量比约为6∶5。与方解石相似,白云石的吸附过程同样受碳酸盐的分解影响。由于白云石含有大量碳酸镁,如图14所示,MgO对Se吸附后的产物在600 ℃前即发生分解,因此,白云石对Se吸附在中温段效果相对较好,最大吸附量145.9 mg/g出现在600 ℃。且白云石对Se的吸附效果优于MgO但低于CaO与CaCO3,其吸附量最大值介于MgO与CaO、CaCO3之间。
图18 白云石吸附产物的XRD谱图
2.3 煅烧方解石对SeO2吸附特性研究
CaCO3与方解石煅烧得到的CaO与CaO相比在物理性质上表现出较大差异,这可能对Se的吸附具有很大影响。高温煅烧的碳酸钙与方解石对Se的吸附效果如图19所示,F-sor与C-sor的吸附效果随温度变化趋势与CaO相似,整体吸附量略优于CaO,其中,F-sor吸附效果较好,最高可达403 mg/g。由表1可以推测,吸附效果的提升可能与F-sor和C-sor具有较大比表面积、孔容与平均孔径有关。图20为CaO、C-sor与F-sor及其产物的XRD谱图,与CaO对Se吸附产物相似,C-sor与F-sor对Se吸附产物在20°-30°也出现较多的衍射峰,且峰强度略高于CaO对Se吸附产物的衍射峰强度。图21与图22分别为C-sor与F-sor及其产物SEM照片。由图21(a)、(b)与图22(a)、(b)中可以看出,F-sor表面呈均匀的球状颗粒态分布,C-sor表面也具有球状结构,但相比F-sor,分布并不均匀,还存在大面积的熔融态,这表明CaCO3的结构塌陷较为严重。相比于CaO的层片状结构,F-sor与C-sor表面相对粗糙,且煅烧过程中随CO2的脱除,有助于吸附剂孔隙结构的增加。增大的孔径有利于SeO2分子向吸附剂内部扩散,因此,有利于吸附能力的增加。
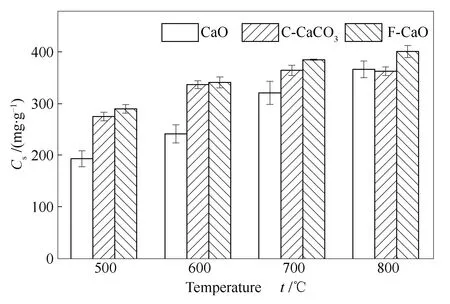
图19 C-sor与F-sor对Se的吸附量

图20 C-sor与F-sor吸附产物的XRD谱图
从图21(c)、(d)与图22(c)、(d)中还可以看出,吸附后的C-sor表面熔融状增多,表面结构塌陷程度较高。但与C-sor相比,F-sor吸附后产物尽管发生了一定的熔融,致使表面结构由较为立体的球状转变为饼状,出现一定程度的塌陷,但F-sor吸附产物的塌陷程度相对较弱。C-sor与CaO相似,表面吸附Se后都出现了较大面积的黏连,但F-sor吸附Se后依然保持均匀的表面结构,这可能是因为F-sor具有较好的抗烧结能力,而抗烧结能力有助于保持吸附剂的多孔结构,便于SeO2向内部扩散,有利于内部的CaO与SeO2发生反应,提高吸附能力。而CaO与C-sor受热表面结构塌陷,导致内部还未参与反应的CaO无法向外扩散,影响吸附效果。
图23和图24分别为C-sor与F-sor吸附产物热稳定性分析。根据图7可以看出,CaO吸附产物于810 ℃发生大量分解,由图23、图24中DTG曲线可以看出,C-sor吸附产物的迅速分解出现在约920 ℃,F-sor吸附产物的迅速分解则出现在990 ℃,这表明C-sor与F-sor吸附产物的热稳定性优于CaO吸附产物,且F-sor吸附产物的热稳定性最好,这也与吸附实验结果相对应。因此,除优异的表面形貌与孔隙结构外,吸附产物具有较好的热稳定性也是F-sor吸附效果较好的原因之一。
图23 C-sor吸附产物的TG-DSC曲线
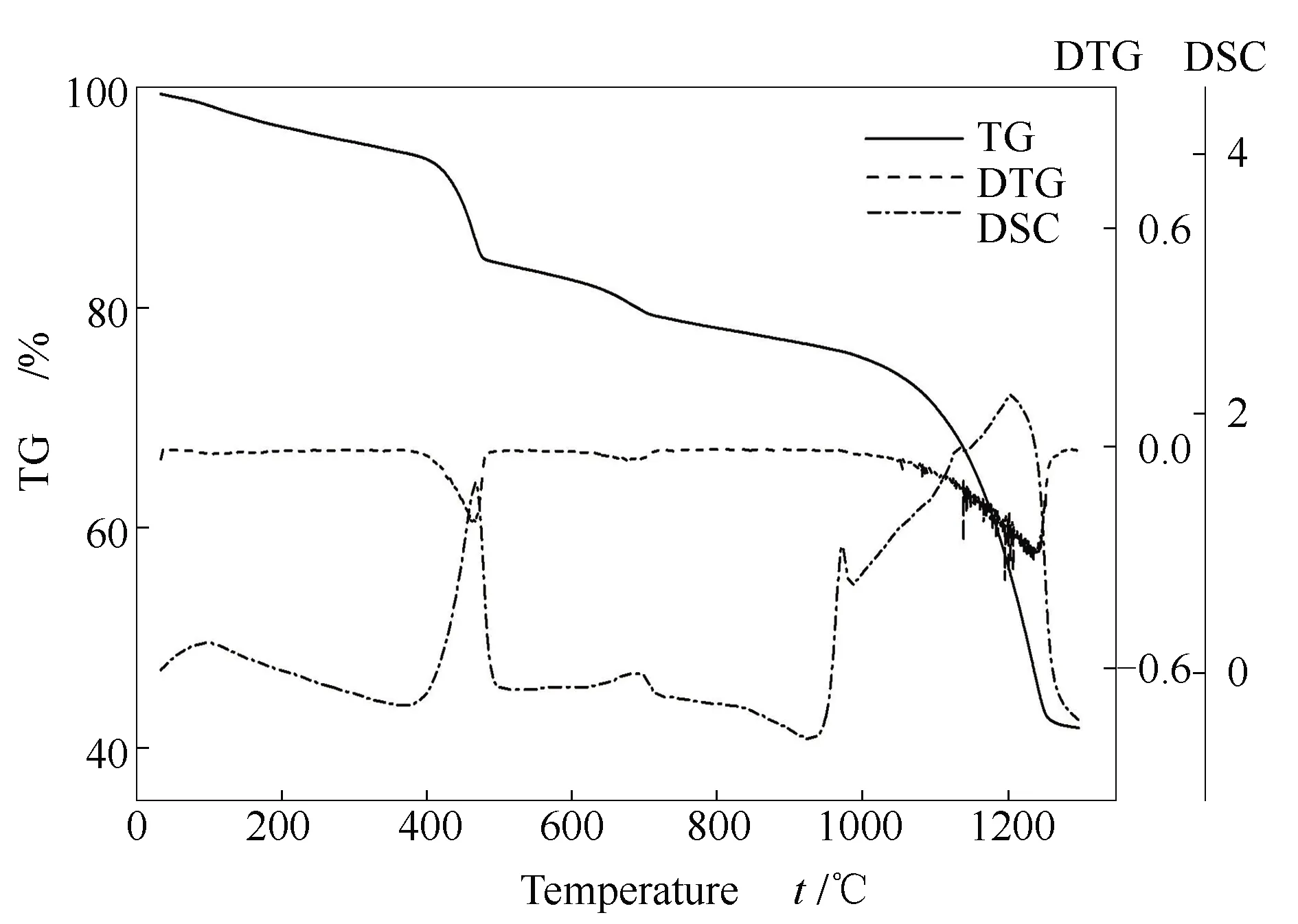
图24 F-sor吸附产物的TG-DSC曲线
3 结 论
本研究对钙/镁基矿物吸附剂的主要组分CaO、CaCO3与MgO对Se的吸附过程分别进行研究,并选取天然矿物方解石、白云石,研究其对Se的吸附效果,且对方解石煅烧得到的CaO吸附效果进行讨论。钙/镁基吸附剂对Se的吸附主要与其氧化物和SeO2的反应有关,吸附产物主要为亚硒酸盐。尽管镁基吸附剂在中温段对Se具有一定的吸附效果,但总体而言钙基吸附剂对Se的捕集更为优异。三种组分中单位质量CaO的吸附效果最好,800 ℃时单位质量CaO对Se的吸附量可达368 mg/g。CaCO3对Se的吸附在其开始受热分解为CaO时对Se的吸附效果最佳。此外,CaCO3吸附产物的热稳定性与CaO、MgO吸附产物相比相对较好,MgO吸附产物热稳定性相对较差。方解石随温度变化对Se的吸附效果变化趋势与CaCO3的吸附过程相似,但因其较好的比表面积和孔隙,单位质量方解石对Se的吸附效果优于CaCO3。方解石煅烧得到的F-sor对Se的吸附效果优于CaCO3煅烧得到的C-sor与CaO,最高可达403 mg/g,这是因为F-sor具有良好的比表面积、孔隙结构与抗烧结能力,且其吸附产物的热稳定性较好。
猜你喜欢
杂志排行
燃料化学学报的其它文章
- Study on the environmental effects of heavy metals in coal gangue and coal combustion by ReCiPe2016 for life cycle impact assessment
- 复合聚并协同脱除燃煤颗粒物及颗粒态重金属的中试研究
- In-situ reaction between arsenic/selenium and minerals in fly ash at high temperature during blended coal combustion
- Speciation analysis of arsenic in coal and its combustion by-products in coal-fired power plants
- 燃煤烟气中As、Se、Pb的形态分布及S、Cl元素对其形态分布的影响
- 燃煤电厂砷、硒、铅的排放与控制技术研究进展
