F-在方解石表面的吸附及其对方解石表面性质的影响
2022-09-08殷玉兰陈俊宏敖先权
殷玉兰,陈俊宏,谢 燕,敖先权
(贵州大学化学与化工学院,贵阳 550025)
0 引 言
氟在地壳中的质量含量为0.072%,自然界中的氟主要以萤石(CaF2)、冰晶石(Na3AlF6)及氟磷灰石(Ca10(PO4)6F2)形式存在[1-2]。这些矿物通常与脉石矿物方解石、白云石、石英等密切伴生或共生,导致矿物分离困难[3-4]。浮选法是矿物富集分离的常用方法,浮选法一般用油酸或脂肪酸类捕收剂改变矿物表面性质来富集分离目标矿物与脉石矿物[5-6]。由于矿物中目标矿物与脉石矿物的表面性质相似,溶解性比较强,在浮选过程中矿物表面的元素部分溶解,溶解出的离子在矿物表面发生吸附、沉淀、迁移转化络合,部分离子在矿物表面形成新的活性位点提高捕收剂与矿物的吸附,或者抑制捕收剂与矿物的吸附,从而改变矿物表面性质[7-9]。周坤等[10]研究了无机阴离子对石英浮选的影响,结果表明,在以HAY为捕收剂时,添加的F-、PO3-4、SiO2-3会使矿物的Zeta电位负移,对矿物的浮选分离有一定的抑制作用。Hirajima等[11]研究了Mg2+和Ca2+对辉钼矿和黄铜矿可浮性的影响,研究表明,当pH值高于9时,Mg2+、Ca2+分别会以Mg(OH)2、CaCO3形式沉淀在矿物表面,降低矿物表面的疏水性,此外Mg2+和Ca2+会改变黄铜矿和辉钼矿的表面Zeta电位。
这些研究表明,溶出的金属离子或非金属离子会发生水解、络合、吸附等反应改变矿浆环境,同时也会引起矿物表面性质的改变。由于氟大量存在于磷矿和萤石中,在矿浆中会溶出少量氟,加上浮选工艺中选矿回水的使用会增大矿浆中的氟浓度[12-14],而这些矿物一般都伴生有方解石脉石矿物,目前关于F-在方解石表面的吸附以及对方解石表面性质的影响研究文献报道较少。本文研究了F-在方解石表面的吸附及其对方解石表面性质的影响和机理。
1 实 验
1.1 材 料
由于矿石中伴生的方解石难以用物理方法挑选出纯样品,为了排除其他杂质对试验的干扰,采用天然的、纯度较高的方解石样品(取自河北省灵寿县)用于试验,方解石通过人工挑选,超声清洗,干燥,破碎过筛,得到74 μm的样品。使用美国赛默飞世尔科技公司的ARL PERFORMX型X射线荧光光谱分析仪(XRF)对方解石的化学组成进行分析检测;使用荷兰帕纳科公司的X-Pert PRO型X射线衍射仪分析仪(XRD)对方解石的物相组成进行分析检测,结果分别见表1和图1。

表1 方解石化学元素分析结果Table 1 Chemical element analysis results of calcite

图1 方解石的XRD谱Fig.1 XRD pattern of calcite
由表1可知,矿样所含主要元素为Ca、P、Si、Mg等,方解石样品中不含F元素,方解石纯度较高,符合单矿样品要求。由图1可知,方解石样品的特征吸收峰尖锐,无其他杂峰,说明方解石纯度较高,矿物的结晶度较好。试验所用的试剂主要有:盐酸(HCl),重庆川东化工集团有限公司,分析纯;氢氧化钠(NaOH),中化蒙联化工有限公司,分析纯;油酸钠(C17H33COONa,NaOL),上海麦克林生化科技有限公司,纯度96%;氟化钠(NaF),成都金山化学试剂有限公司,分析纯。
1.2 方 法
1.2.1 F-吸附量测定
向烧杯中加入2.0 g方解石,加入含10 mg/L的F-溶液。将pH值调整为5.5,磁力搅拌一段时间,将矿浆离心并过滤,采用氟离子选择电极法测定滤液中F-含量。使用上海仪电科学仪器股份有限公司的PF-2-01型氟离子电极和232-01型参比电极为饱和甘汞电极进行测定。根据公式(1)计算吸附量。
Qe=(C0-Ce)Vm
(1)
式中:Qe是吸附量,mg/g;C0是离子的初始浓度,mg/L;Ce是离子的平衡浓度,mg/L;m是方解石样品的质量,g;V是溶液的体积,L。
1.2.2 接触角测量
接触角采用东莞市晟鼎精密仪器有限公司的SDC-100型接触角测量仪测量。称取2.0 g纯矿物置于烧杯中,加20 mL去离子水,添加一定量的NaOL和氟化钠(NaF),调节pH值,磁力搅拌10 min,然后过滤矿浆,并将滤饼在60 ℃下烘6 h。使用上海山岳科学仪器有限公司的DY-20型粉末压片机,在15 MPa下将所制备的样品压成薄片。用液滴法测量接触角,每个样品测量三次,取平均值。
1.2.3 Zeta电位测量
在每次测量中,称取40 mg方解石样品,加入40 mL去离子水,添加一定量的NaOL和NaF溶液,使用盐酸(HCl)、氢氧化钠(NaOH)调节pH值,然后对悬浮液进行超声180 s,以确保颗粒分散。Zeta电位使用美国贝克曼库尔特有限公司的DelsaNanoC型电位及纳米粒级分析仪进行测定。每个样品测量三次,取平均值。
1.2.4 XPS分析
采用X射线光电子能谱(XPS)仪分析技术对不同条件下方解石表面元素组成和化学状态分析。本试验使用美国赛默飞世尔科技公司的Thermo ESCALAB 250XI 型X射线光电子能谱仪,以Al-Kα(1 486.6 eV)为放射源,功率为120 W,在约5.0×107Pa的高真空度的分析室内进行XPS测试分析。数据采用Thermo Scientific Avantage软件处理,并使用C 1s结合能为284.8 eV作为标准来校正。
2 结果与讨论
2.1 方解石对F-的吸附
图2研究了矿浆在pH值5.5、温度25 ℃、固液比1 ∶10、F-浓度10 mg/L、HCl作为pH调节剂时,不同时间下方解石对F-吸附量的影响。当制浆时间从5 min增加至60 min时,方解石对F-的吸附量逐渐增大。在90 min时,吸附量达到0.033 59 mg/g,此时方解石对F-的吸附达到平衡。当时间超过90 min后,矿物中方解石对F-的吸附量不再改变,趋于平衡。方解石中的Ca2+容易与溶液中的F-反应生成CaF2覆盖在方解石表面[15-16]。
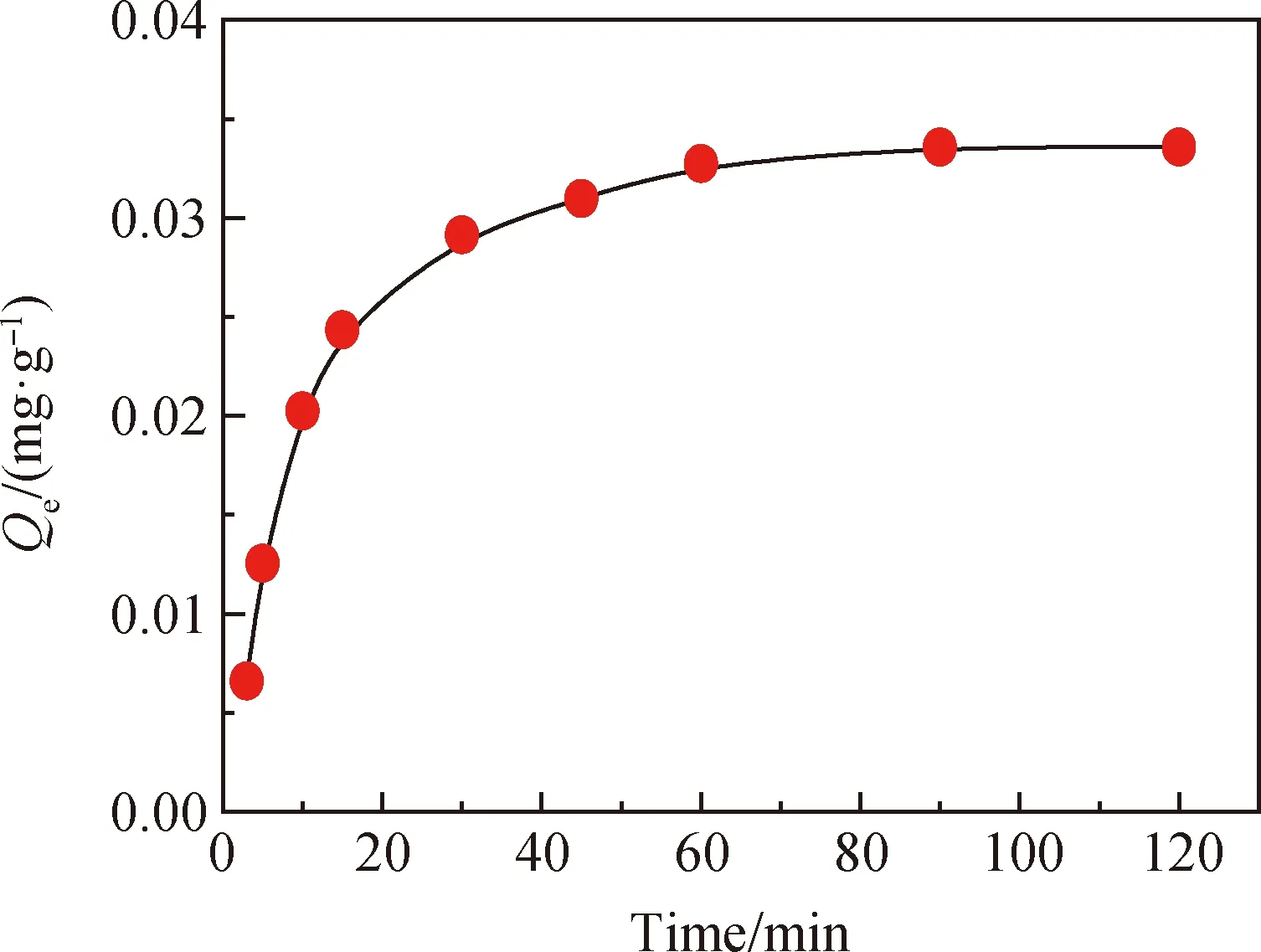
图2 方解石表面吸附量与时间的关系(pH=5.5,c(F-)=10 mg/L)Fig.2 Relationship between calcite surface adsorption amountand time (pH=5.5, c(F-)=10 mg/L)
2.2 F-对方解石表面接触角的影响
接触角是测量矿物表面润湿性的重要参数,矿物的浮选分离与润湿性密切相关[17]。以HCl为矿浆pH调节剂下,方解石表面接触角变化如图3所示。方解石表面接触角为20.45°,表明方解石是亲水性矿物;方解石吸附F-后,接触角为19.82°。在矿物浮选中,通常使用捕收剂增大脉石矿物与目标矿物的润湿性来分离矿物。在方解石矿浆中添加150 mg/L的NaOL时,方解石接触角发生显著变化,其值为119.90°,表明NaOL可以大幅度提高方解石表面的疏水性。当方解石与10 mg/L的F-吸附后,再添加150 mg/L的NaOL时,方解石表面的接触角为108.00°,与未吸附相比接触角分别减少了11.90°,从而减弱了方解石表面的疏水性。这是因为F-和方解石中的Ca2+反应生成新的物质CaF2占据了NaOL的吸附位点,同时NaOL属于阴离子型捕收剂,会与F-一起竞争吸附在方解石表面。

图3 不同条件下方解石表面接触角变化(c(NaOL)=150 mg/L,c(F-)=10 mg/L)Fig.3 Contact angle variation of calcite surface under differentconditions (c(NaOL)=150 mg/L, c(F-)=10 mg/L)
以HCl为pH调节剂、NaOL为捕收剂时,不同F-浓度对方解石表面接触角的影响如图4所示。由试验结果可知,当F-浓度从0 mg/L增加到60 mg/L时,方解石表面的接触角从119.90°下降到95.02°,减少了24.88°。方解石与不同浓度的F-相互作用后再与NaOL作用时,随着添加F-浓度的增大,方解石表面的接触角反而逐渐减小,方解石矿物表面的疏水性减弱。这表明高浓度的F-会减小NaOL与方解石的接触机会。

图4 F-浓度对方解石表面接触角的影响(c(NaOL)=150 mg/L)Fig.4 Effect of F-concentration on contact angle ofcalcite surface (c(NaOL)=150 mg/L)
2.3 F-对方解石表面Zeta电位的影响
离子在矿物表面的吸附会改变矿物表面的电荷分布。通过对不同条件下矿物表面电荷分布的研究,揭示了矿物表面的吸附特性[18]。图5显示了方解石表面的Zeta电位与F-或NaOL作用前后pH值之间的关系。

图5 pH值与方解石表面电位的关系(c(NaOL)=150 mg/L,c(F-)=10 mg/L)Fig.5 Relationship between pH value and calcite surfacepotential (c(NaOL)=150 mg/L, c(F-)=10 mg/L)
由图5可知在pH值为3~8,方解石表面未出现等电点[19-20]。此时随着矿浆pH值的增大,方解石表面的Zeta电位逐渐减小。当方解石矿浆中添加10 mg/L的F-时,方解石表面的电性整体向负方向移动,表明F-可吸附在方解石表面。当方解石与150 mg/L的NaOL相互作用后,方解石表面电位不断负移,而且电位整体变化较大。当溶液中引入F-和NaOL,溶液中的Zeta电位再一次向负方向移动。表明F-与方解石表面的Ca2+结合,占据了NaOL的吸附位点,减少了NaOL在方解石表面的吸附。
2.4 溶液化学计算分析
方解石是微溶盐型矿物,表面溶解和反应对表面性质的影响起着关键作用[21]。溶液化学计算已被证明是研究捕收剂和盐型矿物相互作用机理的有力工具,图6为方解石和NaOL溶液化学计算图。

图6 方解石和NaOL的溶液化学计算(c(NaOL)=150 mg/L)Fig.6 Solution chemistry calculation for calcite and NaOL (c(NaOL)=150 mg/L)
通过溶液化学计算可以得出,不同pH值下的优势组分在酸性条件下,方解石主要以Ca2+、CaHCO-3的形式存在[22]。NaOL水溶液中以5种组分存在,分别是RCOOH(l)、RCOOH(aq)、RCOO-(一聚物)、(RCOOH)2-2(二聚物)和RCCOH-RCOO-(分子-离子缔合物)[23-24]。在pH值为5~6时,NaOL主要以RCOOH(l)、RCOOH(aq)、RCOO-形式存在,Ca2+是方解石溶液中的优势组分。在没有添加F-时,NaOL一部分以离子形态吸附在方解石表面,另外一部分以分子的形态吸附于方解石表面。当添加F-时,一部分F-与Ca2+结合生成CaF2,另外一部分F-会与NaOL形成竞争吸附,导致方解石与NaOL的接触机会减小。因此,矿浆中的F-会抑制NaOL在方解石表面的吸附。
2.5 XPS分析
为了证实试剂与矿物表面之间的相互作用机理,对不同条件处理后的方解石进行了XPS分析。
图7显示了方解石吸附F-前后的全谱图,方解石表面检测到Ca、C、O元素的峰,没有其他元素的特征峰。说明方解石表面没有其他杂质,与前文中XRD和XRF检测结果一致。图7(b)显示了方解石吸附F-后的全谱图,从图中可以知方解石吸附F-后表面除了方解石含有的元素特征峰以外,还有新的氟元素的特征峰。说明F-在方解石表面发生了明显的吸附,生成了其含氟物质附着在方解石表面。此外由表2方解石表面元素的相对原子百分含量可知,纯的方解石表面钙的原子含量是15.57%,碳的原子含量是35.08%,氧的原子含量是49.35%。当方解石吸附F-后表面钙的原子含量是15.23%,减少了0.34%;碳的原子含量是34.41%,减少了0.67%;氧的原子含量是49.00%,减少了0.35%。其中氟的原子含量增加了1.36%。综上,可明确得出F-在方解石表面发生了化学吸附作用,生成了新的物质CaF2。

图7 不同条件下方解石的XPS全谱图Fig.7 XPS full spectra of calcite under different conditions

表2 方解石表面元素的相对原子分数Table 2 Relative atomic fraction of calcite surface elements
图8显示了不同条件下方解石表面Ca 2p峰的变化。方解石表面Ca 2p可以分为Ca 2p 3/2和Ca 2p 1/2峰。图8(a)显示了天然方解石表面Ca 2p 3/2峰处结合能是346.96 eV,Ca 2p 1/2峰处结合能是350.42 eV[25-26]。当方解石与NaOL作用后结果如图8(b),方解石表面的Ca 2p 3/2峰处的结合能是346.61 eV,Ca 2p 1/2峰处的结合能是350.01 eV。此时方解石表面的Ca 2p 3/2处结合能减少了0.35 eV,Ca 2p 1/2峰处结合能减少了0.41 eV。表明方解石与NaOL作用后,方解石表面的Ca 2p峰的化学环境发生了变化。当方解石吸附F-后与NaOL相互作用后结合能变化如图8(c),此时方解石表面的Ca 2p 3/2峰处的结合能是346.85 eV,Ca 2p 1/2峰处的结合能是350.16 eV。方解石与NaOL作用后的Ca 2p峰的结合能相比,Ca 2p 3/2处的结合能减少了0.11 eV,Ca 2p 1/2结合能减少了0.26 eV。表明当方解石吸附F-后再与NaOL作用,F-占据了NaOL的吸附位点,减少了NaOL与方解石的接触机会。

图8 不同条件下方解石表面Ca 2p峰Fig.8 Ca 2p peaks on calcite surface under different conditions
图9为不同条件下方解石表面O 1s峰的变化。图9(a)O 1s峰拟合中,结合能532.91 eV、531.85 eV、531.24 eV分别对应方解石表面—OH、—CO3、Ca—O的峰位[27]。图9(b)显示方解石与NaOL作用后,O 1s结合能分别为531.58 eV、530.96 eV、530.66 eV,其中—CO3的峰位发生了0.89 eV的偏移。而在方解吸附F-与NaOL作用,结合能如图9(c)分别为531.47 eV、531.12 eV、530.60 eV。—CO3的峰位发生了0.73 eV的偏移,说明当方解石吸附F-后再与NaOL作用和方解石直接与NaOL作用相比,F-的存在会改变方解石表面元素的结合能大小。即F-的存在限制了NaOL与方解石的相互作用。

图9 不同条件下方解石表面O 1s峰Fig.9 O 1s peaks on calcite surface under different conditions
方解石吸附F-后,方解石的表面元素组成及含量都发生了变化。方解石与F-、NaOL相互作用时,方解石表面的Ca和O元素的化学环境发生相应改变。当方解石吸附F-后再与NaOL相互作用时,生成CaF2附着在表面占据了方解石表面的活性位点从而减弱了NaOL与方解石的作用。
3 结 论
(1)矿浆中的F-在方解石表面的吸附量随着制浆时间的增加逐渐增大,在90 min时吸附量为0.033 59 mg/g。随着时间继续增加,F-在方解石表面的吸附量不再改变,趋于平衡。
(2)在矿物浮选制浆中,当NaOL为矿物捕收剂时,F-的存在会减少NaOL在方解石表面的吸附量,从而降低方解石的接触角大小,且随着F-浓度的增加其接触角不断减小。
(3)Zeta电位,溶液化学计算和XPS分析表明,NaOL在方解石表面发生了物理吸附和化学吸附,F-会和方解石表面的Ca2+反应生成CaF2沉淀,占据了方解石表面的活性位点,从而抑制了方解石表面的疏水性。
