构建我国药品临床综合评价工作机制的思考
2020-12-28石秀园赵锐李璠刘春平高晶磊赵琨
石秀园 赵锐 李璠 刘春平 高晶磊 赵琨

摘 要 目的:推进我国药品临床综合评价工作的具体落实,促进药品回归临床价值,提高有限资源的利用效率,为卫生健康部门的决策者提供参考依据。方法:通过梳理药品临床综合评价相关政策文件和文献,介绍国内相关政策演进及研究进展,分析并归纳加拿大、美国、英国、澳大利亚、欧洲、国际药物经济学和结果研究学会等国家(地区/组织)的先进经验(包括评估主体、评估价值维度、评估方法、评估流程与结果应用),提出构建我国药品临床综合评价工作机制的相关建议。结果与结论:建议通过以下措施来构建我国药品临床综合评价机制,包括以决策需求为导向,进一步明确药品临床综合评价的发展目标和定位;发挥政府主导作用,加强部门间合作和政策的协同;建立内外部标准可溯质控体系,坚持公开、公正、公平的原则;充分发挥信息化和大数据作用,加强对评价方法学和评价标准的探索;加强评价结果的转化应用,推动评价结果服务政策决策等。
关键词 药品临床综合评价;多准则决策分析;评价机制
ABSTRACT OBJECTIVE: To promote the implementation of clinical comprehensive evaluation of drugs in China, promote the return of drugs to clinical value, improve the utilization efficiency of limited resources, and provide reference for decision makers of health departments. METHODS: By combing the relevant policy documents and literatures of clinical comprehensive evaluation of drugs, the evolution and research progress of relevant policies in China were introduced; the advanced experiences (including evaluation subjects, evaluation value dimensions, evaluation methods, evaluation procedures and results applications) of Canada, the United States, the United Kingdom, Australia, Europe, International Society for Pharmacoeconomics and Outcomes Research and other countries (regions/organizations) were analyzed and summarized; relevant suggestions on the construction of Chinas clinical comprehensive evaluation mechanism for drugs were put forward. RESULTS & CONCLUSIONS: It is suggested that the following measures should be taken to construct the clinical comprehensive evaluation mechanism of drugs in China including that the development goal and orientation of clinical comprehensive evaluation of drugs should be further clarified with the guidance of decision-making needs; the government should play a leading role and strengthen inter departmental cooperation and policy coordination; the traceability quality control system of internal and external standards should be established, adhere to openness, fairness and fair; at the same time, it is suggested to give full play to the role of informatization and big data, strengthen the exploration of evaluation methodology and standards, strengthen the transformation and application of evaluation results, and promote the service of evaluation results to policy decision-making.
KEYWORDS Clinical comprehensive evaluation of drugs; Multi-criteria decision analysis; Evaluation mechanism
藥品临床综合评价是基本药物遴选和动态调整、药品采购、临床合理用药等工作的基础支撑,对健全药品供应保障制度的决策部署、及时准确掌握药品使用情况、不断提高药品规范科学使用管理水平、更高质量地保障人民健康具有重要意义。近年来随着医药费用上涨、医保资金压力增加、临床用药合理性有待提高等问题日益凸显,结合我国基本国情开展药品综合评价,并以此为抓手,促进药品回归临床价值,能让患者真正用上临床疗效显著、可及且可负担的药品十分必要[1]。新时期下,国家卫生决策及药品目录决策工作对高质量决策证据提出了新的需求,如何高效率地进行药品临床综合评价,如何统筹考虑资源配置的价值维度和标准,如何实现以价值为基础的循证决策,为人民群众提供高性价比的医药健康服务,是开展药品临床综合评价研究的重点课题。本研究通过系统回顾国家药品临床综合评价政策,借鉴国际经验,结合国内实际,提出构建我国药品临床综合评价体系和运行机制的策略建议,以期促进药品回归临床价值,提高有限资源的利用效率,为卫生健康部门的决策者提供参考依据。
1 我国药品临床综合评价的政策演进及研究进展
1.1 我国药品临床综合评价的政策演进
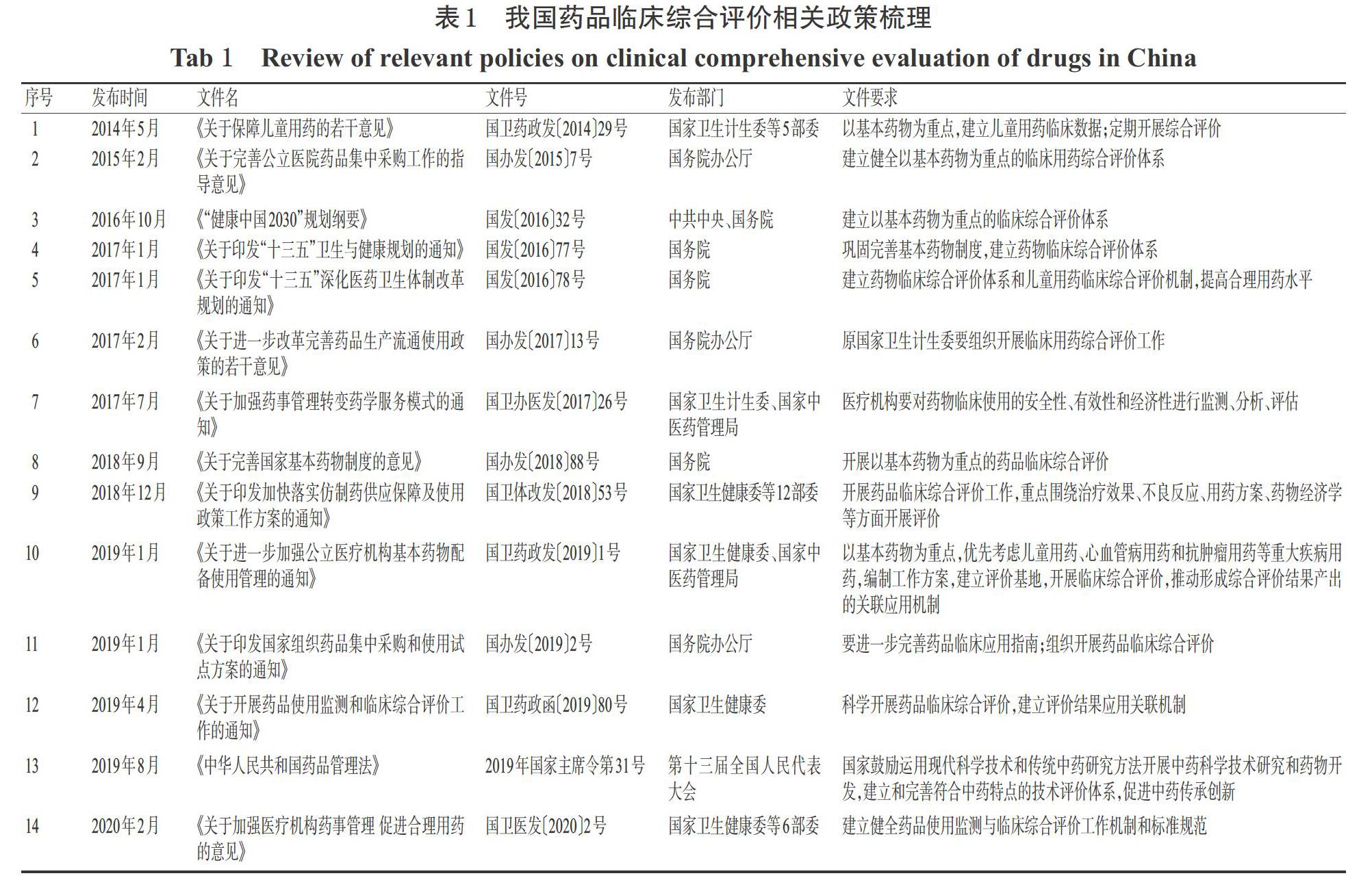
基于我国药品临床综合评价实施的不同阶段,可将其发展路径大致分为3个时期,即起步期、成长期和发展新时期,相关政策梳理详见表1。
药品临床综合评价起步期(2014-2015年),主要是我国药品临床综合评价的试水起步阶段,“以基本药物为重点”的药品临床综合评价被首次提出。此阶段,国家初步探索了药品临床综合评价应用于儿童用药的特定领域,并对评价的理论框架不断进行更新完善,为药品临床综合评价工作的起步做好了前期准备。然而,虽然当时在全国范围内遴选出具有综合优势的医院开展评价,但评价并未普及且未明确评价结果如何进行应用。
药品临床综合评价成长期(2016-2017年)为药品临床综合评价的发展阶段。在这一阶段,党中央、国务院颁布了《“健康中国2030”规划纲要》《“十三五”卫生与健康规划》《“十三五”深化医药卫生体制改革规划》,正式提出“建立以基本药物为重点的临床综合评价体系”,将药品临床综合评价正式上升为国家健康战略规划。在《关于进一步改革完善药品生产流通使用政策的若干意见》(国办发〔2017〕13号)中明确提出“国家卫生计生委要组织开展临床用药综合评价工作,探索将评价结果作为药品集中采购、制定临床用药指南的重要参考”。此阶段,药品临床综合评价迅速发展并逐步完善;但同时我们也看到,局部地区由于评价体系和运行机制不完善等原因,药品临床综合评价工作执行艰难。
2018年9月,国务院发布了《关于完善国家基本药物制度的意见》(国办发〔2018〕88號),再次明确提出“开展以基本药物为重点的药品临床综合评价,指导临床安全合理用药”。自此,药品临床综合评价进入了发展新时期(2018年至今)。同年12月,国家卫生健康委、国家发改委等12部委在《关于印发加快落实仿制药供应保障及使用政策工作方案的通知》(国卫体改发〔2018〕53号)中提出要“开展药品临床综合评价工作,重点围绕治疗效果、不良反应、用药方案、药物经济学等方面开展评价”。2019年1月,国家卫生健康委、国家中医药管理局发布了《关于进一步加强公立医疗机构基本药物配备使用管理的通知》(国卫药政发〔2019〕1号),确立了以基本药物为重点,优先考虑对儿童用药、心血管病用药和抗肿瘤用药等重大疾病用药开展评价。2019年4月,国家卫生健康委发布的《关于开展药品使用监测和临床综合评价工作的通知》(国卫药政函〔2019〕80号)明确加快建立健全药品临床综合评价标准规范和工作机制,这一文件对此项工作的开展具有里程碑意义。在新时期下开展具有中国特色的药品临床综合评价工作,不仅需要不断完善相关政策,建立互联互通的组织体系,还应对评价过程进行质量控制,结合信息化和真实世界大数据,在评价结果的转化应用上下足功夫。
1.2 药品临床综合评价的国内研究进展
对药品临床综合评价进行系统性立项研究最早可以追溯到2008年中国药品综合评价指南项目组的组建。项目组最初由30多位国内资深临床药师共同发起,并在中国药学会医院药学专业委员会及人力资源与社会保障部社会保障研究所专家指导下开展工作。当时期望将药品综合评价的结果应用于国家对药品相关目录和技术规范的修订,为基本药物、药品报销品种、药品定价、临床路径和招标采购等工作提供有效依据。2011年,该项目组发布了《中国药品综合评价指南参考大纲(第一版)》,并在2015年更新发布了第二版,确定了从药品安全性、药品有效性、体内药学特性、药品质量、药品顺应性、临床药物经济性评估、药物临床价值综合评价、药品信息服务评价等8个方面对药品进行综合评价[2]。《中国药品综合评价指南参考大纲》搭建了我国药品临床综合评价的理论框架并为其奠定了重要基础。
我国关于药品临床综合评价的研究大多是对相关细分领域进行研究,如药品安全性、有效性、经济性的评价方法,药品价值评价,药品上市前评价、临床评价、上市后再评价等。也有不少学者对药品临床综合评价的维度和指标展开了研究,如贾露露等[3]根据儿童用药特点,指出儿童用药综合评价应基于药品安全性、有效性、经济性、体内药学特性、顺应性等5个维度进行评估比较。又如孔凡心等[4]建议我国药品临床综合价值评价的核心指标为安全性、有效性、经济性、可支付性、可及性、公平性、依从性、适宜性。其中,安全性、有效性、经济性、可支付性、依从性的概念界定清晰,数据来源充分,研究设计在国际上存在共识,且方法学较为成熟;但在其他如可及性、公平性、适宜性等维度尚未有统一定义,还有待深入探讨。特别是在重点疾病、创新药的评价方面,还需要形成评价工作机制,在多方达成共识的前提下,进行药品临床综合评价体系建设。
2 药品临床综合评价的国际经验
2.1 评估的主体
在医药卫生决策中,各国政府出于对药品价值评估或药物经济性评估需求,其药品审评决策机构通常会指定一个明确的评价机构参与评估审查。研究发现,各国评价机构的组织模式和运行机制与国家医疗卫生服务体系相适应——以公立医疗机构为主体的国家,其评价机构主要由政府支持或参与,如英国国家卫生和临床技术优化研究所(NICE)、加拿大药物和卫生技术局(CADTH)和澳大利亚的药品保险咨询委员会(PBAC)等;以非政府举办医疗机构为主体的国家,其评价机构也呈现非国有的情况,如美国有81%的卫生技术评价机构是非政府组织,但是这些卫生技术评价机构同时也接受政府部门的委托,开展卫生政策评估[5]。
2.2 评估考虑的价值维度
价值维度判断是基于某一项卫生技术评估产生的证据和相关政策评价的结果,综合、全面、系统、科学地判断这项卫生技术的应用价值,以支持制定和完善相关政策[6]。随着医疗成本上升、卫生资源需求量增加、卫生技术的复杂性增强,以及创新医疗技术的不断涌现,对基于卫生技术评估结果的多维度价值判断框架需求越来越强烈,很多国家(地区/组织)基于自身卫生决策需求开发了相应的价值评估框架,详见表2。
3.4 充分发挥信息化和大数据作用,加强对评价方法学和评价标准的探索
加快适用于我国国情和现实需求的方法学和评价标准的研发,加强信息化和真实世界大数据的应用,是推进药品临床综合评价工作的重要基础。在新时期下,应加强对药品临床综合评价方法学和相关实证研究的探索,充分整合和利用真实世界大数据、区块链、人工智能等技术,建立国家药品评价信息平台,通过平台查询评价开展情况、上报评价问题、发布评价结果等,避免重复评价,对评价关键环节和核心部分进行质量控制;同时,重视从多个维度对药品综合价值进行判断,在应用中保持對评价维度和指标结构的持续优化,注重评价的实际可操作性。
3.5 加强评价结果的转化应用,推动评价结果服务于政策决策
在法律法规的框架引领下,结合我国国情,将澳大利亚、英国、加拿大等国家的成功经验本土化,明确药品临床综合评价及其评价结果的应用方式,重视药品上市前评价与上市后评价的相互结合。评价结果报告应包括药品价值综合判断和推荐意见两部分,例如推荐将证据充分、结果确定的评价药品优先纳入医保目录,以药品报销作为评价结果应用的切入口,开展药品技术评估和药物政策评估,并逐步扩大其应用范围。由政府组织实施主题遴选、综合评价、质量评审、转化应用及信息发布,加强评价成果转化的应用,可考虑对持续更新的数据每年进行动态优化评价,构建动态优化体制,从而更好地推动药品临床综合评价结果为政策决策服务。
参考文献
[ 1 ] 国家卫生健康委员会.关于开展药品使用监测和临床综合评价工作的通知[EB/OL].(2019-04-09)[2020-05- 22].http://www.nhc.gov.cn/yaozs/pqt/201904/31149bb18- 45e4c019a04f30c0d69c2c9.shtml.
[ 2 ] 中国药品综合评价指南项目组.中国药品综合评价指南参考大纲:第二版[J].药品评价,2015,12(8):6-25.
[ 3 ] 贾露露,孟瑶,刘亦韦,等.基于层次分析法开展儿童用药循证综合评价[J].药物流行病学杂志,2016,25(10):601-605.
[ 4 ] 孔凡心,马爱霞,李洪超,等.公共决策视野下药品临床综合价值的界定、测量与评价[J].中国药房,2020,31(5):539-544.
[ 5 ] 徐文煜,薛迪.美国、加拿大与澳大利亚的卫生技术评估[J].中国卫生质量管理,2011,18(1):8-10.
[ 6 ] 郭武栋.如何“以价值论英雄”[J].中国卫生,2019(10):79-81.
[ 7 ] 郭祖德,周萍,夏志远,等.加拿大卫生技术评估机构研究:以加拿大药物和卫生技术局为例[J].中国卫生资源,2016,19(3):187-190.
[ 8 ] PEARSON SD. The ICER value framework:integrating cost effectiveness and affordability in the assessment of health care value[J]. Value Health,2018,21(3):258-265.
[ 9 ] NEUMANN PJ,COHEN JT. Measuring the value of prescription drugs[J]. N Engl J Med,2015,373(27):2595- 2597.
[10] NICE. The National Institute for Health and Clinical Excellence[EB/OL]. (2007-01-01)[2020-05-22]. https://www.nice.org.uk/guidance.
[11] PBAC. Pharmaceutical Benefits Advisory Committee(PBAC) membership[EB/OL].(2011-06-01)[2020-05- 22].http://www.pbs.gov.au/info/industry/listing/participants/pbac.
[12] 李艳博,陈校云,余中光,等.欧洲卫生技术评估网络的核心评估模型及应用[J].中国卫生信息管理杂志,2016,13(4):370-375.
[13] SCHEY C,KRABBE PFM,POSTMA MJ,et al. Multi- criteria decision analysis (MCDA):testing a proposed MCDA framework for orphan drugs[J]. Orphanet J Rare Dis,2017. DOI:10.1186/s13023-016-0555-3.
[14] LAKDAWALLA DN,DOSHI JA,GARRISON LP JR,et al. Defining elements of value in health care:a health economics approach:an ISPOR special task force report:3[J]. Value Health,2018,21(2):131-139.
[15] 刘树林.多属性决策理论方法与应用研究[D]. 北京:北京航空航天大学,1997.
[16] M?HLBACHER AC,KACZYNSKI A. Making good decisions in healthcare with multi-criteria decision analysis:the use,current research and future development of MCDA[J]. Appl Health Econ Health Policy,2016,14(1):29-40.
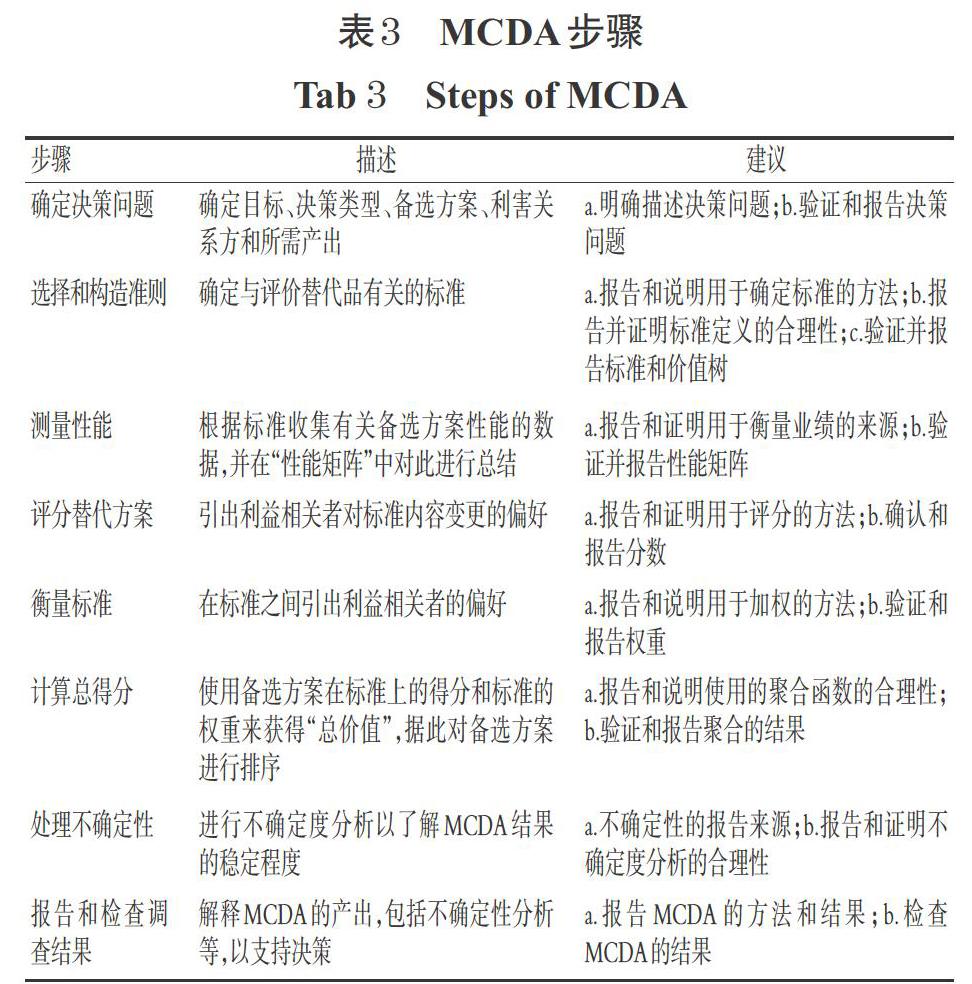
[17] THOKALA P,DEVLIN N,MARSH K,et al. Multiple criteria decision analysis for health care decision making:an introduction:report 1 of the ISPOR MCDA emerging good practices task force[J]. Value Health,2016,19(1):1-13.
[18] MARSH K,IJZERMAN M,THOKALA P,et al. Multiple criteria decision analysis for health care decision making:emerging good practices:report 2 of the ISPOR MCDA emerging good practices task force[J]. Value Health,2016,19(2):125-137.
[19] 姚嘉奇,周挺,管欣,等.英国NICE卫生技术评估介绍及对我国医保目录动态调整的启示[J].中国循证医学杂志,2018,18(9):984-989.
[20] 茅艺伟,陈英耀,唐檬,等.澳大利亚卫生技术评估的应用[J].中国卫生资源,2014,17(6):484-486.
(收稿日期:2020-06-15 修回日期:2020-09-07)
(编辑:胡晓霖)
