不同保存条件下龙头鱼不同组织DNA提取效果比较分析
2020-12-26
(浙江海洋大学水产学院,浙江舟山 316022)
龙头鱼Harpodon nehereus 俗称虾潺、豆腐鱼、九肚鱼、鼻涕鱼,是一种广泛分布于热带和亚热带海域范围内的中小型经济鱼类,喜栖息于水深50 m 以浅的近岸或河口泥沙底质的环境,我国浙江舟山、温台渔场及福建沿海产量较高[1]。近年来,由于带鱼、大黄鱼、小黄鱼等主要经济鱼类资源的衰退[2-4],使得以龙头鱼和鳀鲱鱼类为代表的中小型鱼类捕捞产量逐年增加,经济价值和生态价值日益突显。龙头鱼已在我国东海和南海渔业中占有重要地位,当地渔汛期可占渔获物的20%~40%,具有较好的捕捞潜力和开发利用前景[5-6]。
目前,国内外有关龙头鱼的研究大多数集中在形态特征[7]、资源分布[8-9]、生理生态[10]和营养加工[11-13]等方面。二十世纪70 年代以来,随着分子生物学技术的迅速发展,限制性酶切片断长度多态性(Restriction Fragment Length Polymorphisms,RFLP)、随机扩增多态性DNA(Polymerase Chain Reaction DNA,RAPD)、扩增片段长度多态性(Amplified Fragment Length Polymorphism,AFLP)和简单重复序列(Simple Sequence Repeats,SSR)等一系列建立在聚合酶链式反应(Polymerase Chain Reaction,PCR)基础上的分子标记技术相继出现[14]。由于DNA 分子标记是从核酸水平对遗传变异的直接反映,且具有操作简单、无组织特异性、不受环境条件和发育阶段的影响等优点,目前已广泛应用于物种遗传多样性研究、亲缘关系鉴定、遗传图谱构建和分子辅助育种等领域[14-15]。
PCR 是一种在生物体外进行的特殊DNA 复制的分子生物学过程[16],基因组DNA 提取质量的高低直接关系着PCR 反应的效果,决定了后续分子标记相关实验的成败。有关不同保存情况下鱼类组织样品DNA 提取效果的比较,前人已开展了许多相关工作[17-21],但研究对象多以淡水鱼类为主,针对海洋鱼类的较少。本研究采用传统Tris 饱和酚-氯仿法对不同保存状态下龙头鱼肌肉和鳍条组织样品DNA 提取效果进行比较研究,旨在建立最适于龙头鱼分子标记的基因组DNA 提取的组织和保存方法,以期为龙头鱼遗传多样性和种质资源研究奠定基础,也为合理利用与保护该渔业资源提供科学依据。
1 材料与方法
1.1 样品采集与处理
实验所用龙头鱼于2018 年11 月购买自浙江省舟山市沈家门渔港。剪取新鲜鱼体上背部肌肉和鳍条组织,装入1.5 mL 离心管,分别于4 ℃冷藏、-20 ℃冷冻及浸泡于无水乙醇、75%(V/V)乙醇和10%(V/V)甲醛室温条件下保存。用于剪取不同个体、不同组织的解剖剪严格分开并单独清洗,以防交叉污染影响实验数据的准确性。冷藏样品保存24 h,其他样品保存30 d 之后进行模板DNA 提取实验。
1.2 基因组DNA 提取
10%甲醛浸泡的样品参考文献[22-24]的方法需先进行预处理,具体步骤如下:70%的乙醇溶液中浸泡12 h,依次换入80%、90%乙醇各浸泡2 h,最后浸泡入无水乙醇中。各样品剪取一小块置于干净的卫生纸上进行按压,待液体充分吸干后,再称取约0.01 g 样品放入新的离心管中。
采用Tris 饱和酚-氯仿法[25]提取不同组织样品的基因组DNA,详细提取方法如下:①在装有样品的离心管中加入650 μL STE 裂解缓冲液[0.1 mol·L-1NaCl,10 mmol·L-1 Tris.Cl (pH 8.0)],1 mmol·L-1EDTA(pH 8.0)和蛋白酶K(德国Merck 公司,20 μg·μL-1) 15 μL,颠倒混匀后置于50 ℃烘箱内进行消化2~3 h(每隔30 min 颠倒混匀1 次)。②待样品澄清时,从烘箱取出晾凉至室温,加入650 μL 平衡酚,温和颠倒混匀10 min。③离心10 min(转速12 000 r·min-1),吸取600 μL 上清液至另一干净离心管中,再加入600 μL 平衡酚,温和颠倒混匀10 min。④离心10 min (转速12 000 r·min-1),吸取500 μL 上清液至另一干净离心管中,加入500 μL 的苯酚:氯仿:异戊醇(25:24:1),温和颠倒混匀10 min。离心10 min(转速12 000 r·min-1),吸取400 μL 上清液至另一干净离心管中。⑤加入400 μL 的氯仿:异戊醇(24:1),温和颠倒混匀10 min,离心10 min(转速12 000 r·min-1),吸取300 μL 上清液至另一干净离心管中。⑥加入600 μL 预冷的无水乙醇,稍微颠倒混匀后,-20 ℃沉淀30 min 左右,离心10 min(转速12 000 r·min-1),轻柔倒去乙醇。⑦加入预冷的75%乙醇600 μL,缓慢颠倒洗涤DNA 沉淀,4 ℃离心10 min(转速12 000 r·min-1)。⑧轻柔倒去乙醇,将DNA 样品自然风干后,加入100 μL 灭菌双蒸水溶解DNA,置4℃冰箱保存。
1.3 基因组DNA 检测
1.3.1 紫外分光光度计检测
用量程为1~10 mL 的德国Eppendorf 单道可调移液器吸取5 μL 模板DNA,用英国柏点(型号BioDrop μLite)紫外分光光度计直接测定并记录DNA 浓度和A260 nm/A280 nm 值。
1.3.2 基因组DNA 的琼脂糖凝胶电泳检测
取3 μL 待检DNA 溶液与2 μL 6×Loading Buffer 充分混合后直接上样于1.0%的琼脂糖凝胶,选择2 000 bp DNA Marker 作参照,使用六一仪器厂生产的DYY-8 型电泳仪在150V 恒压下电泳25 min 左右。置于凝胶成像系统(型号Tanon 3500)下检测并拍照。
1.3.3 PCR 扩增产物的琼脂糖凝胶电泳检测
以所提取的龙头鱼基因组DNA 为模板,采用通用引物L14734-F:5’-AACCACCGTTGTTATTCAACT-3’和H15915-R:5’-CTCCGATCTCCGGATTACAAGAC-3’[26-27],用美国Bio-Rad 公司PCR 仪(型号T100 Thermal Cycler)扩增龙头鱼Cyt b 基因序列。PCR 反应总体积为25 μL,其中含0.25 μL 浓度为5 U·μL-1的Taq 酶,正反向引物(10 μmol·L-1)各1 μL,dNTPs (2.5 mmol·L-1) 2 μL,10×buffer 缓冲液(含Mg2+) 2.5 μL,模板DNA (约50 ng) 1 μL,灭菌水17.25 μL。PCR 反应程序为95 ℃预变性5 min,95 ℃变性0.5 min,52 ℃退火0.5 min,72 ℃延伸1.25 min 循环35 次,72 ℃延伸5 min。用浓度1.0%琼脂糖凝胶电泳检测PCR扩增产物,凝胶成像系统下检测拍照。
2 结果与分析
各种保存方法下,肌肉组织提取的DNA 浓度均高于鳍条组织(表1)。乙醇是较为常用的组织固定剂,能使得蛋白质变性、酶丧失活性,样品保存效果较好。本研究中,用无水乙醇保存的鳍条样品DNA 浓度最高平均值为0.071 μg·μL-1,75%乙醇保存的肌肉样品次之,为0.069 μg·μL-1。冷藏和冷冻保存的样品DNA平均浓度在0.047~0.058 μg·μL-1之间,表明未加固定剂的样品经过降温升温的环境变化后,会使得样品产生降解,影响所提取的DNA 浓度。10%甲醛保存的样品DNA 浓度最低,平均值仅在0.035 μg·μL-1左右。甲醛同样能使酶丧失活性,而且甲醛的穿透力强,能均匀固定样品,但一定浓度的甲醛会能引起DNA断裂(DNA strand breakage,DSB)、DNA-DNA 交联(DNA-DNA crosslink,DDC)、DNA-蛋白质交联(DNA-protein crosslink,DPC)等作用[28]。因此,即使经乙醇梯度处理后,仍会有甲醛溶液残留,阻碍核酸释放、影响DNA 提取效果。
通常核酸的最高紫外吸收峰的波长在260 nm 处,蛋白质最高紫外吸收峰的波长在280 nm 处,A260可反映的是溶液中核酸的吸光度,A280 反映的是溶液中蛋白质或者氨基酸的吸光度。一般而言,纯净DNA 的A260/A280 比值在1.8 左右。本实验中,不同保存方法下龙头鱼肌肉和鳍条组织样品基因组DNA的A260/A280 值在1.808~1.973 之间,纯度均符合要求(表1)。冷藏的新鲜鳍条组织中提取出的DNA 较为纯净,比值最接近1.8。10%甲醛保存样品由于完全消化所需时间较长,使得消化进行完全,DNA 纯度也相对较好。
从基因组DNA 电泳检测结果来看,以75%乙醇浸泡的样品为例,电泳图谱中肌肉组织样品条带清晰完整,亮度高于鳍条组织(图1),表明肌肉组织所提取的基因组DNA 浓度和质量均好于鳍条组织条,能够用于PCR 扩增的模板,进行遗传多样性等方面的研究。而10%甲醛保存的样品基因组检测条带不明显,且个别条带出现拖带现象,可能与提取过程中操作不当、DNA 片段破碎有关。
经10%甲醛浸泡的肌肉组织所提取的基因组DNA 进行PCR 扩增后无明显条带(图2a),而其他对照组PCR 产物电泳图谱条带清晰完整(图2b),扩增得到大小相同的DNA 片段,没有明显的差异,表明除10%甲醛浸泡的其他各保存方法及组织样品所提取的DNA 完全可以用于PCR 扩增。
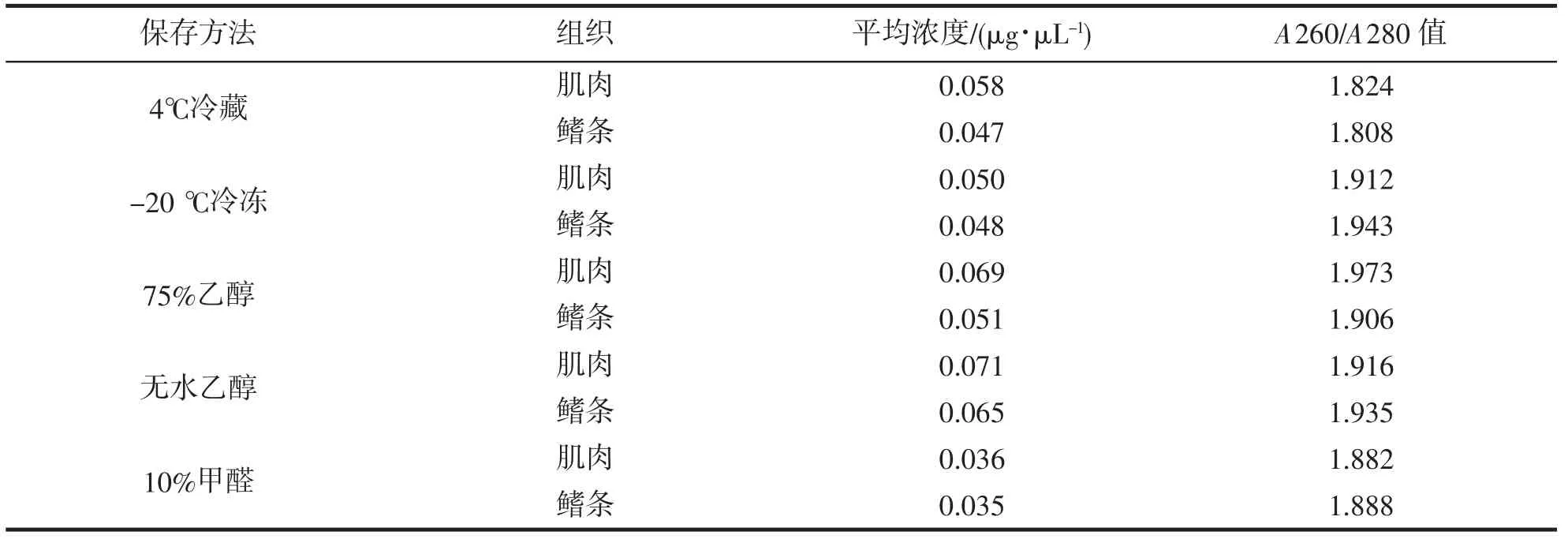
表1 不同保存条件下肌肉和鳍条样品DNA 浓度和A260/A280 值Tab.1 DNA concentration and A260/A280 value of muscle and fin samples under different preserved conditions
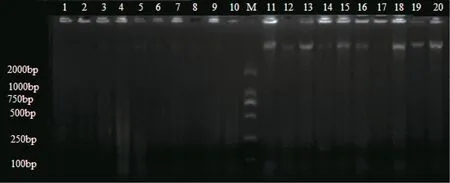
图1 基因组DNA 提取效果电泳图Fig.1 Electrophoretogram of genomic DNA extraction effect
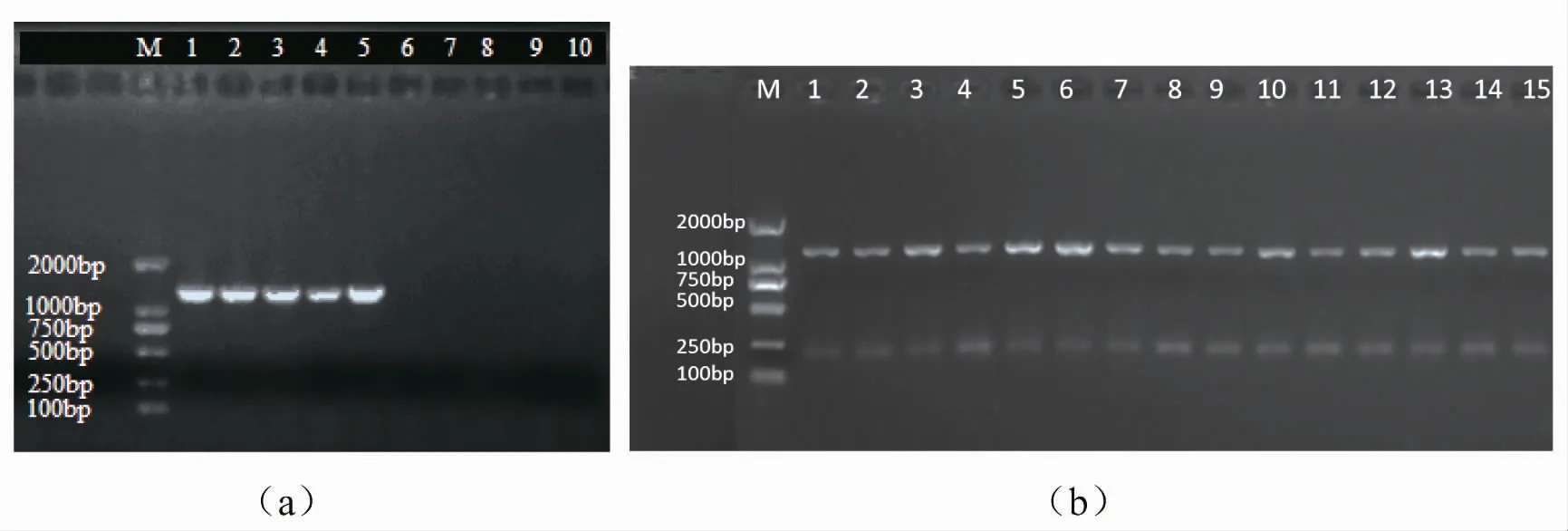
图2 基因组DNA PCR 扩增效果电泳图Fig.2 Electrophoretogram of PCR-products
3 讨论
基因组DNA 模板质量关系到SSR、RAPD、ISSR 等一系列分子标记实验的效果,本实验针对不同保存方法下龙头鱼肌肉和鳍条组织基因组DNA 提取效果进行了比较研究。结果表明,除10%甲醛浸泡的样品外,龙头鱼的肌肉和鳍条组织在另外4 种保存条件下(冷藏、冷冻、无水乙醇浸泡、75%乙醇浸泡)均能获得较高质量的基因组DNA,可用于进一步的分子标记实验。张海琪等[29]的研究结果表明,大黄鱼Pseudosciaena crocea 鲜活样品以及冷冻、70 %乙醇保存的样品均可得到高质量的DNA,而从10%福尔马林保存样品DNA 获得率低。范武江等[19]对鳙鱼Aristichths nobilis 肌肉、肝脏、尾鳍以及用乙醇保存的3 种组织进行DNA 提取效果分析,发现DNA 样品质量最好的是尾鳍。然而本研究结果发现,同等重量的龙头鱼肌肉样品比鳍条样品提取的DNA 浓度高,且基因组检测和PCR 扩增效果均较好,分析可能原因一方面来自人为实验差异影响,另一方面也可能与龙头鱼肌肉组织含水量较高、肉质软嫩易于被裂解有关。此外,实验过程中发现甲醛固定的组织样品消化所需时间为其他样品的十几倍,且PCR 扩增前后琼脂糖凝胶电泳电泳结果均不明显,表明甲醛残留对后续实验的影响较大。尽管前处理过程中利用乙醇的羟基与甲醛的羰基反应生成缩醛或半缩醛的反应原理,通过乙醇浓度梯度置换出甲醛,但由于甲醛与乙醇较难反应,且反应产物不稳定,加之细胞结构被破坏,甲醛对蛋白酶K 有抑制作用,使得甲醛样品所提取出的DNA 浓度仍远低于其他样品[30]。因此,后续的探索实验还需要对10%甲醛浸泡样品的预处理进行改进。
由于样品选取、保存和DNA 提取的各个环节均会影响DNA 浓度和纯度,具体选用哪种方法应根据取样地点和实验条件而定。从提高实验效率和节约经济成本的角度来看,应综合考虑选择最优设计方案。首先,由于龙头鱼体型狭长,内脏器官小,鳞片少且易脱落,故内脏器官和鳞片不适宜作为样品组织。选取样品组织应首选龙头鱼肌肉组织,选择丰满结实的背部肌肉,尽量避开鱼骨。如龙头鱼个体过小或者肌肉损毁严重,则可选用鱼鳍代替肌肉组织。其次,由于海上采样路途遥远,无水乙醇具有无毒、无异味且可用于消毒等优点,在提取过程的预处理也较为简便,但无水乙醇会使组织迅速脱水并在表面形成硬膜,阻止内部组织被固定,有研究表明95%乙醇固定速度慢、有利于充分浸透组织[31],因此建议出海作业采集的龙头鱼样品保存宜用无水乙醇固定,以减少样品组织细胞降解。但从经济和实用角度考虑,也可用95%乙醇替代无水乙醇。最后,DNA 基因组提取的第一步消化样品保证时间充足,操作过程不时摇动溶液以促使蛋白酶K 发挥最佳消化活性,同时尽量减少试剂对样品的污染,提高DNA 浓度和纯度。
