两株苯唑草酮降解细菌的筛选与降解能力测定
2020-12-23杨峰山唐若瑶马玉堃付海燕刘春光
杨峰山, 孙 丛, 唐若瑶, 马玉堃, 付海燕, 刘春光
(1. 黑龙江大学 农业微生物技术教育部工程研究中心, 哈尔滨 150500;2. 黑龙江大学 生命科学学院 黑龙江省寒地生态修复与资源利用重点实验室, 哈尔滨 150080;3. 黑龙江大学 生命科学学院 黑龙江省普通高校分子生物学重点实验室, 哈尔滨 150080)
苯唑草酮(topramezone,简称TO)是2016年上市的玉米田间除草剂[1-2],其主要通过抑制杂草中类胡萝卜素和叶绿素的合成,使杂草不能完成光合作用而逐渐死亡[3],能有效防除世界范围内玉米作物上的主要禾本科杂草和阔叶杂草。然而,由于其在土壤中自然消解缓慢,半衰期长达125 d[4],苯唑草酮的施用带来了土壤残留药害等问题。研究[5-6]表明,苯唑草酮可能会使小鼠患有甲状腺瘤,还可能会增加小鼠和兔子骨骼骨化位点的改变和变异的风险;另外,施用了苯唑草酮的玉米田土壤对后茬敏感作物水稻会产生较为明显的抑制效果[7]。目前,对苯唑草酮的药效以及毒理方面的报道较多,但对其微生物降解方面报道较少。本研究从黑龙江省哈尔滨市呼兰区施用苯唑草酮的玉米田土壤中筛选出两株以其为唯一碳氮源的菌株,对其进行种属鉴定、降解能力测定等研究,以期为利用这两株细菌进行苯唑草酮污染土壤的微生物修复提供理论依据。
1 材料与方法
1.1 材料
1.1.1 样品来源
土壤样品来源于黑龙江省哈尔滨市呼兰区施用苯唑草酮的玉米试验田。
1.1.2 主要试剂和培养基
98.4%质量分数苯唑草酮标准品(德国巴斯夫公司),97%质量分数苯唑草酮原药(德国巴斯夫公司)。
Luria-Bertani培养基(LB)[8];基本培养基(MM)[8]。
苯唑草酮无机盐培养基(MM+TO):基本培养基灭菌后按比例加入97%苯唑草酮原药备用。
1.2 方法
1.2.1 苯唑草酮降解菌株的筛选及降解能力定量分析
参考摇瓶富集培养法[9],驯化质量浓度分别为5、50、100、200、300、400、500、600、800和1000 mg/L,分离能够以苯唑草酮为唯一碳氮源生长的菌株,将其接入到500 mg/L的MM+TO液体培养基中,设置不加菌为对照组,称重并记录,30 ℃,170 r/min,培养7 d,补齐水分,使用二氯甲烷对培养液中的苯唑草酮进行萃取,利用HPLC对样品进行分析,色谱柱:Waters 300×3.9 mm,波长:254 nm;流动相为甲醇∶水(乙酸铵1.25 g/L)=1∶4;柱温:30 ℃;流速:1.4 mL/min;进样量:20 μL。
绘制苯唑草酮的标准曲线,回收率和降解率的计算公式如下:
添加回收率(%)=(实测质量浓度÷添加质量浓度)×100%
(1)
降解率(%)=[1-(处理实测质量浓度÷对照实测质量浓度)]×100%
(2)
1.2.2 苯唑草酮降解菌株的生长曲线测定
将活化后的菌株TOB1和TOB2分别以1%接种到两种培养基(LB和MM+TO)中,另设MM+TO不接菌为对照组,其中TO的质量浓度分别为500 mg/L和5 mg/L,每组处理3个重复,利用酶标仪测定降解菌株的生长状况,参数如下:温度30 ℃,转数180 r/min,波长600 nm,运行72 h,每15 min检测1次,绘制生长曲线。
1.2.3 菌株的种属鉴定
利用革兰氏染色法观察细胞形态以及平板法观察菌落形态,参考《伯杰细菌鉴定手册(第九版)》和东秀珠的《常见细菌鉴定手册》测定生理生化特征。将PCR扩增16S rDNA序列提交到GenBank数据库并获得登录号,然后采用MEGA 7.0构建系统进化树,以确定菌株的种属关系[10]。
2 结果与分析
2.1 土壤中降解菌的分离与纯化
从土壤中分离纯化出4株细菌菌株,分别编号为TOB1、TOB2、TOB3和TOB4,具体结果如图1所示:菌株TOB1的单菌落呈现乳白色,不透明,圆形,边缘整齐,表面光滑,中央凸起;菌株TOB2的单菌落呈现淡粉色,半透明,圆形,边缘整齐,表面光滑,中央凸起;菌株TOB3的单菌落呈现金黄色,不透明,圆形,边缘整齐,表面光滑;菌株TOB4的单菌落呈现乳黄色,半透明,圆形,边缘不整齐。
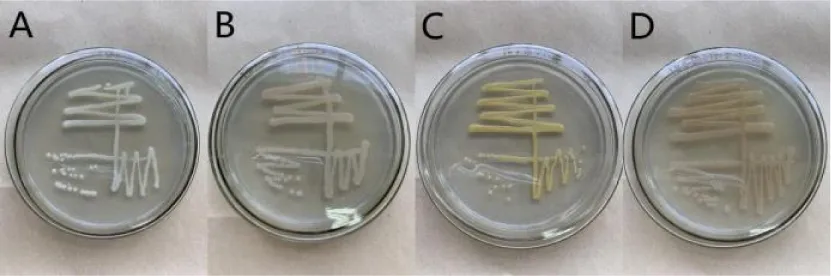
A:TOB1;B:TOB2;C:TOB3;D:TOB4
2.2 苯唑草酮降解菌株的降解能力定量分析
苯唑草酮标样的标准曲线的线性回归方程为:y=13 170x-20 530,其相关系数:R2=0.995 7,通过计算可以得到苯唑草酮的添加回收率为85.6%。 苯唑草酮的残留质量浓度(图2)显示,在初始质量浓度500 mg/L 苯唑草酮培养液中,与对照组相比,添加4种菌株培养7 d后,苯唑草酮的残留质量浓度降低了16.31%~28.76%[图2(a)],在初始质量浓度为5 mg/L的苯唑草酮培养液中,苯唑草酮的残留质量浓度降低了25.23%~85%[图2(b)],其中,菌株TOB1和TOB2对于两种质量浓度均呈现出较高的降解能力,保藏这两株菌做后续研究。
2.3 苯唑草酮降解菌株的生长曲线
如图3所示,菌株TOB1和TOB2在LB培养基中,72 h内都能够呈现正常的生长状态:菌株TOB1在0~1 h处于延迟期,在3~19 h处于对数生长期,在20~55 h处于对数稳定期,在56~72 h处于衰亡期;菌株TOB2在0~5 h处于延迟期,在6~35 h处于对数生长期,在36~50 h处于对数稳定期,在54~72 h处于衰亡期。然而两个菌株都在MM+TO中有所抑制,与对照组相比,在MM+TO(500 mg/L)培养基中这两株菌有所生长,菌株TOB1在42~69 h内OD值能达到0.124~0.157,菌株TOB2在3~66 h OD值能达到0.119~0.232。在MM+TO(5 mg/L)的培养基中,两株菌也能够生长,菌株TOB1在1~72 h内OD值能达到0.110~0.326,菌株TOB2在1~72 h OD值能达到0.103~0.236。综上所述,两株菌在低质量浓度苯唑草酮溶液中(5 mg/L)比在高质量浓度(500 mg/L)中生长状态较好,菌株TOB1的生长状态明显高于菌株TOB2。
2.4 菌株种属鉴定
染色后在油镜下的观察结果(图4)显示,菌株TOB1和TOB2都呈现红色,均为革兰氏阴性菌。其中TOB1为短粗的杆状菌,排列成链状,TOB2为直形的杆状菌。菌株TOB1和TOB2的生理生化鉴定结果如表1所示。
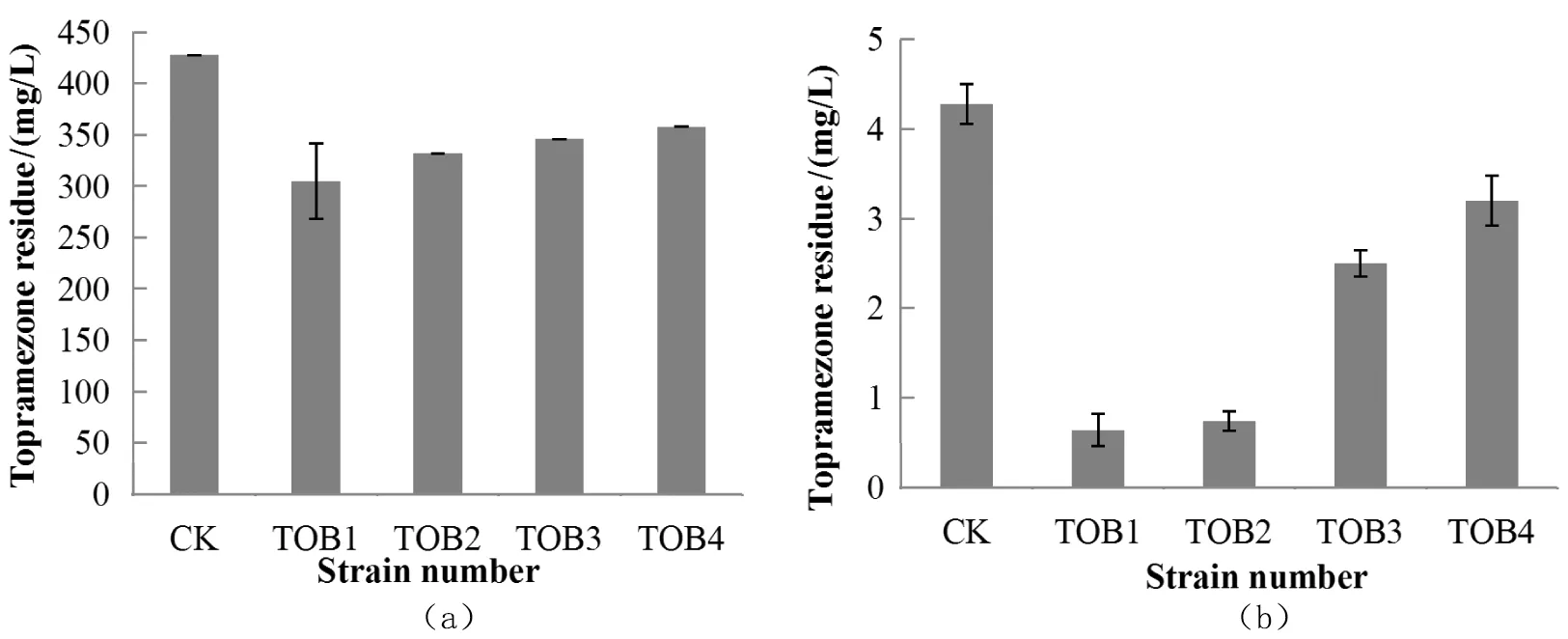
(a)经菌株处理后初始浓度为500 mg/L苯唑草酮的残留浓度;(b)经菌株处理后初始浓度为5 mg/L苯唑草酮的残留浓度
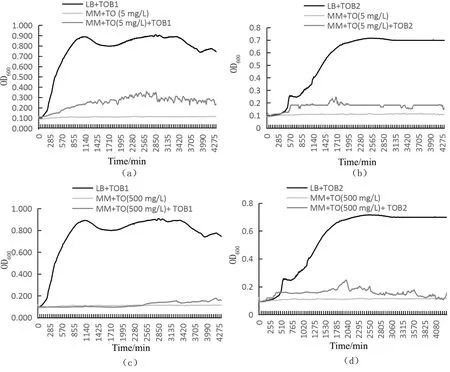
(a)菌株TOB1生长于MM+TO(5 mg/L);(b)菌株TOB2生长于MM+TO(5 mg/L);(c)菌株TOB1生长于MM+TO(500 mg/L);(d)菌株TOB2生长于MM+TO(500 mg/L)
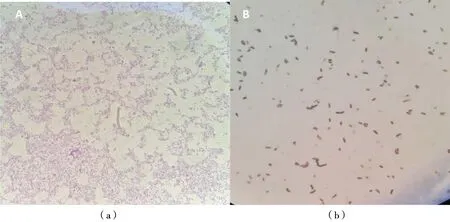
(a)TOB1;(b)TOB2
两株菌株16S rDNA片段PCR扩增电泳检测结果(图5)显示,两个菌株均产生了高亮的16S rDNA片段,其大小相近,约为1.5 kb。
菌株TOB1和TOB2经过16S rDNA测序后得到的核苷酸序列,通过对其进行BLAST比对后可以看出,菌株TOB1与不动杆菌属的16S rDNA序列相似性都超过了99%,菌株TOB2与假单胞菌属的16S rDNA序列相似性都超过了99%,提交至GenBank获得的登录号分别为MK719973和MK719974,结合形态、生理生化特征和系统发育树(图6),初步将TOB1鉴定为不动杆菌属(Acinetobactersp.),初步将TOB2鉴定为假单胞菌属(Pseudomonassp.)。
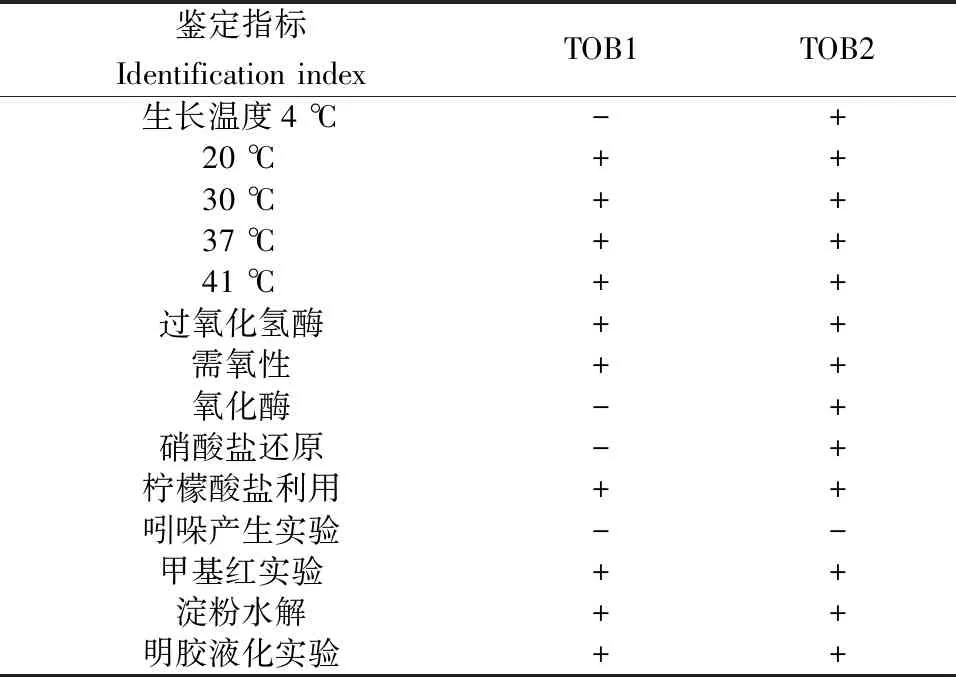
表1 菌株TOB1和TOB2的生理生化反应特征
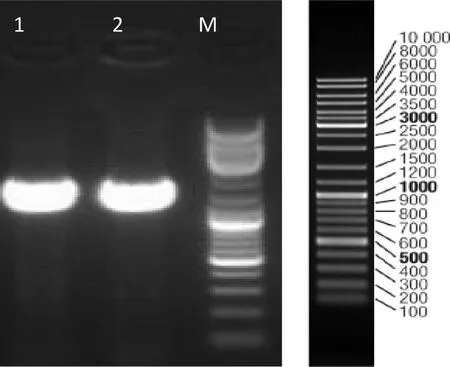
M:Marker DL10000

图6 菌株TOB1和 菌株TOB2的系统发育树
3 讨论与结论
目前,国内外主要侧重于苯唑草酮的杂草防效和毒理方面的研究,国内仅有吉林农业大学和浙江工业大学对苯唑草酮残留方面的相关报道:苯唑草酮的水解半衰期为354.1~807.0 d;光解的半衰期为24.1~64.7 h[11];冯义志等[12]研究表明,按27~40.5 g a.i./hm2用量,喷雾施药1次,收获期采样,玉米植株、青玉米和玉米中苯唑草酮残留量均低于0.01 mg/kg,土壤中苯唑草酮残留量均低于0.02 mg/kg。然而,针对苯唑草酮污染的土壤微生物修复,国内外尚鲜见报道。本研究从黑龙江省施用苯唑草酮玉米田土壤中驯化分离出两株对苯唑草酮有降解能力的菌株TOB1和TOB2。在7 d的时间内,相比于菌株TOB3和菌株TOB4,菌株TOB1和菌株TOB2降解率较高:对于质量浓度为500 mg/L的苯唑草酮,这两株菌的降解率分别为28.76%和22.43%;对于质量浓度为5 mg/L的苯唑草酮,这两株菌的降解率分别为85%和82.65%。但是,这两株菌都能够在含苯唑草酮的培养基中生长,在低质量浓度(5 mg/L)苯唑草酮溶液中比在高质量浓度(500 mg/L)中生长状态较好,菌株TOB1的生长状态好于菌株TOB2。
将菌株TOB1和菌株TOB2分别鉴定为Acinetobactersp.(不动杆菌属)和Pseudomonassp.(假单胞菌属)。关于不动杆菌属针对石油污染沉积物、含菲废水及多环芳烃污染土壤、石油烃等方面修复降解的报道[13-15]较多。郭火生[16]研究发现Acinetobactersp. DNS32菌株具有较好的降解能力,在阿特拉津质量浓度100 mg/L的培养液中,48 h的降解率可达97.63%,且在相对较低温度下也具有一定的降解能力。关于假单胞菌属针对应用百菌清污染的土壤,对染化废水中典型类持久性有机污染物以及对二氯喹啉酸危害烟草等方面生物的修复报道[17-19]已经很多,赵昕悦等[20]研究表明Pseudomonassp. ZXY-1在11 h内可完全降解初始质量浓度为100 mg/L的阿特拉津,降解效率为99%。本研究对质量浓度为500 mg/L的苯唑草酮降解效率不高(10%~15%),然而,对于质量浓度为5 mg/L的苯唑草酮降解效率很高(90%~99%)。本研究所筛选出这两个种属的细菌菌株对苯唑草酮的降解能力不如上述文献报道中其对阿特拉津的降解能力高,有可能是因为在中国阿特拉津的施用已经有近40年,土壤中微生物对其适应能力较强,而苯唑草酮是新兴起的除草剂,在中国刚刚上市3年,施用时间较短,土壤中微生物对其耐受能力较差,导致细菌对其降解能力和菌体生长状况较弱,不过不动杆菌属和假单胞菌对苯唑草酮的降解作用属首次报道,其对低质量浓度苯唑草酮残留的土壤修复有一定的研究价值与应用前景。今后将从菌株对作物的致病性以及微生物菌剂土壤修复方面开展研究,再进一步研究菌株对苯唑草酮的降解分子机理。
