轮状病毒VP3表达载体pEGFP-VP3的构建、表达及功能研究
2020-12-23林晓晨胡晓青李鸿钧
杜 静, 周 艳, 纳 璐, 林晓晨, 胡晓青, 汪 艺, 李鸿钧
(中国医学科学院 北京协和医学院 医学生物学研究所 云南省重大传染病疫苗研发重点实验室, 昆明 650118)
轮状病毒(Rotavirus, RV)是一种双链RNA病毒,常感染婴幼儿进而导致腹泻。调查数据显示,每年感染轮状病毒住院治疗的婴幼儿占35%至50%,导致全球约20万婴幼儿死亡[1]。轮状病毒感染引起的腹泻尚无特效药治疗。因此,研究轮状病毒致病机理具有重要意义。
轮状病毒属于呼肠病毒科,是一种无包膜的二十面体形状病毒,是一种由11个不连续节段组成的双链RNA病毒,编码6种结构蛋白(VP1-4、6、7)和6种非结构蛋白(NSP1-6)[2-5]。轮状病毒结构蛋白3(VP3),由长度为2 362个碱基的轮状病毒基因4(Rotavirus complete gene 4)编码,包含776个氨基酸,VP3蛋白分子大小98 ku[6]。VP3可以特异性结合GTP,是一种鸟苷酰转移酶[7]。RNA病毒已经进化出多种转录策略,其中许多涉及通过病毒加帽酶的活性向病毒mRNA的5′末端添加帽结构。添加甲基化帽结构可以帮助稳定病毒mRNA,增强其翻译,并防止细胞先天免疫传感器检测它们。轮状病毒VP3蛋白可以给病毒mRNA加帽,有助于对抗细胞固有的抗病毒防御[8]。除了其加帽活性外,VP3还可以作为毒力决定因子起作用。据报道,VP3的C末端结构域通过切割2′-5′-寡腺苷酸(2-5A)来拮抗干扰素诱导的寡腺苷酸合成酶(OAS)-RNase L途径。VP3可能通过拮抗RNase L或通过甲基化2′-O位置的病毒RNA来促进毒力[9-10]。因此,本文构建pEGPF-N2-VP3真核表达载体,并初步探讨VP3对RV复制的影响,旨在为后续更加深入地探究VP3的功能及在轮状病毒复制中的作用提供实验基础。
1 材料与方法
1.1 菌种和质粒
大肠杆菌(DH-5α);非洲绿猴胚胎肾上皮细胞系(MA104);轮状病毒 ZTR-68株 (G1P[8])、pEGFP-N2真核表达载体由本实验室保存。
1.2 主要试剂和仪器
MEM培养基(美国GIBCO公司);新生牛血清(北京民海生物科技有限公司);质粒小提试剂盒和胶回收试剂盒(Omega 公司);病毒核酸提取试剂盒、限制性核酸内切酶和T4连接酶(Thermo Fisher Scientific公司);One-Step RT-PCR 试剂盒(大连宝生物有限公司);one-step probe qRT-PCR试剂盒(北京TransGen Biotech公司)TRizol 和 Lipofectamine3000(Invitrogen 公司);鼠抗 β-actin 抗体(Origene公司);山羊抗RV(G1)抗体(本实验室保存);兔抗VP3(金斯瑞生物科技有限公司合成);HRP标记的山羊抗兔抗体(美国KPL 公司);HRP标记的山羊抗鼠抗体(美国Signalway Antibody公司);Cy-3标记的驴抗山羊抗体(美国Jackson Immune Research公司);引物(北京硕擎科技有限公司合成);探针(上海捷瑞公司合成);荧光定量PCR 仪CF96(Bio-Rad公司)。
1.3 引物设计
根据GenBank中的RV G1P[8]型VP3及载体pEGFP-N2的序列设计引物。P1:5′-CGGAATTCCGACCATGAAAGTATTAGCT-3′;P2:5′-GCGTCGACTCAC TCAGACATATCAAAT-3′(下划线部分分别为EcoR I和SalI酶切位点),引物由北京硕擎科技有限公司合成。
1.4 RV-VP3基因序列扩增
用病毒核酸提取试剂盒提取MA104细胞内RV总RNA。使用TaKaRa一步法试剂盒通过RT-PCR扩增出VP3基因。反应条件:50 ℃ 30 min;94 ℃预变性2 min;94 ℃ 变性30 s,58 ℃ 退火30 s,72 ℃ 延伸1 min,共35次循环;72 ℃ 再延伸10 min。扩增产物用1%琼脂糖凝胶电泳鉴定后,用胶回收试剂盒回收目的片段并测序鉴定。
1.5 重组真核表达载体pEGFP-N2-VP3的构建
将pEGFP-N2和VP3基因序列分别用EcoR I 和SalI进行双酶切。10 μL酶切体系:VP3基因序列/ pEGPF-N2空载质粒1 μg,EcoR I 和SalI各1 μL,10×buffer 1 μL,ddH2O补足10 μL。反应条件:37 ℃水浴15 min,1%琼脂糖电泳后切胶,用胶回收试剂和回收纯化VP3目的条带和pEGPF-N2载体,进行连接。20 μL连接体系:酶切目的片段(VP3)7 μL,酶切载体(pEGPF-N2)1 μL,T4 DNA ligase 1 μL,buffer 2 μL,ddH2O 补足20 μL。反应条件:16 ℃水浴过夜。连接产物转化至大肠埃希菌DH5α感受态细胞。将菌液涂布于含0.1% kan+的LB固体培养基上,37 ℃倒置过夜。次日挑取单克隆菌落至LB液体培养基(含0.1% kan+)扩大培养后,提取阳性克隆质粒。
1.6 重组质粒pEGPF-N2-VP3的初步鉴定
重组质粒用双酶切进行酶切鉴定,阳性质粒送硕擎测序,测序结果与VP3进行BLAST比对。
1.7 重组质粒pEGPF-N2-VP3转染MA104细胞及其表达
转染前一天接种合适密度的MA104细胞,于5% CO2培养箱中37 ℃培养约24 h。待细胞达到40%~60%汇合度时,用DMEM清洗细胞面2次,第3次换成opti-MEM。配制转染试剂(六孔板),Ⅰ液:质粒2.5 μg,P3000 5 μL,用opti-MEM补足125 μL;Ⅱ液lip3000 3.75 μL,opti-MEM 121.25 μL,将Ⅰ液与Ⅱ液1∶1混匀,室温10~20 min后,加入六孔板中250 μL/孔。转染6 h后,换成不含双抗的细胞培养液。分别于转染后12、24、48和72 h检测质粒表达情况。
Western Blot检测VP3蛋白的表达。取30 μg 蛋白经 12% SDS-PAGE 凝胶分离,40 V湿转2 h(4 ℃),5%脱脂奶粉封闭 1 h,TBST洗膜3次(15 min/次);加入兔抗VP3抗体(1∶1 000),4 ℃过夜;次日TBST 洗膜3次(15 min/次)后加入辣根过氧化物酶标记的山羊抗兔(1∶10 000)二抗室温孵育2 h,TBST洗膜3次后行ECL显色。
1.8 重组质粒pEGPF-N2-VP3对RV复制的影响
1.8.1 MA104细胞转染pEGPF-N2-VP3后RV拷贝数检测
pEGPF-N2-VP3转染MA104细胞24 h后,用轮状病毒ZTR-68感染细胞。24 h后将细胞取出,置于-20 ℃反复冻融3次;将病毒液4 ℃,8 000 r/min离心20 min后取上清提取病毒总RNA。用已知滴度(106.0PFU/mL)的RV标准株进行10倍梯度稀释至102.0PFU/mL,进行 one-step probe qRT-PCR,以标准毒株10为底的对数作为横坐标,cq值为纵坐标,绘制标准曲线。随后检测样品Cq值代入标准曲线,计算出样品中RV拷贝数。qRT-PCR反应体系为2×Supermix 10 μL;上下游引物(20 μmol/mL)0.4 μL;Enzyme Mix 0.4 μL;RNA样品500 ng; Probe (10 μmol/mL)0.4 μL;RNAase-free 水补至20 μL。反应程序为50 ℃ 10 min;94 ℃ 预变性30 s;94 ℃变性5 s,60 ℃ 退火30 s,循环45次。
1.8.2 MA104细胞转染pEGPF-N2-VP3后RV免疫荧光检测
pEGPF-N2-VP3转染MA104细胞24 h后,用轮状病毒ZTR-68株感染细胞。病毒感染24 h后从培养箱中取出细胞,PBS轻柔清洗细胞面1次,2%多聚甲醛4 ℃固定30 min(1 mL/孔);取已提前预冷的甲醇4 ℃固定15 min(1 mL/孔);PBS洗3次,每次5 min;2%BSA 37 ℃封闭45 min;PBS洗1次;加入山羊抗RV (1∶500稀释)抗体,37 ℃孵育1.5 h;PBST洗3次;加入Cy-3标记的驴抗山羊(1∶200稀释)二抗37 ℃孵育1 h;PBST洗3次后,DAPI(1∶1 000稀释)染细胞核10 min;PBST洗3次,封片后用倒置荧光显微镜观察。
1.8.3 观察GFP分布状态
MA104 细胞转染pEGFP-N2-NSP5 48 h后接种RV,并分别在接种病毒0、8、12和24 h后于倒置荧光显微镜下观察 GFP 的分布状态,以进一步确认重组蛋白VP3是否参与RV复制。
1.9 统计学方法
计量资料采用平均数±标准差(x±s)表示,采用SPSS 13.0 软件做t检验进行样本之间的两组间比较。P≤ 0.05表示差异具有统计学意义。
2 结果与分析
2.1 pEGPF-N2-VP3表达载体的构建和鉴定
PCR产物经 1.5%琼脂糖凝胶电泳后,可见1条大小与目的基因大小基本一致的片段,为1条695 bp的特异性片段。重组质粒 pEGPF-N2-VP3经EcoR I和SalI双酶切后得到约 4 795 bp和 695 bp的 2个条带(图 1)。经过测序Blast比对结果与VP3编码序列一致,表明重组质粒pEGPF-N2-VP3构建成功。将构建的真核表达质粒pEGPF-N2-VP3转染到MA104细胞中,分别于不同时段提取蛋白进行Western Blot检测。结果显示,48 h VP3蛋白表达最高(图2)。
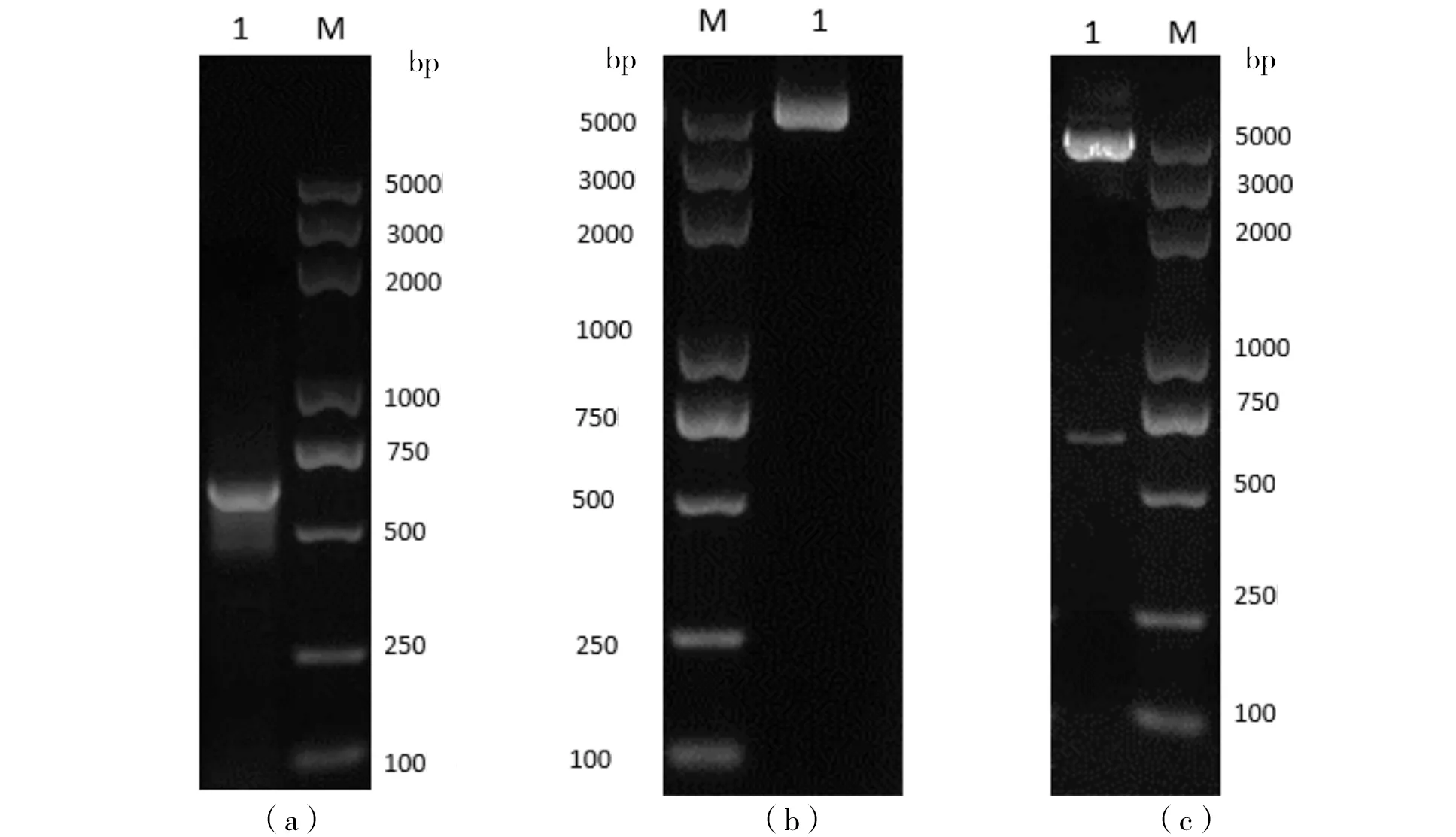
(a)Lane 1为RV-VP3基因扩增;(b)Lane 1为pEGPF-N2基因扩增;(c)Lane 1为pEGPF-N2-VP3双酶切鉴定
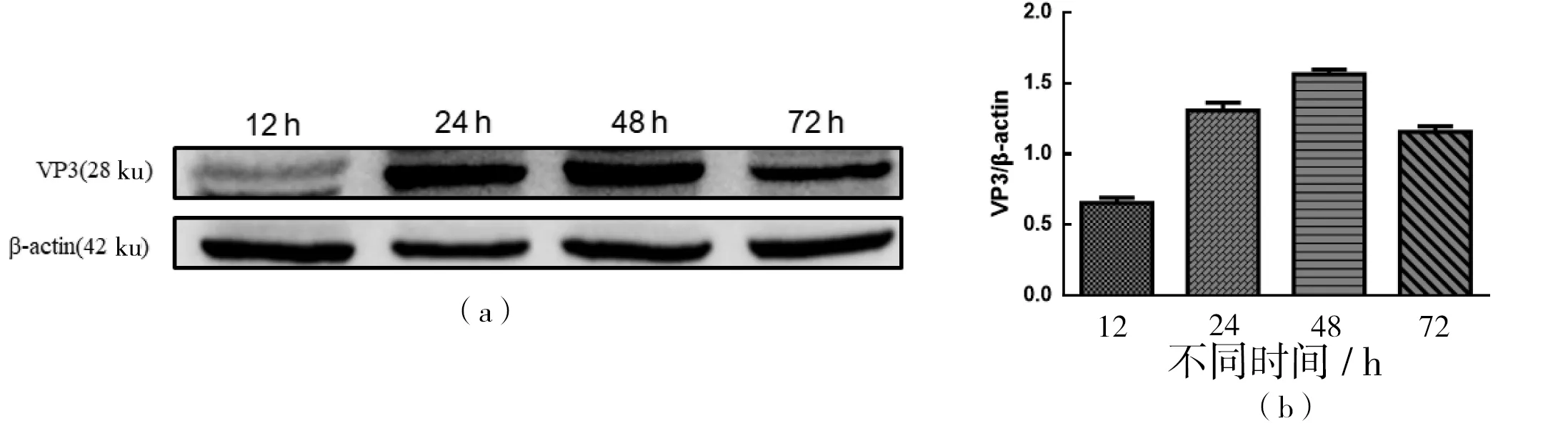
(a)pEGPF-N2-VP3转染MA104细胞不同时段重组蛋白VP3 Western Blot检测;(b)各条带灰度值
重组质粒pEGFP-N2-VP3 转染MA104 细胞后,分别于不同时段取出细胞,用倒置荧光显微镜观察GFP荧光在细胞内的分布及表达情况。结果显示, MA104细胞的胞质和胞核中均有pEGFP-N2-VP3分布。pEGFP-N2-VP3表达量初期随转染时间逐步增高,且在48 h达到高峰,随后表达下降(图3)。
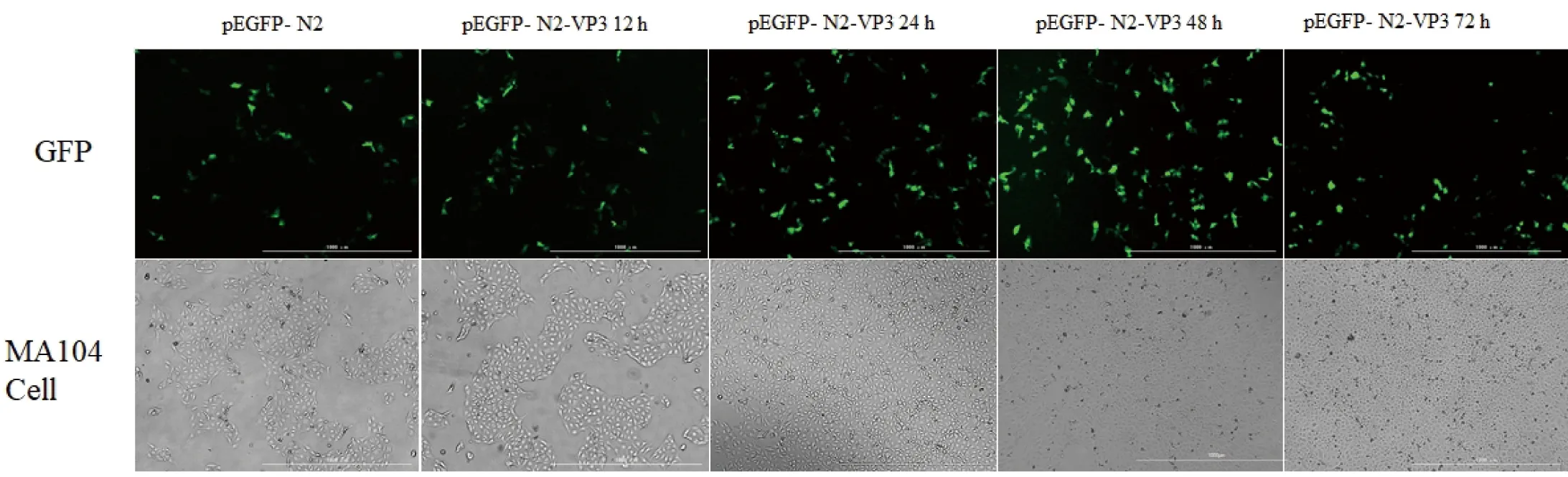
图3 pEGFP-N2-VP3 转染MA104 细胞不同时间GFP荧光结果(×200)
2.2 转染pEGPF-N2-VP3对RV复制的影响
MA104细胞经过不同处理后分成3组(转染pEGPF-N2-VP3;转染pEGPF-N2空载体;不转染),于转染24 h后感染等量RV(106.0PFU/mL),并于感染24 h收获病毒上清。用绝对定量法检测各组收获RV病毒液滴度。绘制标准曲线:y=-4.9202x+ 50.585;R2=0.9997,将3组收获的病毒液进行qRT-PCR检测,结果代入标准曲线计算出对应的病毒滴度。结果显示,转染pEGPF-N2-VP3组收获的RV病毒滴度显著高于转染pEGPF-N2空载体组及不转染的空白(Mock)组,而pEGPF-N2空载体组与Mock组并无显著差异,表明重组蛋白VP3可促进RV在宿主细胞内的复制(图4)。
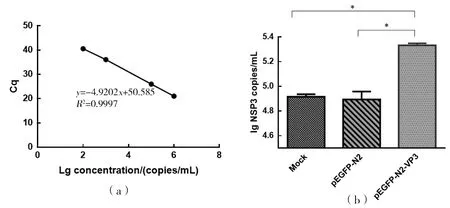
(a)RV G1标准株的qRT-PCR标准曲线; (b)pEGPF-N2-VP3转染MA104细胞24 h后接种RV并于24 h收获RV上清且根据标准曲线计算出RV滴度(*P≤0.01)
此外,免疫荧光能够更直观地反应重组蛋白VP3对RV复制的影响。3组不同处理的MA104细胞转染48 h后感染RV,并于感染病毒16 h检测RV在细胞内的复制情况。结果显示pEGPF-N2-VP3转染组RV阳性细胞数显著高于pEGPF-N2 空载体转染组和Mock(空白组)。结果进一步确认了pEGPF-N2-VP3能够促进RV在宿主细胞能的复制[图5(a)]。
MA104细胞转染pEGPF-N2-VP3后48 h接种RV,通过不同时间段GFP分布情况观察发现,在未接种RV的细胞中,GFP呈现弥散均匀地分布,但当感染RV后,随着感染时间的增加GFP在细胞内逐渐形成越来越紧密的点状样聚集。图5(b)表明了重组蛋白VP3能够参与RV复制过程,且对RV复制具有促进作用。

(a)免疫荧光检测N2-VP3转染MA104细胞48 h后RV复制情况;(b)RV阳性细胞计数(×200);(c)接种RV后0、8、12和24 h的GFP分布情况(×400)。*P≤0.01
3 讨论与结论
轮状病毒(Rotavirus)是引起婴幼儿严重腹泻的主要病原体,每年在全球范围内造成了严重的经济损失,尤其在中非、南亚等发展中国家[11]。固有免疫反应是宿主细胞抵抗病毒感染的第一道防线。通过寡腺苷酸合成酶(OAS)合成2′-5′-寡腺苷酸(2-5A)是一种重要的先天细胞反应,其通过激活潜在的细胞RNase、RNase L来降解单链RNA来限制病毒复制。在宿主细胞与病毒的这场博弈中,研究表明轮状病毒已经进化出多种策略来隐藏和直接拮抗宿主先天免疫系统[12]。这些途径之一是2′-5′-寡腺苷酸合成酶(OAS)/ RNase L途径。 OAS被双链RNA(dsRNA)激活,产生2′-5′寡腺苷酸,它们是RNase L的激活剂;这种酶降解病毒和细胞RNA,限制病毒感染。最近发现轮状病毒VP3的羧基末端结构域(CTD)具有2′-5′-磷酸二酯酶(PDE)活性,其能够在功能上代替小鼠肝炎病毒ns2蛋白的PDE活性。这种特定的磷酸二酯酶切割寡腺苷酸的2′-5′-磷酸二酯键,拮抗OAS/RNase L途径[13-16]。然而,在轮状病毒的复制周期中VP3的这种活性是否相关尚不清楚。因此,深入探究VP3的功能及在轮状病毒复制中的作用具有重要意义,且为后续研究RV的抗病毒机制提供理论依据。VP3基因全长为2 508 bp,由于构建和表达全长的VP3基因存在困难,本研究选择最长开放阅读框(Open reading frame, ORF)进行构建和表达。
本研究旨在通过构建RV-VP3基因真核表达载体,转染使其在MA104细胞中过表达,观察过表达VP3对轮状病毒复制的影响。首先利用基因重组技术将RV-VP3插入质粒pEGPF-N2中,发现转染后48 h重组蛋白表达最高。然后于转染48 h后感染病毒,通过免疫荧光和拷贝数检测通过外源载体过表达VP3对轮状病毒复制的影响,结果均显示重组蛋白VP3可促进病毒复制。当轮状病毒感染宿主细胞时,宿主启动自噬病毒复制位点形成,荧光观察呈现颗粒状小点[17-18]。观察发现当RV感染宿主细胞时,细胞内表达的GFP荧光从最初的弥散分布状态变为点状聚集,进一步直观说明重组蛋白VP3成功表达并参与RV复制。
因此,本研究成功构建了VP3真核表达载体,使其在MA104细胞中过表达,并发现了pEGFP-N2-VP3重组质粒能够参与促进RV复制,为后续更加深入探究VP3的功能及轮状病毒的调控机制奠定了基础。
