自噬对粒细胞样髓源性抑制细胞生存与功能的影响
2020-12-23郭红叶朱栋炜芮棵田洁王胜军
郭红叶,朱栋炜,芮棵,田洁,王胜军
(1.江苏大学医学院,江苏 镇江 212013;2.江苏大学附属医院检验科,江苏 镇江 212001)
在机体免疫系统内,髓系细胞是造血细胞中最丰富的类型,在多种生理和病理情况下发挥作用[1]。正常的情况下,造血干细胞分化为髓系前体细胞然后进一步分化为未成熟髓系细胞(不具备免疫抑制功能),这群细胞会迁移到不同外周器官后进行分化。然而,在急慢性感染、创伤、败血症以及在肿瘤微环境下,这群未成熟髓系细胞在局部大量聚集,正常途径的成熟分化过程发生阻滞,并发生活化,成为了一群具有免疫抑制功能的髓源性抑制细胞(myeloid derived suppressor cells,MDSCs),其在许多病理条件下发挥免疫调节功能[2]。MDSCs由两大类细胞组成:粒细胞样MDSCs(granulocytic MDSCs,G-MDSCs)和单核细胞样MDSCs(monocytic MDSCs,M-MDSCs)。在形态上,G-MDSCs与中性粒细胞相似,而M-MDSCs则像单核细胞[1];在表型上,小鼠体内总MDSCs的表型为CD11b+Gr-1+,G-MDSCs表型为CD11b+Ly-6G+Ly-6Clow,M-MDSCs表型为CD11b+Ly-6GlowLy-6Chigh[3]。
在病理情况下,髓样细胞前体中的可溶性肿瘤坏死因子通过结合肿瘤坏死因子受体1激活STAT3信号通路,导致正常髓系前体增殖并分化为MDSCs[4]。MDSCs是肿瘤微环境中重要的组成部分,可以通过介导免疫抑制来促进肿瘤的发展[5]。MDSCs可以促进调节性T细胞的形成[5],然而调节性T细胞是适应性免疫应答的重要参与者,能够促进免疫耐受;MDSCs通常分化为免疫抑制性肿瘤相关巨噬细胞[6],并且可以促进成纤维细胞分化为癌症相关成纤维细胞[7]。MDSCs不仅参与调控肿瘤免疫应答,还可以通过促进肿瘤血管生成、肿瘤细胞侵袭以及转移前微环境的形成来促进肿瘤发展[8]。
肿瘤晚期患者体内大量存在的MDSCs,往往意味着较差的生存率[9]。自噬途径是在缺氧条件下诱导的,然而缺氧是大多数肿瘤的主要特征,在肿瘤的发展、转移和对治疗的反应中发挥重要作用[10]。自噬是细胞内一种保守的自降解系统,属于溶酶体分解代谢途径[11],参与胞质中长寿命蛋白、蛋白聚集物以及受损伤细胞器降解后再循环利用,在维持组织、器官稳定性及抗肿瘤免疫中发挥至关重要的作用[12]。
虽然大多数研究集中于自噬在肿瘤细胞中的作用[13],但是在肿瘤微环境中自噬如何影响免疫应答特别是MDSCs的作用仍需要进一步的探讨。有研究间接表明自噬在调节MDSCs功能方面发挥重要作用,能够调节缺氧诱导因子1α促进MDSCs向肿瘤相关巨噬细胞分化[14-16]。本研究拟通过检测自噬对小鼠G-MDSCs存活以及功能的影响,初步探讨自噬是否为影响G-MDSCs在肿瘤中大量聚集的原因之一,为临床上针对免疫抑制细胞的免疫疗法提供一定的理论依据。
1 材料与方法
1.1 主要材料
雄性,6~8周龄,体重(20±2)g,SPF级C57BL/6小鼠20只购自扬州大学比较医学动物中心。Lewis肺癌细胞系为本课题组保存;髓源性抑制细胞分离试剂盒(德国Miltenyi Biotec公司);PE标记抗小鼠Ly-6G抗体、FITC标记抗小鼠Ly-6C抗体、PE/Cy5标记抗小鼠CD11b抗体(美国Biolegend公司);LC3B抗体(美国CST公司);雷帕霉素、氯喹、3-甲基腺嘌呤(美国Sigma公司);FlowCellectTM自噬LC3抗体检测试剂盒(德国MERK公司);QuantiChromTM精氨酸酶测定试剂盒(美国BioAssay Systems公司)。
1.2 模型构建、细胞分离
小鼠Lewis肺癌细胞系用含10%小牛血清DMEM培养,皮下注射至C57BL/6小鼠。移植后第30 d摘取脾脏,获得的细胞悬液4℃、500×g离心5 min,弃上清液;加5 mL ACK红细胞裂解液,静置5 min;加RPMI 1640培养液,混匀,500×g离心5 min,弃上清液;计数。加PBE缓冲液(PBS中加入EDTA和小牛血清)后加入FcR封闭液,冰上孵育10 min;加入抗-Ly-6G生物素孵育30 min;加PBE,离心5 min,弃上清液;加抗-Ly-6G-生物素磁珠,30 min;加入PBE,4 ℃、500×g离心5 min,弃上清液;加入500 μL PBE,将分选柱置于分选器上,加入细胞悬液用PBE洗涤3次;将分选柱悬于离心管中,加入PBE,推动柱栓得到细胞悬液,即G-MDSCs。
1.3 G-MDSCs纯度鉴定
收集1×106个G-MDSCs于EP管中,加1 mL PBS将细胞重悬,离心5 min,弃部分上清液后余约100 μL;重悬后加抗Ly-6G、抗Ly-6C、抗CD11b,4 ℃孵育30 min;加1 mL PBS,4 ℃、500×g离心5 min,弃上清液。加200 μL PBS重悬,上机检测。
1.4 G-MDSCs形态鉴定
将1×106个G-MDSCs细胞悬液加入到1.5 mL EP管中,加入PBS,混匀,4℃、500×g离心5 min,弃掉部分上清液后余大约100 μL,混匀细胞;取10 μL涂片,待涂片自然干燥,滴加试剂A(瑞氏-吉姆萨复合染液),室温放置,染色1~2 min;加入等量的试剂B(PBS),混匀,室温静置3~10 min。流水冲洗,至液体无色,大约30 s。干燥后,先低倍镜观察,然后油镜下观察并拍照保存。
1.5 蛋白质印迹法检测雷帕霉素对G-MDSCs自噬的影响
1.5.1 细胞培养 将含有G-MDSCs的细胞悬液加入24孔板中,每孔细胞数为2×106个,在含有10%胎牛血清的RPMI 1640培养液中进行培养,体系为1 mL,加入1 μL氯喹(原液10 mmol/L,终浓度10 μmol/L)作为对照组。在上述体系中加入20 μL雷帕霉素(原液500 nmol/L,终浓度10 nmol/L)作为雷帕霉素处理组。培养12 h,4℃、500×g离心5 min,弃上清液。
1.5.2 蛋白提取 加入1 mL PBS,离心5 min,弃上清液。细胞沉淀中加50 μL RIPA,每10 min振荡1次,每次2 min,共3次;4 ℃、14 000×g离心5 min,收集上清液,测定蛋白浓度。加入5×上样缓冲液于样品中,沸水浴10 min后置冰上。14 000×g离心10 min,收集上清液备用。
1.5.3 蛋白电泳及显色 配制浓缩胶(5%)和分离胶(12%),每个上样孔加80 μg蛋白样品。80 V电泳,待溴酚蓝染料进入分离胶时,电压调为100 V继续电泳至结束,取出胶,浸泡在转膜缓冲液中。确定目的蛋白的大致位置,组装电转移装置,350 mA、2 h后关闭电源,取出PVDF膜。室温下封闭1 h,加入稀释抗β-肌动蛋白抗体(1 ∶3 000)、抗LC3B抗体(1 ∶1 000),将PVDF膜浸在一抗中4 ℃孵育过夜,将PVDF膜用1×TBST洗涤3次。加入羊抗鼠HRP-IgG抗体(1 ∶5 000)、羊抗兔HRP-IgG抗体(1 ∶8 000),室温孵育1 h。取出PVDF膜,1×TBST洗涤3次。显色,凝胶成像系统及分析仪扫描保存图像。
1.6 流式细胞术检测雷帕霉素对G-MDSCs自噬的影响
1.6.1 细胞培养 G-MDSCs处理方法同“1.5.1”。
1.6.2 荧光抗体标记及检测 加入1 mL PBS重悬细胞,4℃、500×g离心5 min,弃上清液。加100 μL 1×自噬试剂A,4 ℃、500×g离心5 min,弃上清液。加100 μL 1×自噬试剂B,4 ℃、500×g离心5 min,弃上清液。加95 μL分析缓冲液和5 μL 20×抗LC3/FITC抗体,避光孵育30 min。加500 μL分析缓冲液,4℃、500×g离心5 min,弃上清液。加200 μL分析缓冲液重悬,上机检测。
1.7 流式细胞术检测自噬对G-MDSCs存活的影响
1.7.1 细胞培养 将G-MDSCs加入24孔板中,每孔2×106个细胞,在含有10%胎牛血清的RPMI 1640培养液中培养,体系为1 mL,加入10 μL雷帕霉素(原液1 μmol/L,终浓度10 nmol/L),此为雷帕霉素组;另一组加入雷帕霉素,同时加入3-甲基腺嘌呤(3-MA,原液200 mmol/L,终浓度5 mmol/L),此为雷帕霉素+3-MA组。培养12 h,混匀,将细胞加入到1.5 mL EP管中,4 ℃、500×g离心5 min,弃上清液。
1.7.2 标记及检测 加入1 mL PBS后混匀细胞,4℃、500×g离心5 min,弃上清液。加入500 μL结合缓冲液和2 μL 7-AAD,室温避光孵育10 min,上机检测。
1.8 ELISA检测自噬对G-MDSCs效应分子精氨酸酶的影响
1.8.1 细胞培养 G-MDSC处理方法同“1.7.1”。
1.8.2 检测与计算 加入哺乳动物蛋白抽提试剂,4 ℃、14 000×g离心10 min,取上清液。按照说明书加样后37 ℃孵育1.5 h。每孔加200 μL尿素制剂,加入10 μL 5×底物缓冲液到样本空白孔中,室温避光下放置15 min,选择波长520 nm测各个样本光密度(D)值;根据说明书计算精氨酸酶活性。
1.9 统计学处理

2 结果
2.1 G-MDSCs纯度的鉴定
分离纯化G-MDSCs细胞,小鼠体内G-MDSCs表型为CD11b+Ly-6G+Ly-6Clow,对细胞进行荧光抗体染色标记后通过流式细胞术检测磁珠分选获得的G-MDSCs纯度,结果显示G-MDSCs纯度达95%以上(图1)。
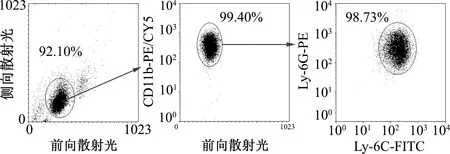
图1 流式细胞术分析G-MDSCs的细胞纯度
2.2 G-MDSCs形态的鉴定
获得G-MDSCs之后,采用瑞士-吉姆萨染色对其形态进行鉴定(图2)。结果显示涂片染色良好,细胞完整,细胞核呈环状或分叶状,与文献中所描述的G-MDSCs形态一致[3]。
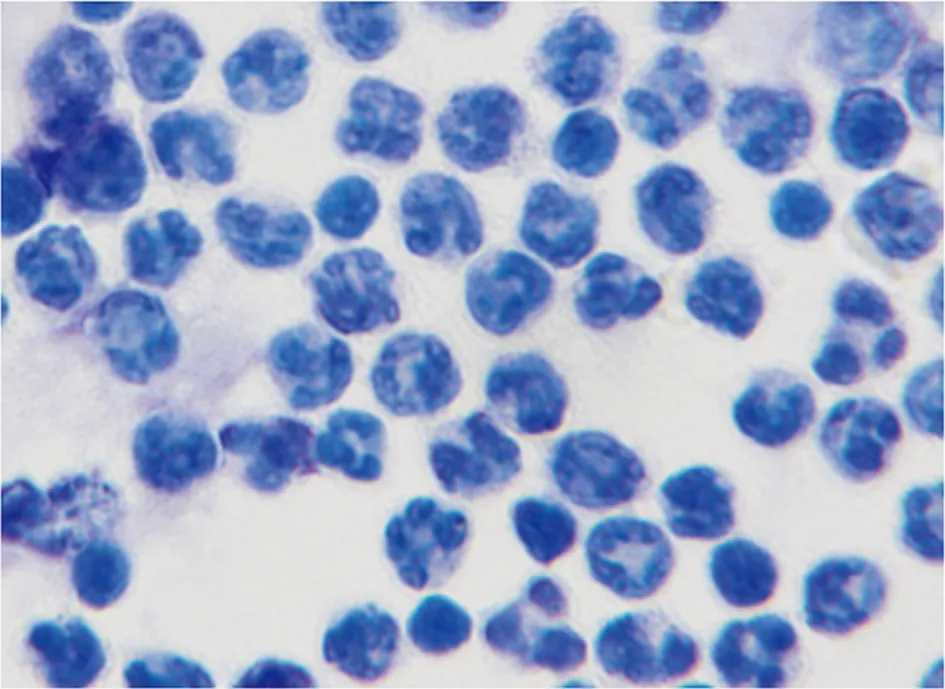
图2 油镜下G-MDSCs的细胞形态(瑞吉染色,×1 000)
2.3 雷帕霉素促进G-MDSCs自噬
对获得的G-MDSCs纯度和形态鉴定后,在体外,首先观察雷帕霉素这种常用的自噬诱导剂是否能诱导G-MDSCs发生自噬。结果显示,与对照组相比,雷帕霉素处理组LC3-Ⅱ的水平显著升高而LC3-Ⅰ水平降低,表明大量LC3-Ⅰ转变为LC3-Ⅱ,提示雷帕霉素上调了G-MDSCs自噬的水平(图3)。
为了进一步验证雷帕霉素对G-MDSCs细胞自噬的作用,采用流式细胞术检测细胞内LC3-Ⅱ。结果显示,雷帕霉素处理后,增强了细胞内LC3-Ⅱ的荧光强度,表明雷帕霉素上调了G-MDSCs自噬的水平(图3)。
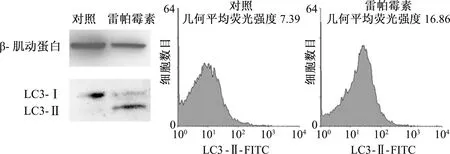
图3 雷帕霉素对G-MDSCs自噬的影响
2.4 自噬有利于G-MDSCs存活
加入自噬抑制剂3-MA后,观察自噬对G-MDSCs体外存活的影响。结果显示,处理细胞12 h后,雷帕霉素+3-MA组与雷帕霉素组相比,活细胞比例明显降低(t=3.075,P<0.05),表明自噬对G-MDSCs体外存活发挥了一定的促进作用。见图4。
2.5 自噬上调G-MDSCs 中精氨酸酶的活性
结果显示,处理细胞12 h后,雷帕霉素+3-MA组精氨酸酶活性(6.967±0.848)U/106个细胞与雷帕霉素组(11.250±0.635)U/106个细胞相比显著降低(t=4.046,P<0.05),提示抑制细胞内自噬水平后,细胞免疫抑制功能有所下降,这很可能将利于机体更好地与肿瘤细胞进行对抗。
3 讨论
自噬发生的标志分子LC3存在两种形式,即LC3-Ⅰ和LC3-Ⅱ。细胞中的LC3蛋白合成后在Atg4蛋白酶的作用下形成LC3-Ⅰ。当细胞内发生自噬时,自噬小体分隔膜开始形成,可溶性的LC3-Ⅰ分子与磷脂酰乙醇胺结合形成LC3-Ⅱ,并且始终定位于自噬小体的外膜和内膜上直至与溶酶体融合。在本研究中,在对细胞体外培养时加入氯喹以抑制自噬小体与溶酶体融合,使得自噬小体无法降解,从而保留了LC3-Ⅱ,作为自噬小体的标记,利于结果观察并判断细胞内生成自噬小体的水平,来反映发生自噬的水平;在采用流式细胞术展开实验时,由于在培养时也加入了氯喹,自噬小体以及内容物无法降解,并且通过自噬试剂B作用后,使得染色过的细胞内只保留了存在于自噬小体膜上的LC3-Ⅱ,这样就可以通过LC3-Ⅱ-FITC的荧光强度的变化来分析判断细胞内自噬发生的水平。
很多研究已经证实肿瘤发生时,机体内会有大量的MDSCs聚集,然而对于其数量增多的原因,绝大多数研究的关注点在MDSCs的增殖和分化方面。为了探究细胞自噬是否参与了肿瘤患者体内MDSCs大量聚集,首先需要解决的问题就是如何检测G-MDSCs这群特殊的免疫抑制性细胞其细胞内自噬水平。有研究表明,荷瘤小鼠来源的M-MDSCs胞内mTOR通路下调[17]。所以本研究选择了通过下调mTOR通路来上调细胞自噬的雷帕霉素,这种常用来在其他细胞中诱导自噬的诱导剂开展研究。结果显示,检测细胞自噬的两种经典方法(蛋白质印迹法和流式细胞术)都可以用来反映这一特殊细胞群体的自噬水平,并且在培养体系中加入自噬抑制剂后,活细胞比例降低,同时细胞内效应分子精氨酸酶水平下调。精氨酸酶是MDSCs用来抑制T细胞活化和功能的经典分子之一,能够大量消耗精氨酸,然而精氨酸是T细胞活化和发挥免疫功能所必需的氨基酸,G-MDSCs细胞内高表达的精氨酸酶将环境中的精氨酸耗竭后,导致T细胞无法活化,从而抗肿瘤活性下降[18]。本研究结果表明,自噬不仅有利于G-MDSCs细胞体外存活,还可能通过上调效应分子精氨酸酶来抑制T细胞功能,从而提示自噬参与了MDSCs促进肿瘤发展的这一过程。由此表明,可以通过调控细胞自噬减少肿瘤患者体内这群发挥抑制肿瘤免疫的细胞,进而促进机体抗肿瘤免疫,提高免疫治疗的效果。尽管很多研究均表明可能自噬与MDSCs功能的相关,但是该途径的直接作用以及与自噬在MDSCs介导的抗肿瘤抑制中发挥作用的具体分子机制并不十分明确,需要进一步研究。
MDSCs于2007年首次被描述为新的治疗药物[3],直到2016年,人们才意识到MDSCs在免疫疗法中的重要作用[3],学者开始研究消除MDSCs的方法。这种消除MDSCs的免疫治疗手段已经在患者身上发挥一定疗效[19]。
多种病理条件下,MDSCs在负向调节免疫应答中发挥重要作用。与调节性T细胞不同,MDSCs在机体的生理条件下并不存在,这有可能靶向这群细胞进行治疗的同时避免一些不良反应。对调控MDSCs聚集以及功能的机制进行深入研究,可以促进更加精确地进行靶向治疗。自噬很可能是一个很好的减少MDSCs聚集的切入点,随着对这个领域研究的不断深入,作为一种潜在的新的细胞治疗手段,MDSCs在肿瘤以及免疫相关疾病治疗中将会得到越来越广泛的应用。
