ACSS2通过PI3K/AKT信号通路调控食管鳞癌细胞的顺铂敏感性
2020-12-23高星宇王景芝凌锐周月鹏毛朝明陈德玉
高星宇,王景芝,凌锐,周月鹏,毛朝明,陈德玉
(江苏大学附属医院 1.肿瘤治疗中心;2.肿瘤学实验室;3.核医学科,江苏 镇江 212001)
乙酸盐或乙酸对维持哺乳动物体内能量平衡起着重要作用[1]。最新研究表明,在应激条件下如低糖、营养受限等,游离乙酸盐可以作为肿瘤细胞脂肪生成、能量代谢的重要碳源,其中乙酰辅酶A合成酶2(acetyl-CoA synthetase 2,ACSS2)发挥着关键枢纽作用[2]。目前已在膀胱癌[3]、肾癌[4]、乳腺癌[5]、肝癌[6]等肿瘤发现,ACSS2参与肿瘤浸润、侵袭、转移等恶性进程,其异常表达常提示着不良预后。本研究以食管鳞癌(esophageal squamous cell carcinoma,ESCC)组织样本及细胞株作为研究对象,结合顺铂处理并通过靶向调控ACSS2蛋白表达,探究ACSS2在顺铂敏感性调控过程中的关键作用。
1 材料与方法
1.1 主要材料
1.1.1 组织标本、细胞株 选取2017年4月至2019年2月间于江苏大学附属医院外科住院的40例食管鳞癌患者,于手术中收集每位患者的食管鳞癌瘤体及癌旁组织(距瘤体边缘2~3 cm左右)标本,均为初诊同时术前未接受任何肿瘤治疗,所有样本经病理科确诊并得到江苏大学附属医院伦理委员会批准。
食管鳞癌细胞株TE-1、ECA-109 及KYSE-150(上海吉凯基因技术公司),正常食管鳞状上皮细胞Het-1A(广州吉尼欧生物科技有限公司)。
1.1.2 主要试剂 ACSS2抗体(美国Santa Cruz 公司);p-PI3K、AKT/p-AKT、p-mTOR、p-Erk、cleaved-Caspase-3以及β-肌动蛋白单克隆抗体(美国Cell Signaling公司);顺铂(Cisplatin,DPP)购自美国Selleck公司;PI3K通路抑制剂LY290042(美国Med Chem Express公司);HRP标记的抗鼠或抗兔二抗(武汉三鹰生物技术有限公司);脂质体Lipofectamine 2000(美国Invitrogen公司);CCK8以及Annexin-V/PI凋亡试剂盒(杭州联科生物技术有限公司);siRNA-ACSS2和siRNA阴性对照,阴性对照病毒CON238及过表达ACSS2慢病毒LV-ACSS2(上海吉凯基因技术公司)。
1.2 免疫组化检测食管鳞癌及癌旁组织中ACSS2的表达
组织样本经4%多聚甲醛固定后以石蜡进行包埋,连续切片(厚度4 μm),切片经脱蜡水化以3%过氧化氢孵育,PBS冲洗并抗原修复后置于含ACSS2抗体稀释液(1 ∶200)中,于4 ℃冰箱中浸染过夜,次日冲洗3次后加入对应二抗工作液结合,再次清洗后DAB显色封片观察。肿瘤组织及癌旁组织样本均以200倍镜下随机选取5个视野进行免疫组化评分,其中ACSS2表达强度分为:阴性为0分,弱阳性为1分,阳性为2分,强阳性为3分;表达程度评分标准如下:<25%者为0分,<50%但≥25%者为1分,≥50%同时<75%者为2分,≥75%者为3分。上述两项得分相乘计为总得分:0分记为“-”,1~5分记为“+”,6~9分记为“++”。
1.3 细胞培养以及脂质体、慢病毒转染
食管鳞癌细胞株TE-1、ECA-109 及KYSE-150培养于含10%胎牛血清、1%青霉素和1%链霉素混合的RPMI-1640培养基,正常食管鳞状上皮细胞Het-1A培养于含10%胎牛血清、1%青霉素和1%链霉素混合的DMEM培养基,均在37℃ 、5% CO2的细胞培养箱中培养。取对数生长期细胞,以(3~4)×104个/mL密度接种于6孔板中,并将其随机分为3组:siRNA-ACSS2组(siRNA-ACSS2转染),siRNA-NC组(siRNA阴性对照)及对照组(未做任何处理)。依照Lipofectamine 2000试剂说明转染上述不同组细胞,无血清培养基内转染6 h后更换为含血清培养基继续培养,再行收集细胞进行后续的实验。序列如下,siRNA-ACSS2-1:正义链5′-CAUCUGUCAUCAGUCACCUTT-3′;反义链5′-AGGUGACUGA-UGACAGAUGTT-3′;siRNA-ACSS2-2:正义链5′-CAGGAUGGCUAUUACUGGATT-3′;反义链5′-UCCAGUAAUAGCCAUCCUGTT-3′;siRNA-ACSS2-3:正义链5′-CGGGAUCGUUUGCAAGUAATT-3′;反义链5′-UUACUUGCAAACGAUCCCGTT-3′;siRNA-NC:正义链5′-UUCUCCGAACGUGUCACGUTT-3′;反义链5′-ACGUGACACGUUCGGAGAATT-3′。阴性对照病毒CON238及LV-ACSS2感染72 h后利用含嘌呤霉素培养基(4 μg/mL)筛选出转染细胞并运用免疫印迹实验验证过表达效果。
1.4 蛋白质印迹检测食管鳞癌组织及细胞中ACSS2蛋白的表达
食管鳞癌及癌旁组织蛋白提取需先去除坏死等组织,以每50 mg组织取500 μL的比例加入含蛋白酶抑制剂的RIPA细胞裂解液,玻璃研磨棒冰上研磨10 min;细胞蛋白(食管鳞癌细胞株TE-1、ECA-109 及KYSE-150,正常食管鳞状上皮细胞Het-1A)以6孔板为例:细胞经PBS清洗3次后加入100 μL裂解液冰上处理10 min,收集后4℃条件下12 000×g离心10 min,经BCA法测定蛋白含量后加入上样缓冲液,100 ℃下热变性10 min。根据目的蛋白分子大小于10%~12%的SDS-PAGE凝胶电泳后,将蛋白电转移至PVDF膜上,用含5%牛血清白蛋白的TBST于37 ℃水浴摇床上封闭60 min,加入稀释好的一抗ACSS2(1 ∶2 000配置),4 ℃冰箱孵育过夜。次日TBST 洗3次,每次10 min;抗鼠二抗室温孵育60 min后,TBST 再次清洗3次,每次10 min,最后加入曝光液显影、拍摄、计算灰度值。
1.5 CCK8实验检测ACSS2干扰对TE-1细胞顺铂IC50值的影响
将TE-1细胞设置为4组:未处理(空白对照)组,siRNA-NC组(阴性对照组),siRNA-ACSS2-1组和siRNA-ACSS2-3组。于96孔板中种植5×103个细胞/孔,待细胞贴壁后分别进行siRNA处理24 h,每组处理设6个平行孔。顺铂按浓度梯度(3.125、6.25、12.5、25、50 μg/mL)加入处理 24 h,并于实验终止前每孔加10 μL的CCK8,振荡、孵育2 h后在酶联检测仪上检测 450 nm 波长下每孔光密度(D)值,按公式(实验组D值/空白孔D值)×100%求出细胞活力值,根据细胞活力值拟合函数曲线计算IC50值。
1.6 流式细胞术检测下调ACSS2对TE-1细胞凋亡的影响
TE-1细胞种于6孔板,设置为6组:阴性对照组,顺铂(5 μg/mL)组,siRNA-ACSS2-1组,siRNA-ACSS2-3组,siRNA-ACSS2-1+顺铂组,siRNA-ACSS2-3+顺铂组。待细胞贴壁后行siRNA-ACSS2、siRNA-NC处理48 h,顺铂(5 μg/mL)单独处理24 h或者siRNA-ACSS2处理24 h后联合顺铂(5 μg/mL)处理24 h。随后,细胞经消化离心后用4℃预冷的PBS洗3次,每孔细胞收集于流式管内用500 μL缓冲液重悬,每管避光加入5 μL的Annexin V-FITC,上机前15 min加入5 μL碘化丙啶后检测凋亡水平。
1.7 蛋白质印迹检测PI3K/AKT信号通路及cleaved-Caspase-3蛋白的表达
TE-1细胞种于6孔板,设置为6组:阴性对照组,siRNA-ACSS2-3组,LV-ACSS2组,顺铂组,siRNA-ACSS2-3+顺铂组与LV-ACSS2+顺铂组。细胞蛋白提取、浓度测定等步骤同“1.4”。加入稀释好的一抗p-mTOR、p-Erk1/2、p-PI3K、AKT/p-AKT、cleaved-Caspase-3(均按1 ∶1 000配置),孵育、清洗后抗鼠或抗兔二抗再次孵育后,经曝光、拍摄并根据灰度值计算各蛋白表达量。
1.8 统计学分析

2 结果
2.1 ACSS2在食管鳞癌及癌旁组织中的表达
免疫组化可见,食管鳞癌细胞胞质中ACSS2多呈阳性或强阳性;癌旁组织中除基底、固有腺区域内细胞中有较高的ACSS2表达外,整体表达强度均较低(图1)。统计结果显示,食管鳞癌组织中ACSS2表达总得分++、+的比例分别为47.5%(19/40)和50%(20/40),癌旁组织中++、+的比例分别是22.5%(9/40)和37.5%(15/40),两组间差异有统计学意义(Z=-3.79,P<0.001,表1)。蛋白质印迹结果证实,食管鳞癌瘤体中ACSS2蛋白表达水平显著高于癌旁组织(Z=6.668,P<0.001,图2)。

图1 食管鳞癌及癌旁组织中ACSS2的表达(免疫组化,×200)
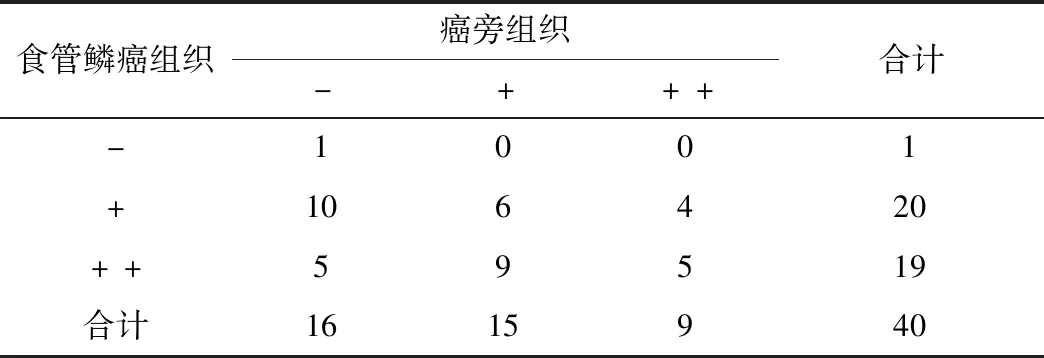
表1 食管鳞癌及癌旁组织中ACSS2表达总得分结果

N1-N3:癌旁组织;T1-T3:食管鳞癌组织图2 蛋白质印迹检测食管鳞癌组织中ACSS2表达
2.2 食管鳞癌细胞中ACSS2蛋白表达水平
蛋白质印迹结果表明,与Het-1A细胞相比,食管鳞癌细胞TE-1、ECA-109及KYSE-150均有较强的ACSS2表达(图3)。siRNA-ACSS2-3干扰效果最明显,siRNA-ACSS2-1和-2的效果较为一致且均弱于siRNA-ACSS2-3(图4)。
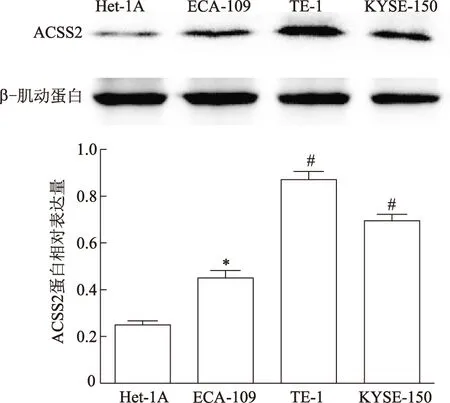
*:P<0.01;#:P<0.001,与Het-1A比较图3 蛋白质印迹检测正常食管鳞状上皮细胞与食管鳞癌细胞中ACSS2表达差异

*:P<0.01;#:P<0.001,与空白对照组及阴性对照组比较图4 蛋白质印迹验证TE-1细胞靶向干扰ACSS2效果
2.3 食管鳞癌细胞中ACSS2表达对顺铂的IC50值的影响
CCK8实验结果显示,相同浓度(除12.5 μg/mL浓度外)的顺铂条件下,siRNA-ACSS2-1、3处理组的TE-1细胞活力较空白对照组、阴性对照组均显著下降(P<0.05);空白对照组TE-1细胞顺铂的 IC50值为23.24 μg/mL,阴性对照组为24.82 μg/mL,siRNA-ACSS2-1和-3处理后下降到15.88 μg/mL和14.57 μg/mL (F=6.496,P<0.01,图5)。

图5 CCK8检测ACSS2干扰对TE-1细胞顺铂IC50值的影响
2.4 食管鳞癌细胞中ACSS2表达改变对顺铂杀伤能力的影响
流式细胞术结果表明,siRNA-ACSS2处理48 h后,阴性对照组、siRNA-ACSS2-1组和siRNA-ACSS2-3组TE-1细胞凋亡率分别为(2.05±0.04)%,(4.34±0.12)%和(3.24±0.12)%,3组间差异有统计学意义(F=367.897,P<0.001)。5 μg/mL顺铂处理24 h后TE-1细胞凋亡率为(9.68±0.57)%,而经siRNA-ACSS2-1、siRNA-ACSS2-3预处理24 h,再顺铂处理24 h后TE-1细胞凋亡率分别上调至(13.81±0.60)%和(15.82±0.13)%,3组间差异有统计学意义(F=62.778,P<0.001)。结果表明,下调ACSS2表达可以增强TE-1细胞对顺铂的敏感性(图6)。
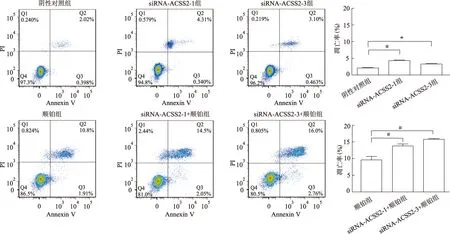
*:P<0.01,#:P<0.001图6 流式细胞术检测ACSS2干扰对TE-1细胞顺铂敏感性的影响
2.5 ACSS2对PI3K/AKT信号通路和凋亡相关蛋白的影响
蛋白质印迹结果显示,过表达ACSS2后PI3K/AKT信号通路出现持续活化,而PI3K通路靶向抑制剂LY290042处理(10 μmol/L)24 h可以有效逆转这一进程发生(图7)。顺铂处理可以诱导TE-1细胞中ACSS2的表达上调以及PI3K/AKT信号通路活化;在靶向下调ACSS2后可见TE-1细胞中p-PI3K、p-AKT表达显著降低而凋亡相关cleaved-Caspase-3 蛋白表达量明显升高,过表达ACSS2维持PI3K/AKT信号活化,同时可逆转cleaved-Caspase-3的表达(图8)。

图7 蛋白质印迹检测ACSS2过表达后PI3K/AKT信号通路相关蛋白

图8 蛋白质印迹检测PI3K/AKT通路及cleaved-Caspase-3的表达
3 讨论
食管鳞癌早期症状隐匿,多数患者初次确诊即为中晚期,造成临床工作中较易见早期局部或者远端转移、扩散,患者丧失了手术切除的机会,需要放疗、化疗等综合手段干预[7-9]。对于不具备手术切除条件的食管鳞癌患者,目前标准治疗方案为同步放化疗,其中联合化疗最常用方案为5-氟尿嘧啶和顺铂[10]。有研究发现,术后化疗采用顺铂可以有效地控制发生淋巴结转移、局部复发肿瘤进展,但是当前同步放化疗处理后5年生存率仅在27%左右,超过40%的患者未见明显改善或出现复发[11-13]。本研究探讨食管鳞癌细胞顺铂敏感性的关键信号通路和调控机制,以期为提高化疗效果和改善患者预后提供理论依据。
现代研究认为,肿瘤的快速生长不可避免地会导致代谢压力,而代谢重编程作为肿瘤恶性特征之一赋予了肿瘤细胞克服代谢压力并维持生长和增殖的能力,其中最常见的代谢表型就是瓦博格(Warburg)效应,即肿瘤细胞在氧气充足的情况下仍以糖酵解为主。研究证实,肿瘤细胞在不断摄取葡萄糖的同时对其他代谢物质如乙酸盐的依赖也会增加,而ACSS2可以利用乙酸盐大量合成乙酰辅酶A提供能量和物质基础,因此ACSS2的异常表达势必影响着肿瘤发生、发展[2]。例如,在肾癌组织中不仅可观察到ACSS2的累积,而且高表达ACSS2的患者表现为较高的肿瘤分期、易转移性以及更低的生存率[4];当乳腺癌细胞处于缺氧、脂质缺乏条件下,ACSS2的表达上调是维持肿瘤细胞增殖的关键分子基础[5]。然而需要注意的是,在不同类型肿瘤中ACSS2表达水平与恶性进程间的关系尚存较大争议:肝癌细胞株及瘤体内ACSS2的表达强度均较低;下调ACSS2表达可以阻断HIF-2α乙酰化从而促进转移发生[6]。因此本研究首先通过免疫组化检测了食管鳞癌组织及癌旁组织中的ACSS2表达,发现多数肿瘤细胞胞质中可见ACSS2强表达;而在癌旁组织中处于固有腺和基底膜附近增殖较旺盛区域的正常细胞亦可见阳性甚至强阳性ACSS2;统计免疫组化结果以及进一步通过组织匀浆蛋白质印迹检测显示,食管鳞癌组织中ACSS2蛋白总体表达水平要明显高于癌旁组织。已有文献报道,对膀胱癌细胞进行ACSS2的靶向抑制剂处理可以显著提高顺铂的杀伤作用[3]。本研究结果表明,靶向下调ACSS2能明显降低食管鳞癌细胞的顺铂IC50值;流式细胞术检测结果显示,siRNA-ACSS2单独处理即可引发肿瘤细胞凋亡,并可以显著增强顺铂对食管鳞癌的杀伤作用。上述结果表明,食管鳞癌细胞中高表达的ACSS2可能参与顺铂敏感性的调控。
众多研究发现,PI3K/AKT信号通路在多种类型恶性肿瘤的增殖、抗凋亡、转移发生等一系列进程中发挥着重要调控作用[14-15]。在肾癌细胞相关研究中证实,ACSS2可通过PI3K/AKT信号通路调控浸润、侵袭发生[4];而最新的研究表明,食管鳞癌中PI3K/AKT信号通路的过度激活会通过作用于凋亡相关蛋白如Caspase家族蛋白等表达参与顺铂敏感性调控[16-18]。本研究中,上调或下调食管鳞癌细胞中ACSS2的表达可直接促进或者抑制p-PI3K、p-AKT的活化水平;结合PI3K/AKT信号通路靶向抑制剂证实,ACSS2通过影响PI3K/AKT下游靶蛋白cleaved-Caspase-3 形成调控食管鳞癌细胞对顺铂的敏感性。
综上所述,食管鳞癌细胞中异常高表达的ACSS2可能通过PI3K/AKT信号通路活化以及凋亡蛋白cleaved-Caspase-3形成参与顺铂敏感性调控,表明ACSS2或可作为提高食管鳞癌化疗疗效和改善患者预后的潜在干预靶点。
