外科植入物产品表面阳极氧化改性应用分析
2020-12-21虞崇庆王龙浩马骏张莉郑建周均
虞崇庆 王龙浩 马骏 张莉 郑建 周均
钛及钛合金材料以材质轻、强度高、耐腐蚀性好、生物惰性等特点广泛应用于外科植入产品[1-3]。然而在临床医学上,钛及钛合金却不是理想的生物材料。一方面,归结于材料自身的属性,如钛及钛合金因生物惰性、弹性模量和人体骨骼不匹配导致应力遮挡等因素。另一方面,是材料表面的因素:钛及钛合金表面耐磨性差;不同牌号钛及钛合金接触发生接触腐蚀;有害金属离子通过表面释放到人体组织。植入物及材料学专家们通过研发更具生物相容性的材料或研究表面改性方法,以获得满足临床使用的植入物材料。
钛及钛合金的生物惰性源于其表面致密的氧化物薄膜,一旦暴露于空气中,钛及钛合金表面会形成一层致密的氧化膜保护层,其厚度通常为0.5~60 nm[4-5]。对于植入材料来说,这一层致密的氧化物薄膜具有2个功能:阻止生物环境对钛及钛合金材料的进一步腐蚀;阻止了基体材料向外界生物环境释放有害金属离子。但是,对于人体组织来说,钛及钛合金是一种外来的异质材料,自然形成的表面氧化膜太薄、强度太差,不足以保护内部基材并和人体组织形成理想结合面。于是研究者通过用各种方法对钛及钛合金进行表面改性,以获得比基体材料具有更高的硬度、强度、耐腐蚀性、耐磨性及生物相容性的表面,这其中应用最为广泛的便是表面阳极氧化。
本文采用扫描电子显微镜及能谱仪对外科植入物产品的表面阳极氧化层进行定性半定量分析,对引入元素的种类进行统计及分析。
1 材料与方法
本文抽取在本中心检测的30余家生产企业的337批外科植入物产品,其中116批为着色阳极氧化产品,221批为微弧阳极氧化产品,采用扫描电子显微镜及能谱仪对其进行表面分析,并对其表面引入元素的种类进行统计分析。
1.1 阳极氧化膜工艺原理及作用
钛及钛合金阳极氧化是指在电解液环境中,将钛及钛合金作为阳极,不锈钢或者其他惰性材料作为阴极,在两极间施加一定的电压,在其表面形成一层致密的氧化层的过程,这一过程称为着色阳极氧化[6-8]。通过参数的设置,可以根据需要获得如黄色、蓝色、紫色、金色、绿色、紫红色等不同颜色的具有不同膜层厚度的外科植入物产品,从而满足临床上的需要。
在电解液环境中,在着色阳极氧化的基础上,当电压上升到一定程度时,原来形成的氧化膜发生击穿,产生剧烈的等离子电弧,表面氧化膜进一步发生重构,电解液中的物质也会与基体一起产生于新的氧化膜中,膜层进一步加厚,这个过程称为微弧阳极氧化[6-9]。
钛及钛合金的阳极氧化膜具有比基体材料更高的硬度、强度、耐腐蚀性以及耐磨性,并且改善了钛及钛合金产品与人体组织的生物相容性。不管是着色阳极氧化还是微弧阳极氧化,都是在电解液中进行的,电解液中的离子都不同程度地参与氧化膜的形成,但这两种氧化膜的厚度不同,电解液成分与外科植入物的结合形态和牢固度也不同。因为不同的工艺,不同企业引入的不同于基体材料的元素也大不相同,有些是无意引入,有些则是有意为之,如P元素、Ca元素,通过调节电解液中的钙/磷比可以调节氧化膜中的钙/磷比[10],有证据表明其有助于形成羟基磷灰石[10-14],增强外科植入物的生物相容性。
1.2 阳极氧化膜分析方法
对钛及钛合金表面性能进行表征的仪器很多[15-17],最常使用的有X射线荧光能谱仪(XRF)、X射线荧光光电子能谱仪(XPS)、扫描电子显微镜及能谱仪、X射线衍射仪(XRD),不同的仪器有不同的特点和优势。其中XRF最大的特点是结果准确、使用方便、检测速度快且样品无需预处理,缺点是不能分析原子序数小于F的元素;XPS不仅能对元素进行定性半定量分析,还能对原子价态进行分析,从而判断出元素存在的化合物,缺点是价格昂贵,样品前处理麻烦;扫描电子显微镜及能谱仪,这里的能谱仪是和扫描电子显微镜联用的仪器,是其重要组成部分,此仪器不仅能得到氧化层在微观尺度上的表面形貌,还能分析其元素组成,是目前最为重要的阳极氧化膜表征方法,也是国家标准方法;XRD能检测出表面氧化层的物相,从而推断出其氧化工艺的种类和优劣,缺点是对标准物质的依赖性较高。
本论文采用的是国家标准方法[18],即S-4800扫描电子显微镜(HITACHI)及能谱仪(EDAX Inc.元素测量范围为Be~U)对外科植入物进行定性半定量分析。涉及的外科植入物产品有胸腰椎椎弓系统、肋骨接骨板、空心接骨螺钉、髓腔钉系统、脊柱后路钉棒内固定系统等,以下将统一称为外科植入物产品。
2 结果
2.1 着色阳极氧化外科植入物表面分析
本文对30余家生产企业的116批着色阳极氧化的外科植入物产品进行分析,扫描电镜下的着色阳极氧化膜典型形貌见图1,从图1可以看出着色阳极氧化膜表面比较平坦、光滑,光洁度较高,且膜层均匀。

图1 扫描电镜下着色阳极氧化膜表面形貌
对116批产品的扫描电镜结果进行统计分析,结果详见表1。其中,98批产品未检出除C、O、Ti、Al等基体元素外的其他元素,占总数的84.5%;有11批产品检测出含有P元素,占总数的9.5%;有7批产品检测出含有Si元素,占总数的6.0%;有4批产品检测出含有S元素,占总数的3.4%;有2批产品检测出含有Na元素,占总数的1.7%。
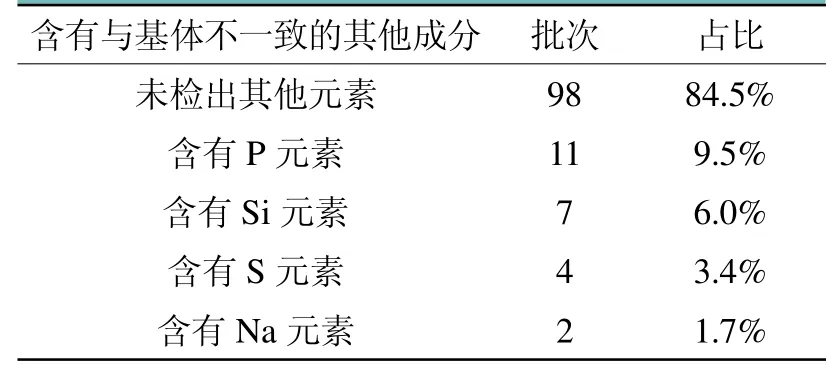
表1 着色阳极氧化膜统计
2.2 微弧阳极氧化外科植入物表面分析
同时,本文对221批表面微弧阳极氧化产品进行分析,扫描电镜下的微弧阳极氧化膜典型形貌如图2所示,在扫描电镜下,微弧阳极氧化膜呈现出直径为1~2 m的火山状孔径,各个孔径之间不互通。

图2 扫描电镜下微弧阳极氧化膜表面形貌
对221批产品的扫描电镜检测结果进行统计分析,结果详见表2。从结果来看,所有的产品均检测出含有基体不含的其他元素,如Si、P、S、Na、Ca元素。对其进行分析统计,发现有188批产品检测出含有Si元素,占总数的85.1%;有139批产品检测出含有P元素,占总数的62.9%;有116批产品检测出含有Na元素,占总数的52.5%;有36批产品检测出含有S元素,占总数的16.3%;有14批产品检测出含有Ca元素,占总数的6.3%。50%以上的微弧阳极氧化外科植入物表面检测出含有Si、P、Na元素。
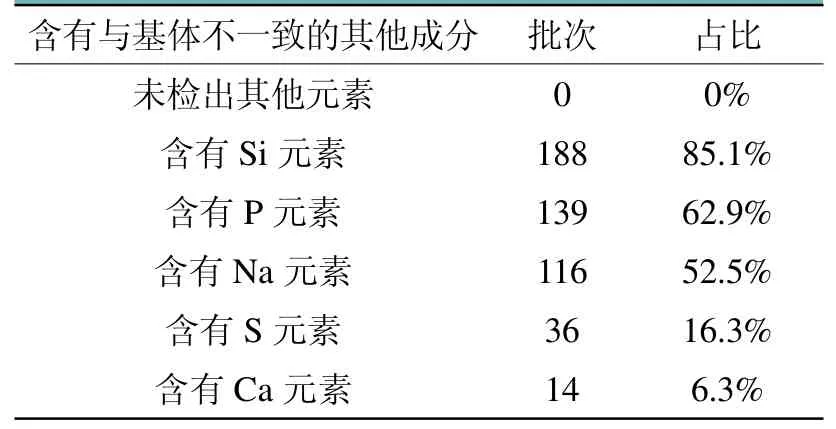
表2 微弧阳极氧化膜统计
2.3 清洗后阳极氧化层表面分析
笔者对4批表面含有S和2批含有Na的着色阳极氧化外科植入物产品进行超声波清洗。将清洗后的产品进行检测,结果均未检测出S、Na元素。说明着色阳极氧化处理的外科植入物表面的S、Na元素可以通过后续的清洗工艺有效去除,去除率达到100%。
3 讨论
3.1 成因分析
阳极氧化按照工艺一般经过“清洗—除油—粗洗—精洗—活化处理—阳极氧化—清洗—干燥”[10-14],通过实验研究,笔者发现在外科植入物的整个加工流程中,氧化过程是引入除基体外其他元素的关键步骤,电解液配方则是外科植入物表面引入除基体外其他元素的关键因素。目前,已经公开的电解液配方[19]有磷酸二氢钠、磷酸钠、硅酸钠、硫酸钠、氢氧化钠、碳酸钠、乳酸、乙酸、氢氟酸、醋酸钙、柠檬酸钠、酒石酸等,这和笔者的分析结果一致。
可见,合理控制氧化工艺的各个参数,特别是电解液配方,直接决定外科植入物表面引入元素的种类和含量,可以获得生物相容性更好的外科植入物产品。
3.2 清洗对阳极氧化膜中引入元素的影响
对于着色阳极氧化,电解液中的成分与外科植入物的结合程度较低,特别是S、Na成分,大概率可以通过清洗彻底去除。
可见,采用合适表面工艺和电解液配方,以获得生物安全、满足临床应用的外科植入物表面。对于需要长期植入的外科植入物,如关节假体等,可以通过在其表面氧化层中适量地添加Ca和P元素,以助于在其表面诱导生成羟基磷灰石,从而有助于骨长入。此外,还能在此基础上改进工艺,通过添加其他元素或助剂的方式以进一步加强骨长入的效果。当然,这还需要做进一步的实验研究及临床研究。希望厂商继续加强表面技术的研发力度,根据实际需要设计出满足不同临床应用的外科植入物产品。
