抑制EGFR信号通路对骨折愈合早期骨内、外膜来源干细胞增殖、分化能力影响的研究*
2020-12-21王华松兰生辉庞炯宇丰瑞兵杨晨曦袁功武曾文波
王华松兰生辉庞炯宇丰瑞兵杨晨曦袁功武曾文波
骨折在日常生活中十分常见,随着人们经济水平的提升,越来越多的骨折患者愿意接受正规治疗,以获得更好的骨折愈合效果、更早的康复锻炼。但美国骨科医师学会指出,仍有5%~10%的骨折患者出现了骨折延迟愈合或骨不连[1-2],这大大拖慢了患者回归正常生活的脚步。近年来,随着对信号通路领域的深入探索,研究者发现表皮生长因子受体(epidermal growth factor receptor,EGFR)信号通路与骨膜内的干细胞(stem cells,SCs)关系密切[3],而此类干细胞正是成骨细胞、成软骨细胞的前身,是骨折愈合过程中的核心角色。故本次研究通过使用EGFR信号通路抑制剂Gefitinib干预股骨干骨折大鼠,旨在探索抑制EGFR信号通路对骨折愈合早期骨内、外膜来源SCs的增殖、分化能力的影响。
1 材料与方法
1.1 材料
1.1.1 动物
健康的SPF级SD大鼠50只(1月龄),雄性,体重104~115(109.7±3.2)g[湖北省实验动物研究中心提供,SCXK(鄂)20-150018]。实验前适应性饲养1周。
1.1.2 主要试剂与仪器
Gefitinib、甲基纤维素(上海阿拉丁生化科技股份有限公司)、水合氯醛、PBS缓冲液、-巯基乙醇、谷氨酰胺、青霉素、链霉素、L-抗坏血酸、L-脯氨酸、丙酮酸钠、FITCBrdU细胞增殖检测试剂盒(武汉英颢科技有限公司)、-MEM完全培养基、胰酶、胎牛血清、成骨诱导液(Gibco公司,美国),FITC-CD29、FITC-CD34、FITC-CD45、FITCCD90(上海恒斐生物科技有限公司),von Kossa染液、阿尔新蓝染液(武汉赛维尔生物科技有限公司),地塞米松、-甘油磷酸钠、胰岛素、维生素C(Sigma公司,美国),1×ITS、TGF-3(北京百奥莱博科技有限公司)。CO2恒温培养箱、流式细胞仪(Thermo公司,美国)、光学显微镜(上海光学仪器厂)、X光机(Siemens公司,德国)。
1.2 方法
1.2.1 造模与分组
建立大鼠股骨闭合性骨折模型[4]:麻醉满意后,常规右下肢备皮。取右下肢髌骨内缘约1 cm纵行切口,逐步显露髌骨并向外侧脱位,于暴露的股骨髁间凹中心插入1枚20号注射针头,沿髓腔至股骨大粗隆部穿出,再将针头更换为直径1.2 mm克氏针。取大粗隆处小切口显露穿出的克氏针,将其折弯紧贴大粗隆骨皮质,缝合切口。贴骨面剪断股骨髁间凹处克氏针,缝合切口。再将大鼠右下肢固定于造模支架上,钝骨刀轻压于大腿中部,用500 g的重物于20 cm高处沿轨道自由落体撞击,致股骨中段闭合性骨折。
选取钝骨刀撞击处无表皮裂伤的大鼠拍摄右股骨正侧位X线片,其中短斜行或横行股骨干骨折大鼠为造模成功大鼠,共42只。将造模成功的大鼠标记后采用随机数表法分为对照组和实验组,各21只。
1.2.2 给药
实验组大鼠给予Gefitinib 100 mg/(kg d)(溶于0.5%甲基纤维素)灌胃,对照组给予等量0.5%甲基纤维素灌胃。共持续1周。
1.2.3 骨内、外膜来源SCs的分离、提取及培养
由于骨折1周后开始逐渐形成骨痂[5-6],因此笔者于造模1周后处死大鼠并置于75%乙醇中消毒15 min。在无菌环境下提取右股骨,-MEM清洗后缓缓刮下骨外膜,用蛋白酶溶液(PBS+2 mg/mL胶原酶A+25 mg/mL胰蛋白酶)消化2 h,获得骨外膜SCs的细胞悬液;用蛋白酶溶液消化股骨20 min,以彻底清除骨外膜SCs,随后去除生长板两端骨质,将股骨沿纵轴切开,去除骨髓后用蛋白酶溶液消化2 h,获得骨内膜SCs的细胞悬液。将上述所得的细胞悬液低速离心10 min后弃去上清液,保留细胞沉淀,再分别接种后置于37℃、5%CO2的饱和湿度恒温孵箱中培养。24 h后换液并加入培养基(-MEM+20%FBS+55 M-巯基乙醇+2 mM谷氨酰胺+100 IU/mL青霉素+100 g/mL链霉素),再置于孵箱中培养。每2 d更换培养基,每3 d换液。当细胞贴壁融合达90%时,再按1∶2传代。
1.2.4 骨内、外膜来源SCs表面标志物鉴定
取第3代骨内、外膜SCs,胰酶消化后计数。配制含0.5%BSA的PBS,各EP管中加入1 mL上述PBS及1×106个细胞;离心5 min后再用上述PBS清洗。然后每管100 L细胞悬液分别添加1 L抗体FITC-CD29、FITC-CD34、FITCCD45、FITC-CD90,4℃孵育30 min。再次离心后用上述PBS清洗并重悬,流式细胞仪检测分析。
1.2.5 骨内、外膜来源SCs增殖能力检测
取第3代骨内、外膜SCs,胰酶消化。再于6孔板中每孔加1 mL细胞悬液,密度为5×105/mL,37℃培养过夜。然后每孔加入BrdU调整浓度至30 M,孵育60 min。吸去培养基并收集细胞,重悬、离心、洗涤后每管加入500 L固定液,4℃固定过夜。洗涤、离心并每管加入500 L通透液重悬细胞,冰上孵育2 min,再次洗涤、离心。每管加入300 L含50 L变性剂的DNA变性工作液,再次洗涤、离心。用195 L染色缓冲液重悬细胞并每管加入FITCBrdU抗体5 L(0.125 g),4℃避光孵育30 min。用流式细胞仪进行检测。
1.2.6 骨内、外膜来源SCs多向分化能力检测
取第3代骨内、外膜SCs,接种于成骨培养基(-MEM+10%FBS+10 mmol/L-甘油磷酸钠+50 mg/L维生素C+0.1 mol/L地塞米松)及成软骨培养基(-MEM+10%FBS+0.1 mol/L地塞米松+50 g/mL L-抗坏血酸+40 g/mL L-脯氨酸+100 g/mL丙酮酸钠+1×ITS+10 ng/mL TGF-3)。成骨诱导21 d后行von Kossa染色,成软骨诱导21 d后行阿尔新蓝染色。在显微镜下进行观察。
1.3 统计学方法
采用SPSS 19.0统计学软件对数据进行分析。计量资料用均数±标准差表示,两组间比较采用两独立样本检验。<0.05为差异有统计学意义。
2 结果
2.1 骨内、外膜来源SCs表面标志物鉴定
流式细胞仪测得FITC-CD29、FITC-CD34、FITC-CD45、FITC-CD90在实验组与对照组的骨内、外膜SCs中表达相似,即CD29、CD90呈现高表达,CD34、CD45呈现低表达(见表1)。
表1 细胞表面标志物的表达率(%,n=21)
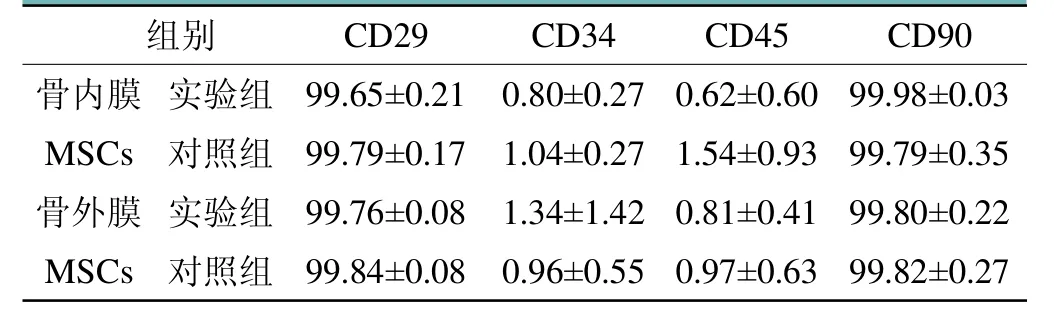
表1 细胞表面标志物的表达率(%,n=21)
?
2.2 骨内、外膜来源SCs增殖能力检测
BrdU法检测各组荧光信号倍增量发现,骨内、外膜SCs的实验组荧光信号倍增量均显著低于对照组(<0.01)(见表2)。Gefitinib抑制EGFR信号通路后,对骨内膜SCs增殖抑制率为15.88%,对骨外膜SCs增殖抑制率为10.09%,可见骨内膜SCs增殖活动被抑制更明显。
表2 骨内、外膜SCs荧光信号倍增量的比较(%,n=21)

表2 骨内、外膜SCs荧光信号倍增量的比较(%,n=21)
?
2.3 骨内、外膜来源SCs多向分化能力检测
骨内、外膜SCs经成骨诱导分化、成软骨诱导分化21 d后,进行相应染色可见:von Kossa染色者镜下骨外膜SCs形成的矿化结节较骨内膜SCs形成明显;阿尔新蓝染色者镜下骨外膜SCs细胞内的淡蓝色颗粒较骨内膜SCs细胞内明显(见图1、图2)。

图1 成骨诱导后von Kossa染色结果(×200):A.骨外膜SCs实验组;B.骨内膜SCs实验组;C.骨外膜SCs对照组;D.骨内膜SCs对照组

图2 成软骨诱导后阿尔新蓝染色结果(×100):A.骨外膜SCs实验组;B.骨内膜SCs实验组;C.骨外膜SCs对照组;D.骨内膜SCs对照组
3 讨论
骨作为一个长期处于高度动态平衡的组织,一旦出现破损,能激发巨大的再生潜能,以重建其完整性及运动功能[7]。骨折愈合主要通过两种方式:一期愈合与二期愈合。一期愈合是指断端复位并处于绝对稳定的情况下,经哈弗系统重建直接发生接触式愈合,无明显骨皮质区吸收、无明显外骨痂生成;二期愈合则在临床上最为多见,包括膜内化骨与软骨内化骨两种形式,有骨痂生成[5,8]。膜内化骨发生在愈合早期骨折近、远端表面,骨内、外膜中的SCs分化为成骨细胞并合成、分泌新的骨基质,骨基质逐渐钙化后形成内、外骨痂,起到一个支架的作用,为断端愈合提供亟需的稳定环境[9-12]。软骨内化骨则发生在骨折端中央,SCs分化为软骨细胞后合成分泌软骨基质,将断端的纤维组织转变为软骨组织,随后破软骨细胞和成骨细胞伴随毛细血管侵入软骨组织,使软骨钙化形成环状骨痂和髓腔内骨痂,连接骨折两端恢复连续性,起到骨桥的作用[9,13]。由此可见,骨膜来源SCs在骨折愈合中的核心程度。
EGFR信号通路近些年来逐渐被学者们解密,发现其是机体调节骨代谢的重要途径[14]。EGFR作为一种跨膜糖蛋白包括3个部分——胞外能与配体相结合的结构域、疏水性的跨膜结构域、细胞内的催化酪氨酸激酶结构域和酪氨酸残基[15-16]。它在特异性配体刺激后形成一种二聚体,在细胞内发生磷酸化后激活下游接收者,从而达到调控细胞核内相关基因表达的目的,以影响细胞的增殖、分化、凋亡行为[13,17]。目前,已有许多研究证实了EGFR信号通路在骨折愈合过程中的关键作用。例如,Yang等[18]研究发现,miR-96可阻断EGFR信号通路来促进大鼠骨髓间充质干细胞的成骨分化;Zhu等[19]研究发现,EGFR激活后抑制成骨细胞核内Runx2和Osterix基因的表达,进而抑制了成骨细胞的分化与矿化;Saito等[20]研究发现,EGFR活化后能够增加成骨细胞的数量;Chandra等[21]通过增加早期生长反应2(early growth response,EGR2)的表达促进成骨细胞的增殖和存活。但研究者们尚未深究EGFR信号通路—骨膜干细胞这一中间过程。同样,本课题组通过前期实验发现EGFR信号通路被抑制后能显著加快大鼠股骨中段骨折的愈合进程[3,22],其中的具体机制需进一步研究。
因此,本次实验使用Gefitinib抑制EGFR信号通路后检测骨内、外膜来源SCs增殖能力,成骨、成软骨分化能力来探索在骨折愈合早期EGFR信号通路与此类SCs之间的关联。首先,笔者对提取的骨内、外膜SCs进行细胞表面标志物鉴定,发现FITC-CD29、FITC-CD90呈高表达,FITC-CD34、FITC-CD45呈低表达,这与Asumda等[23]的研究结果相吻合:成骨相关的干细胞高表达表面抗原CD29、CD90,低表达内皮细胞表面抗原CD45以及造血干细胞表面抗原CD34。其后,笔者通过BrdU掺入法检测干细胞增殖能力,发现在骨折愈合早期骨外膜SCs的增殖力较骨内膜SCs更强,同Gastel等[24]的结果类似,这可能与骨内膜血供相对外膜偏少有关。在EGFR信号通路被抑制后,骨内、外膜SCs的增殖力显著被抑制,且骨内膜SCs受抑制更明显,这可能与影响了细胞周期抑制因子相关基因(P15、P16、P21、P27)的表达有关,需要后期深入探究。最后,笔者对SCs行成骨诱导分化21 d并染色后,发现实验组SCs的矿化结节较对照组更多;同样,经21 d成软骨诱导分化并染色后,发现实验组SCs的淡蓝色颗粒较对照组更多,表明通过Gefitinib抑制EGFR信号通路后,骨内、外膜SCs的成骨、成软骨分化能力增强。结合之前学者的研究,猜测抑制EGFR信号通路将抑制骨髓间充质干细胞、骨膜干细胞、成骨细胞、成软骨细胞这一系列与骨折愈合密切相关细胞的增殖过程,但促进它们的分化过程,这有待进一步探索。
目前,骨折愈合的分子机制尚未被研究透彻,本研究将为学者们对其机制及EGFR信号通路的探索提供宝贵经验,也将为EGFR信号通路成为促进骨折愈合新的治疗靶点提供更多理论基础。
