利拉鲁肽对血管平滑肌细胞增殖的影响及其机制
2020-12-16聂晓东刘源申娟祁华琪
聂晓东,刘源,申娟,祁华琪
血管平滑肌细胞(VSMCs)的异常增殖在血管重构中扮演着重要角色,可引起动脉内膜增厚,继而引起动脉粥样硬化、经皮冠状动脉(冠脉)介入治疗术后或静脉移植术后的血管再狭窄[1-3]。因此,抑制VSMCs异常增殖是逆转血管重构的关键环节[4],但临床尚无特异性抗VSMCs增殖的药物,寻找抗VSMCs增殖且无其他毒副作用的药物对改善血管重构具有重要意义。
胰高血糖素样肽-1(GLP-1)类似物利拉鲁肽(LIR)是一种主要来自回肠内分泌细胞的降血糖素激素,可刺激胰岛β细胞分泌胰岛素,抑制胰岛α细胞分泌胰高血糖素,抑制胃排空并减少餐后高血糖,临床已用来治疗2型糖尿病,效果显著[5-8]。在心血管研究中显示,GLP-1及其类似物可通过激活心肌细胞保护通路,改善小鼠缺血/再灌注损伤,逆转小鼠心肌肥厚及心血管功能障碍[9-11]。基于以上研究结果,我们认为利拉鲁肽具有心血管保护作用,其是否具有抗VSMCs增殖的作用目前尚未得知。本实验采用利拉鲁肽对血小板源性生长因子-BB(PDGF-BB)诱导的VSMCs进行干预处理,观察其对细胞增殖的作用,并对可能机制进行探讨。
1 材料与方法
1.1 实验细胞VSMCs(货号:GNR7)购自中科院细胞库。细胞培养于37℃恒温、体积分数为5%的CO2培养箱中。细胞培养基成分包括改良Eagle培养基(DMEM/F12)+10%新生胎牛血清(FBS)+1%双抗(PS)。光镜下当细胞铺满80%的培养皿底时,采用0.25%胰酶(不含EDTA)消化后传代,所有实验均采用第3-5代VSMCs。
1.2 实验试剂利拉鲁肽购自诺和诺德公司(溶解于0.9%生理盐水中),锥虫蓝、碘化丙啶(PI)、2',7'-二氯荧光黄双乙酸盐(DCFHDA)、Brdu细胞增殖试剂盒购自美国Sigma公司;细胞增殖检测试剂盒(CCK-8)购自日本同仁化学研究所;FBS、DMEM/F12培养基、胰酶、PS均购自美国Gibco公司;PDGF-BB购自美国Peprotech公司;p-JNK、JNK、p-ERK1/2、ERK1/2、p-p38、p38、甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自美国Cell Signaling Technology(CST)公司。
1.3 实验分组实验共分6组,分别为①空白对照组;②PDGF-BB组(20 ng/ml);③PDGF-BB(20 ng/ml)+LIR(25 nM)组;④PDGF-BB(20 ng/ml)+LIR(50 nM)组;⑤PDGF-BB(20 ng/ml)+LIR(100 nM);⑥LIR(100 nM)组。
1.4 锥虫蓝染色检测LIR的细胞毒性不同因素干预细胞48 h后,采用0.25%的胰酶将细胞消化稍皱缩时,轻柔吹打为单细胞悬液,吸取9 μl细胞悬液与1 μl 0.4%的锥虫蓝溶液使之充分混匀后置于细胞计数仪中计数,活细胞率(%)=活细胞总数/(活细胞总数+死细胞总数)×100%,每组随机测3个视野。
1.5 细胞增殖能力测定细胞被接种至96孔板中,每孔100 μl,密度大约1.5×105个/ml,置于温箱培养24 h,更换为饥饿液继续培养12 h,采用不同干预措施继续刺激细胞48 h。
1.5.1 CCK-8将96孔板中的培养基换为含有10 μl CCK-8的饥饿培养基100 μl,温箱中孵育3 h后,置酶标仪下(波长450 nm)读取细胞的吸光度(A)值。以空白对照组细胞活性为100%,余下各组细胞活性数值=干预组/对照组×100%
1.5.2 Brdu将96孔板中的培养基换为含有10 μl Brdu标记液的饥饿培养基,37℃继续孵育细胞3 h后采用Brdu试剂盒检测的标准流程对细胞增殖进行检测。
1.6 PI染色检测细胞周期VSMCs接种至6孔板中,经过不同因素刺激48 h后,消化细胞,离心弃上清,采用预冷PBS漂洗细胞2次后弃去PBS,加入1 ml预冷70%乙醇(无水乙醇+PBS配制),将之吹打为单细胞悬液,4℃冰箱中固定过夜,次日再次以PBS洗涤细胞一次,之后加入485 μl PBS重悬细胞,加入1 μl 0.2%的聚乙二醇辛基苯基醚(Triton X-100)、1mg/ml核糖核酸酶(RNase)5 μl及1 mg/ml PI 10 μl,4℃避光孵育30 min后上机检测。
1.7 实时定量RT-PCRVSMCs接种至6孔板中,经过不同因素刺激48 h后,弃去培养基提取细胞总的RNA,采用紫外分光光度法测定其浓度与纯度后,取适当剂量将各个细胞样本浓度调整一致后逆转录为cDNA。以GAPDH为内参照,采用20 μl体系进行PCR扩增。反应条件为:94℃ 2 min 1个循环,94℃ 40 s 25~35个循环,50~65℃ 40 s,72℃ 1 min,72℃ 5 min 1个循环。所用的引物序列见表1。

表1 调控细胞周期相关蛋白的mRNA引物序列
1.8 Western blot裂解后将细胞刮下置入离心管中,采用BCA定量法检测蛋白浓度,将其调整一致后置于煮沸仪上变性。取10 μl行10% SDSPAGE凝胶电泳,检测GAPDH,根据各个样本的光密度值调整上样剂量,使用调整后的剂量再次行凝胶电泳,使GAPDH光密度值保持一致,后各组均以此剂量进行实验。将蛋白转移至PVDF膜上,用一抗封闭液封闭12 h,一抗包括:p-JNK、JNK、p-ERK1/2、ERK1/2、p-p38、p38,TBST洗膜后将其放入二抗稀释液中避光孵育1h,二抗为Alexa Fluor® 488 goat anti-Rabbit IgG,使用Odyssey图像分析软件检测各组蛋白的密度值作为蛋白表达水平。
1.9 ROS的检测不同处理因素干预细胞6 h后,将96孔板中的培养基换为含有10 μmol/L DCFHDA的培养基继续孵育20 min,检测方法采用Yang等[8]的方法,ROS水平(%)=干预组荧光值/对照组荧光值×100%。
1.1 0 统计学分析所有数据应用SPSS 17.0统计软件进行分析。计量资料以均数±标准差(±s)表示,多组间均数比较采用单因素方差分析,组间两两均数比较采用LSD法检验,以P<0.05为差异统计学意义。
2 结果
2.1 LIR和/或PDGF-BB对VSMCs的细胞毒性不同干预因素刺激细胞48 h后,采用锥虫蓝染色法检测细胞活性,LIR(25、50、100 nM)干预VSMCs的细胞活性分别为98.2%±9.7%、96.1%±6.8%、98.5%±6.6%,与空白对照组相比,差异无统计学意义(P均>0.05);LIR(25、50、100 nM)与PDGF-BB(20 ng/ml)共同干预VSMCs的细胞活性分别为95.4%±8.2%、96.2%±8.3%、97.1%±8.8%,与空白对照组相比,差异无统计学意义(P均>0.05)。
2.2 CCK-8及Brdu检测LIR对PDGF-BB诱导的VSMCs增殖及DNA合成CCK-8细胞增殖检测结果提示,与空白对照组相比,PDGF-BB(20 ng/ml)刺激VSMCs 12、24、48 h后,细胞增殖呈时间依赖性(P<0.01);LIR(25、50、100 nM)与PDGFBB联合干预细胞后,结果提示其呈时间和浓度依赖性的抑制VSMCs增殖(图1A)。我们进一步通过BrdU掺入法观察LIR对VSMCs DNA合成的影响,结果提示,与空白对照组相比,PDGF-BB刺激VSMCs 12、24、48 h后,DNA合成呈时间依赖性(P<0.01),LIR(25、50、100 nM)与PDGF-BB联合干预细胞后,结果提示其呈时间和浓度依赖性的抑制VSMCs DNA的合成(图1B)。
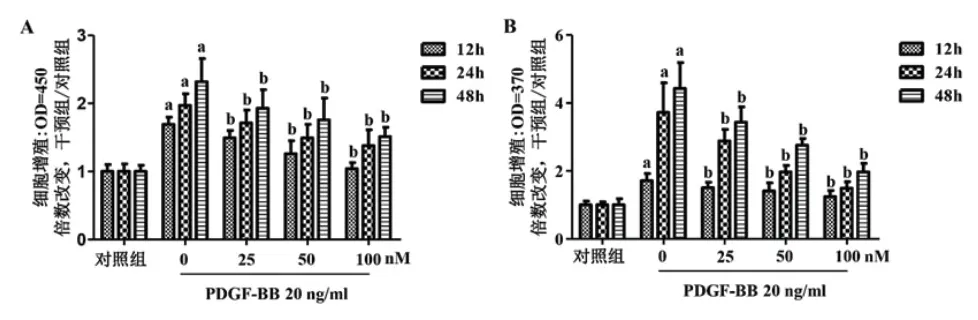
图1 LIR可抑制PDGF-BB诱导的VSMCs增殖及DNA合成
2.3 流式细胞仪检测LIR对细胞周期的影响与空白对照组相比,PDGF-BB(20 ng/ml)刺激VSMCs 48 h后,处于G0/G1的细胞百分比降低,S期及G2/M期细胞百分比均增加;与PDGF-BB组相比,LIR(100 nM)与PDGF-BB联合干预后,处于G0/G1细胞百分比显著增加,S期及G2/M期细胞百分比均下降,结果显示LIR可阻滞G0/G1期VSMCs向S期过渡(表2)。

表2 各组细胞周期统计结果(%)
2.3 调控细胞周期相关蛋白的基因表达与空白对照组相比,PDGF-BB(20 ng/ml)刺激VSMCs 48 h后,CDK6、CDK4、CyclinD1及CyclinE的基因表达水平显著上调,P27表达水平显著下调;与PDGF-BB组相比,LIR(100 nM)与PDGF-BB联合干预后,CDK6、CDK4、CyclinD1及CyclinE的基因表达水平均明显下调,P27表达水平则显著上调;LIR单独干预细胞对以上基因表达无影响(图2)。
2.4 酶标仪检测细胞中ROS的表达水平与空白对照组相比,PDGF-BB(20 ng/ml)刺激VSMCs 6 h后,细胞中的ROS表达水平显著提高(P=0.003);与PDGF-BB组相比,LIR(25、50、100 nM)与PDGF-BB联合干预后,其呈浓度依赖性的抑制细胞内ROS的表达(P=0.02,0.01,0.01)(图3)。

图2 LIR对VSMCs细胞周期相关蛋白mRNA的影响

图3 LIR可抑制PDGF-BB诱导的ROS生成
2.5 调控细胞周期相关信号通路的蛋白表达与空白对照组相比,PDGF-BB(20 ng/ml)刺激VSMCs 15 min后,JNK、ERK1/2及p38的磷酸化水平均显著升高(P=0.02,0.00,0.01);与PDGF-BB组相比,LIR(100 nM)与PDGF-BB联合干预后,ERK1/2和p38的磷酸化水平均显著降低(P=0.00,0.007),而JNK的磷酸化水平则无显著变化(P=0.52);LIR单独干预细胞对以上信号通路的磷酸化水平无影响(P均>0.05)(图4)。

图4 LIR对MAPK信号通路的影响
3 讨论
本研究显示,PDGF-BB(20 ng/ml)可显著刺激VSMCs增殖,处于S期及G2/M期的细胞比例较空白对照组明显增加,此外细胞内ROS产生增加,进一步活化细胞增殖相关信号通路。利拉鲁肽抑制PDGF-BB诱导的VSMCs增殖和DNA合成呈浓度和时间依赖性,并且实验浓度的利拉鲁肽对VSMCs无毒性。本研究还表明,利拉鲁肽能够通过下调CDK6、CDK4、CylinD1及CyclinE的表达,阻滞细胞周期于G0/G1-S期。利拉鲁肽抑制PDGF-BB刺激的VSMCs增殖是通过抑制ROS的产生以及其下游的ERK1/2和p38信号通路活化来实现的。这些结果为利拉鲁肽预防和治疗血管重构相关疾病的提供了理论依据。
VSMCs异常增殖可导致血管狭窄及血管重塑,在动脉粥样硬化及PCI术后再狭窄过程中发挥重要的作用[12-15]。我们的研究结果表明,利拉鲁肽(25~100 nM)可抑制PDGF-BB诱导的VSMCs增殖和DNA合成,其中100 nM效果最佳。细胞增殖受细胞周期的严格调控,此过程需要静态状态的VSMCs进入和通过细胞周期各阶段,利拉鲁肽已被证实可在癌细胞系中阻滞细胞周期进程,为此,我们研究了利拉鲁肽对VSMCs周期的影响。流式细胞仪结果提示利拉鲁肽干预48 h可显著增加G0/G1期细胞的百分比,减少处于S及G2/M期细胞的百分比,表明利拉鲁肽可阻滞VSMCs细胞周期于G0/G1-S期。进一步检测了调控细胞周期由G0/G1期向S期过渡检查点中发挥重要调控作用的基因,结果显示PDGF-BB可显著上调CDK6、CDK4、CylinD1及CyclinE及下调P27 mRNA的表达水平,而利拉鲁肽与PDGF-BB的联合干预48 h后以上指标均得到显著逆转。以上结果提示利拉鲁肽可通过调控这些细胞周期相关蛋白发挥拮抗PDGF-BB诱导的VSMCs增殖作用。
在血管损伤时,PDGF-BB会大量释放,与其细胞膜受体PDGFRβ结合后会产生大量活性氧(ROS),继而诱导下游胞内丝裂原活化蛋白激酶(MAPKs)信号通路活化,VSMCs中MAPKs信号通路如ERK1/2和p38信号通路的活化可引起细胞的增殖,诱导VSMCs表型由收缩型转化为增殖型[16-19],Lee等[20]研究显示,清除ROS可抑制PDGF-BB诱导的VSMCs增殖。我们的研究结果显示,利拉鲁肽可显著抑制PDGF-BB诱导的细胞内ROS的产生,蛋白电泳结果提示利拉鲁肽显著抑制PDGF-BB诱导的ERK1/2及p38 MAPK信号通路的磷酸化水平,而对JNK信号通路磷酸化水平无影响,提示利拉鲁肽是通过抑制ROS以及其下游ERK1/2和p38信号通路的活化抑制VSMCs的增殖。
我们的研究首次发现利拉鲁肽可抑制PDGFBB诱导VSMCs的增殖,这种现象与利拉鲁肽调控相关细胞周期蛋白的表达,以及调控ROS及其下游的ERK1/2和p38信号通路活化有关。该研究结果表明,利拉鲁肽在治疗糖尿病之余,有可能成为治疗和预防血管重构相关疾病的新药物,尤其是对于冠心病合并2型糖尿病的患者更能得到进一步的获益[21]。下一步需要在大体动物身上继续验证,以得到更加肯定的结果,为其进一步的临床研究做好基础支持。
