酶法改性樟树籽仁油制备含ω-3多不饱和脂肪酸结构脂质及其理化性质与抗氧化活性
2020-12-15郑富良黄济勇曾哲灵
郑富良,杨 斌,黄济勇,杨 博,曾哲灵,余 平
(1.南昌大学 资源环境与化工学院,南昌330031; 2.南昌大学 食品科学与技术国家重点实验室,南昌330047)
樟树籽仁油(CCSKO)是从樟树的籽中提取所得。CCSKO中中碳链甘油三酯(Medium-chain tricylglycerols, MCT)含量达95%以上。CCSKO为迄今发现的唯一天然MCT,食用安全,具有减少体内脂肪沉积和肝脏脂变[1-2]、降低血脂和血糖作用[3-4]。MCT易于被水解、吸收、氧化释放能量,是一种快速能量的来源[5-6], 可用于吸收不良综合征人群的饮食治疗[7]。但是,Jeukendrup等[8]研究表明摄入过量的MCT会引起副作用。从脂肪酸组成分析,CCSKO含辛酸0.3%~2.6%、癸酸51%~62%、月桂酸34%~40%,不含必需脂肪酸,不能完全满足日常的营养要求。二十碳五烯酸(EPA)与二十二碳六烯酸(DHA)同属ω-3长碳链多不饱和脂肪酸,主要来源是深海鱼[9]。EPA/DHA具有抑制血小板凝结、抗血栓、调节血脂、改善糖尿病以及炎症等功效[10-11]。
结构脂质(SL)是由天然油脂通过改性或结构重组制得,中长碳链结构脂质是一种新型的结构脂质,其结构中同一甘油三酯(TAG)中含有中碳链脂肪酸(MCFA)和长碳链脂肪酸(LCFA),同时具备两种脂肪酸的营养特征。为提高CCSKO的营养价值,可以采用中长碳链不饱和脂肪酸油脂对CCSKO进行改性制备成结构脂质。结构脂质的制备分为化学法改性和酶法改性。与化学法改性相比,采用酶法改性反应条件更温和,底物选择性更高,催化效率更高,副产品更少,更安全[12-13]。国内外都有使用酶法合成EPA/DHA结构脂质的报道。杨春芳等[14]使用脂肪酶催化金枪鱼油酸解合成含有中长碳链的结构脂质, EPA/DHA掺入总量为27.64%。Willett等[15]使用Novozyme 435脂肪酶催化鱼油和癸酸合成含有EPA/DHA的结构脂质,EPA/DHA掺入总量达到34.83%。
因此,本研究拟通过脂肪酶催化酯交换将EPA/DHA交换到CCSKO骨架上制备一种新的结构脂质,通过单因素试验获得酯交换反应制备结构脂质的最适条件,使其最大限度地发挥油脂中多不饱和脂肪酸的生理功能和营养价值,并对纯化产品的脂肪酸组成及分布、甘油酯组成、理化性质和体外抗氧化活性进行分析,为 CCSKO的高值化生产提供技术参考。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
樟树籽仁油(CCSKO),樟树籽经压榨、碱炼、过滤得到。鱼油乙酯,购自西安伟振生物科技有限公司。
硅胶薄层色谱板(100 mm×200 mm;0.20~0.25 mm),青岛海洋化工有限公司;固定化脂肪酶Novozyme 435 (10 000 PLU/g),诺维信(中国)生物技术有限公司;40种脂肪酸甲酯(FAME)标准混合物,上海惠诚生物有限公司;胰脂肪酶、DPPH自由基试剂、ABTS自由基试剂,上海阿拉丁生化科技有限公司。所有试剂均为分析纯或色谱级。
1.1.2 仪器与设备
BS223S电子天平,德国赛多利斯有限公司;THZ-92C恒温油浴锅;SK1200B超声仪;KL-UP-III-10超纯水制备机;SY-IIID氮吹仪;YOKO-ZX紫外线分析暗箱;7890B气相色谱仪(GC-FID)、1260高效液相色谱仪(HPLC-ELSD),美国安捷伦科技有限公司;5600高效液相色谱-四级杆飞行时间串联质谱仪(HPLC-Q-TOF-MS),美国应用生物系统公司;KDL5短程分子蒸馏仪,德国UIC公司。
1.2 试验方法
1.2.1 酯交换制备结构脂质
将不同底物摩尔比的CCSKO和鱼油乙酯与Novozyme 435脂肪酶在500 mL的烧瓶中混合。将烧瓶放置恒温油浴锅中,氮气保护下,搅拌反应一定时间后,过滤除去脂肪酶得到酯交换粗产物,置于-20℃保存,待进一步分析。回收的脂肪酶经石油醚洗涤,挥发去溶剂后低温保存,用于测定脂肪酶的操作稳定性。
1.2.2 酯交换放大试验及产物纯化
采用最佳反应条件进行放大5倍规模的试验,反应后滤除脂肪酶。对酯交换粗产物进行分子蒸馏,得到重相分子蒸馏产物(即结构脂质产品)。短程分子蒸馏参数:保温温度60℃,刮膜速度120 r/min,进料速度100 mL/h,蒸馏温度150℃,真空度小于10.33 Pa。
1.2.3 脂肪酸组成分析
参考冯绍贵等[16]的方法对样品进行甲酯化,然后进行GC分析。GC条件:氢火焰离子化检测器(FID);DB-23 石英毛细管色谱柱(30 m×0.25 mm×0.25 μm);注射器温度250℃,检测器温度280℃;升温程序为初始温度50℃,以25℃/min升高到175℃,再以3℃/min升高到230℃,保持10 min。以保留时间定性,峰面积归一化法定量。
1.2.4 Sn-2 脂肪酸位置分析
参考Luddy等[17]的方法制备2-单甘酯。将2-单甘酯转化成脂肪酸甲酯,按1.2.3 GC条件分析脂肪酸组成。
1.2.5 样品组成及含量测定
采用HPLC-Q-TOF-MS分析油脂样品甘油三酯、脂肪酸乙酯组成及含量。
HPLC条件:样品用甲醇稀释至质量浓度为5 mg/mL;进样量5.0 μL;柱温25℃;流动相流速0.8 mL/min;洗脱程序为采用梯度洗脱,0 min 70%乙腈(A)和30% 丙酮(B),30 min 50% 乙腈(A)和50% 丙酮(B)。
ELSD蒸发光散射检测器条件:蒸发温度40℃,雾化温度45℃,载气(N2)流速1.6 L/min。
MS条件:采用AB SCIEX Triple TOF 5600系统进行质谱分析。参数设置为:正离子模式,离子喷雾电压5 500 V;离子源温度550℃;幕状气体压力275 kPa;离子源气体压力1.7 MPa;碰撞能量10 eV;扫描范围250~1 100。使用SCIEX OS软件(SCIEX)进行数据采集和处理。
1.2.6 样品理化性质的测定
酸价测定参考GB 5009.229—2016,过氧化值测定参考GB 5009.227—2016,皂化值测定参考GB/T 5534—2008,碘值测定参考GB/T 5532—2008。
1.2.7 体外抗氧化能力的测定
1.2.7.1 DPPH自由基清除能力
参考Zheng等[18]的方法测定不同质量浓度油脂样品的DPPH自由基清除能力。以油脂质量浓度对DPPH自由基清除率作图,进行线性拟合,计算IC50(清除50%自由基所需抗氧化剂样品质量浓度),以IC50评价油脂对DPPH自由基的清除能力。
1.2.7.2 ABTS自由基清除能力测定
参考Shi等[19]的方法测定不同质量浓度油脂样品的ABTS自由基清除能力。以油脂质量浓度对ABTS自由基清除率作图,进行线性拟合,计算IC50,以IC50评价油脂对ABTS自由基的清除能力。
1.2.8 统计分析
数据均取3次测定的平均值,结果以“平均值±标准偏差”表示。采用统计分析软件(IBM SPSS Statistics 23) 对数据进行单因素方差分析(ANOVA),P<0.05为差异有统计学意义。
2 结果与讨论
2.1 底物摩尔比对酯交换反应的影响(见图1)
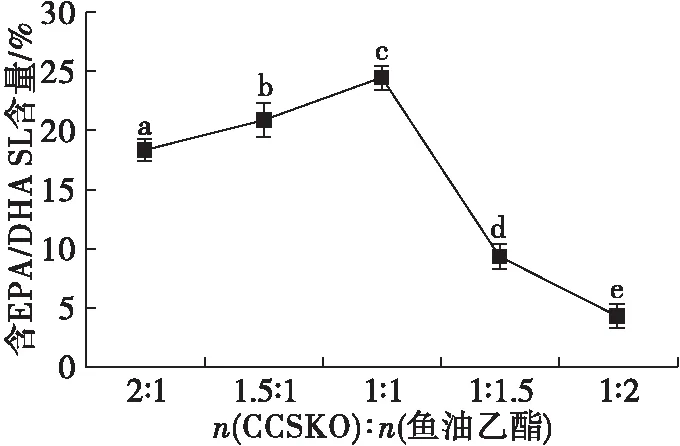
注:酶载量10% (以底物质量计),反应温度60℃和反应时间8 h。不同字母表示显著性差异,下同。
由图1可知,底物摩尔比(CCSKO与鱼油乙酯摩尔比)从2∶1到1∶1,含EPA/DHA SL含量从(18.15±0.09)%增加到(24.34±0.33)%。底物摩尔比进一步增加到1∶2,含EPA/DHA SL含量显著下降。这是由于合适的底物摩尔比可以增加底物与酶之间的接触,加快反应并快速达到平衡[20]。但底物摩尔比过高时会引起体系中水解反应所产生的副产物增加,从而导致含EPA/DHA SL含量降低。因此,选择1∶1为最佳底物摩尔比。
2.2 反应温度对酯交换反应的影响(见图2)
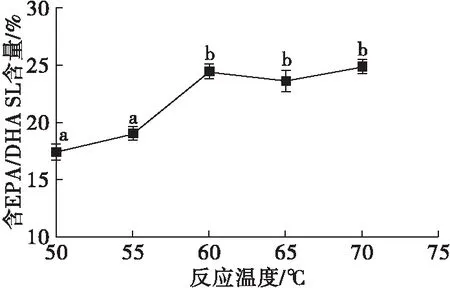
注:n(CCSKO)∶n(鱼油乙酯)=1∶1,反应时间8 h,酶载量10%。
由图2可知,反应温度从50℃升至60℃,含EPA/DHA SL含量从(17.39±0.57)%增加到(24.34±0.33)%,但随着反应温度继续升高,含EPA/DHA SL含量变化没有显著性差异。根据阿伦尼乌斯方程,反应温度对反应速率和反应动力学常数有直接影响[21]。反应温度升高可以降低TAG混合物的黏度,增加底物之间的相互作用,促进酯交换反应的快速平衡[22]。但较高温度可能会导致油脂氧化,影响产品质量。因此,确定最佳反应温度为60℃。
2.3 反应时间对酯交换反应的影响(见图3)
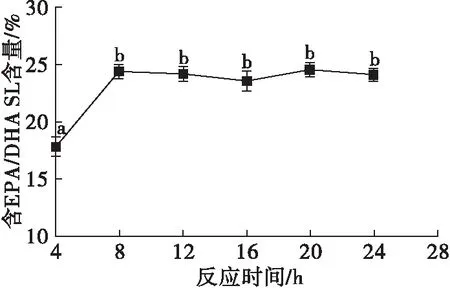
注:n(CCSKO)∶n(鱼油乙酯)=1∶1,反应温度60℃,酶载量10%。
由图3可知,8 h内含EPA/DHA SL含量明显增加,从4 h的(17.88±0.77)%增加到(24.34± 0.33)%。但当反应时间超过8 h后,含EPA/DHA SL含量变化不大,表明8 h时酯化反应基本达到平衡状态。Abed等[23]报道长时间高温反应可能致使SL的氧化和酰基迁移,且反应时间越长,EPA/DHA被氧化可能性越大。因此,选择8 h为最佳反应时间。
2.4 酶载量对酯交换反应的影响(见图4)
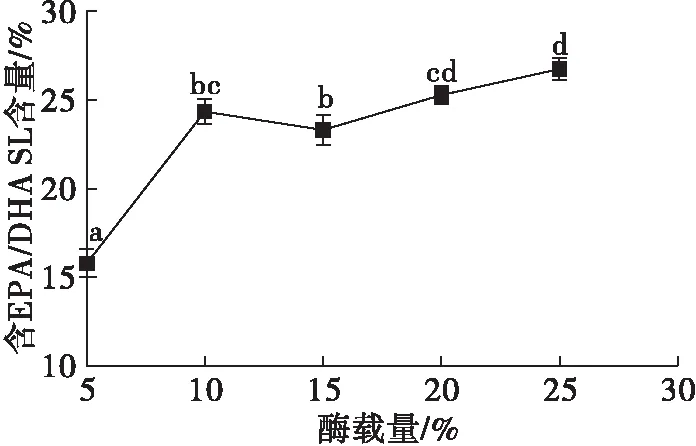
注:n(CCSKO)∶n(鱼油乙酯)=1∶1,反应温度60℃,反应时间8 h。
由图4可知,酶载量从5%增加到10%时,含EPA/DHA SL含量从(15.82±0.39)%增加至(24.34±0.33)%。酶载量增加,增大了底物与酶的接触机会,含EPA/DHA SL含量会有明显提高。酶载量超过10%,含EPA/DHA SL含量下降,但没有显著性差异,随后增加酶载量,含EPA/DHA SL含量缓慢增加,这是因为酯交换是一个复杂的可逆过程,酶载量的增加会促进酯交换的逆反应和水解反应[24]。考虑SL的产率和酶的成本,选择酶载量10%进行酯交换反应。
2.5 脂肪酶的操作稳定性
在最佳条件(底物摩尔比1∶1,反应温度60℃,反应时间8 h,酶载量10%)下进行Novozyme 435脂肪酶操作稳定性试验。结果见图5。
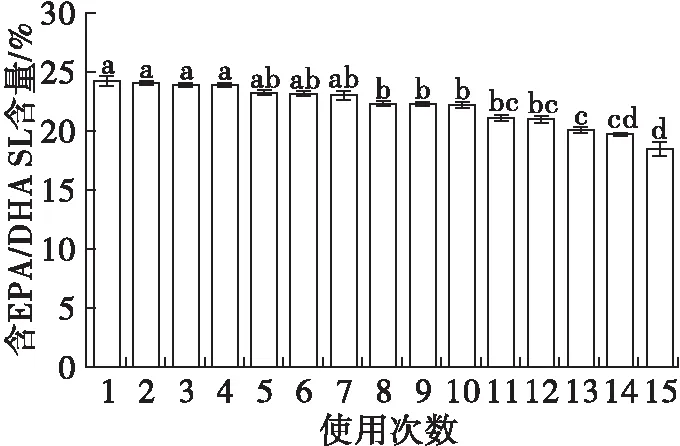
图5 Novozyme 435脂肪酶的操作稳定性
由图5可知,随着脂肪酶使用次数的增加,含EPA/DHA SL含量逐渐下降,即酶催化活力有一定降低。酯交换反应进行到15次时,反应产物中含EPA/DHA SL含量为(19.77±0.08)%,脂肪酶的活性依然高达初始活性的80%以上,表明在最佳反应条件下脂肪酶具有较好的操作稳定性,具有良好的工业化生产潜力。
2.6 放大试验
将酯交换反应按底物总量的5倍进行了放大,在上述最佳条件下进行3批放大试验。含EPA/DHA SL的含量为(23.55±0.63)%,与小试结果相似。过滤除去脂肪酶,储存于-20℃用于后续纯化。
2.7 CCSKO、鱼油乙酯、酯交换粗产物、分子蒸馏产物的脂肪酸组成及位置分布(见表1)
由表1可知,CCSKO脂肪酸主要包括癸酸(C10∶0)和月桂酸(C12∶0),CCSKO中不饱和脂肪酸含量仅为(2.53±0.46)%,主要为油酸和亚油酸,饱和脂肪酸含量高达(97.47±1.18)%。CCSKO在甘油骨架上的脂肪酸分布表明,Sn-2位和Sn-1,3位脂肪酸的组成和含量大致相同。鱼油乙酯中脂肪酸组成主要为EPA、DHA和亚油酸,未检出MFCA。与CCSKO相比较,酯交换粗产物中MCFA的含量降低到(48.95±0.14)%,不饱和脂肪酸含量升高到(48.14±0.11)%;分子蒸馏产物中MCFA含量降至(74.22±0.70)%,不饱和脂肪酸含量上升到(24.15±0.76)%,其中EPA和DHA含量分别为(11.91±0.44)%和(7.67±1.11)%。与酯交换粗产物相比,分子蒸馏产物中MCFA含量升高,不饱和脂肪酸含量降低,这是由于使用短程分子蒸馏去除了酯交换产物中脂肪酸乙酯和FFA。对分子蒸馏产物的脂肪酸位置组成分布分析发现,Sn-2位和Sn-1,3位的脂肪酸差异不显著,因为这是Novozyme 435是酯交换过程中的无位置选择性脂肪酶。
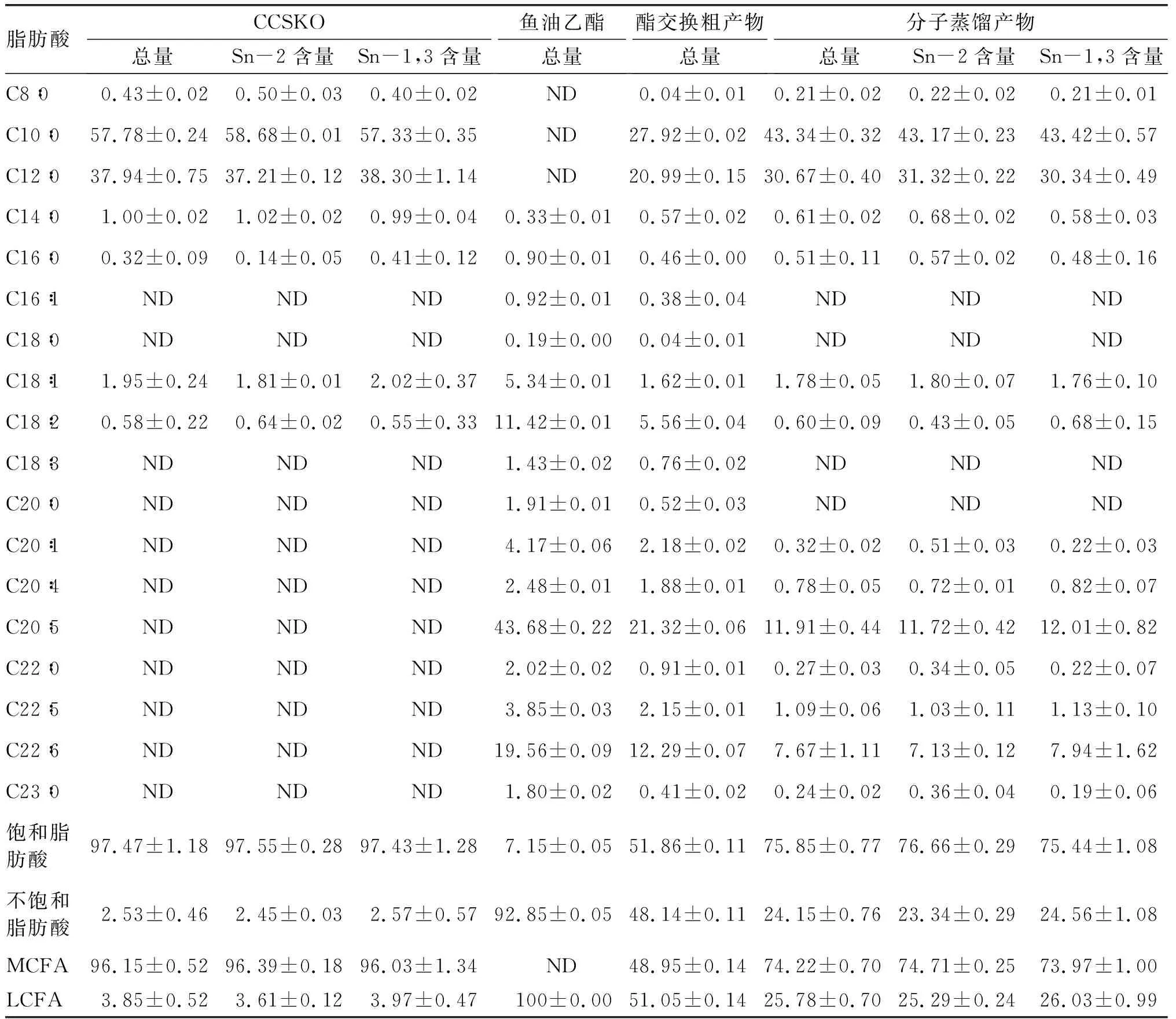
表1 CCSKO、鱼油乙酯、酯交换粗产物和分子蒸馏产物中脂肪酸组成及位置分布 %
2.8 CCSKO、酯交换粗产物、分子蒸馏产物组成及含量(见表2)
由表2可知,CCSKO主要由CCC((5.40±0.01)%)、CCLa((84.78±0.03)%)和MCC/CLaLa((9.82±0.01)%)组成,与Zhao等[25]报道相似。酯交换后,酯交换粗产物中这些TAG含量分别降到(5.15±0.02)%、(15.66±0.43)%和(7.09±0.36)%,脂肪酸乙酯总含量达(44.15±2.34)%,同时,生成了一些新的结构脂质,主要包括CC-EPA、CC-DHA、C-EPA-EPA、CLa-EPA、CLa-DHA和C-O-DHA,含量分别为(6.34±0.08)%、(3.35±0.06)%、(1.48±0.01)%、(6.59±0.27)%、(3.75±0.20)%和(1.85±0.11)%。分子蒸馏产物中未检出脂肪酸乙酯,CC-EPA、CC-DHA、C-EPA-EPA、CLa-EPA、CLa-DHA和C-O-DHA含量分别为(11.07±0.11)%、(6.71±0.21)%、(2.43±0.03)%、(7.78±0.51)%、(5.99±0.25)%和(1.83±0.06)%,结构脂质总含量高达(44.22±0.57)%。由于分子蒸馏去除了未反应的脂肪酸乙酯和FFA,分子蒸馏产物中结构脂质含量比酯交换粗产物高。这些结果表明,CCSKO与鱼油乙酯确实发生了酯交换反应,成功地合成了含EPA/DHA的结构脂质。酯交换粗产物经过分子蒸馏达到了纯化结构脂质的目的,使得结构脂质达到了较高的纯度。
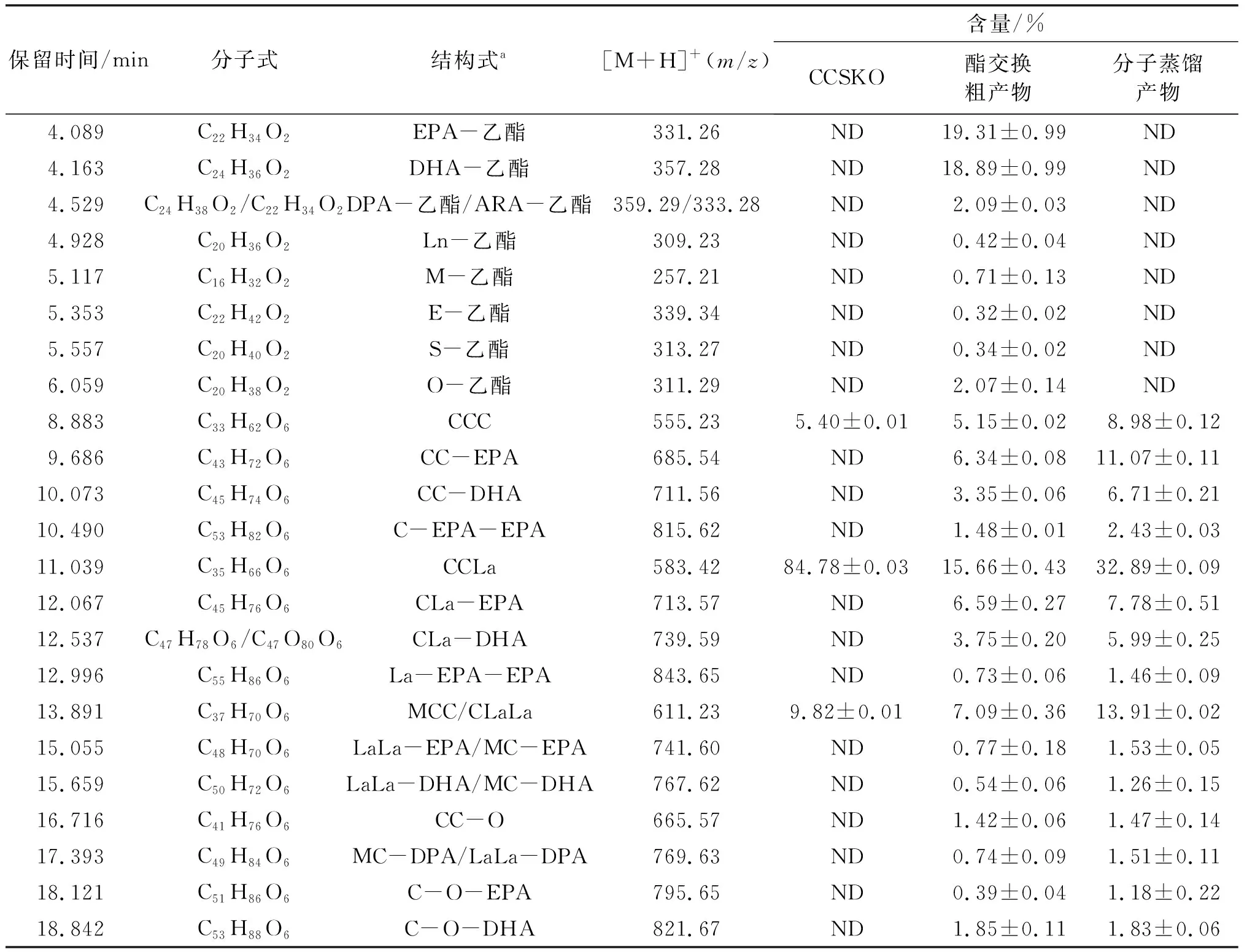
表2 HPLC-Q-TOF-MS测定油脂组成及含量
2.9 结构脂质的理化性质及体外抗氧化活性
2.9.1 理化性质
对分子蒸馏产物的理化性质进行测定,并与CCSKO、鱼油乙酯、酯交换粗产物进行对比,结果如表3所示。
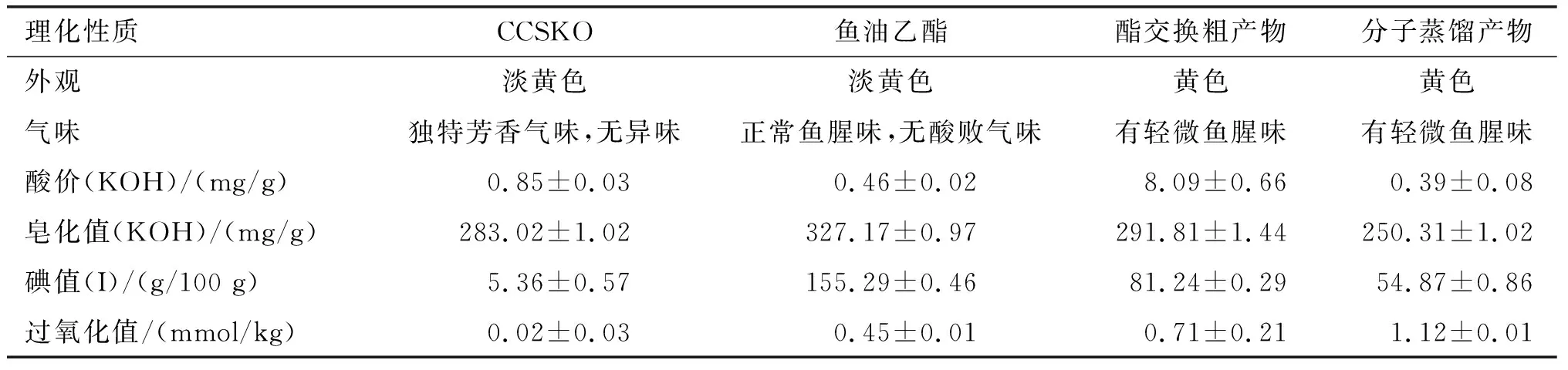
表3 CCSKO、鱼油乙酯、酯交换粗产物以及分子蒸馏产物的理化性质
由表3可知,分子蒸馏产物的颜色较CCSKO颜色略深些,带有轻微鱼腥味。分子蒸馏产物酸价(KOH)为(0.39±0.08)mg/g,较酯交换粗产物的低,说明分子蒸馏操作除去了酯交换粗产物中的FFA。CCSKO、鱼油乙酯、分子蒸馏产物的皂化值(KOH)分别为(283.02±1.02)mg/g、(327.17±0.97)mg/g、(250.31±1.02)mg/g。分子蒸馏产物的皂化值最小,表明其相对分子质量最大,说明分子蒸馏产物与CCSKO比较,其中含有较多大相对分子质量的ω-3多不饱和脂肪酸。分子蒸馏产物碘值(I)达到(54.87±0.86)g/100 g,比CCSKO的碘值高,说明分子蒸馏产物中包含了较多的不饱和脂肪酸,皂化值和碘值从侧面反映CCSKO和鱼油乙酯通过脂肪酶催化酯交换合成新的结构脂质。酯交换粗产物过氧化值为(0.71±0.21)mmol/kg,而分子蒸馏产物的过氧化值为(1.12±0.01)mmol/kg。这可能是分子蒸馏过程中温度稍高,控制不稳定,导致分子蒸馏产物氧化稳定性降低。综上所述,分子蒸馏产物具有良好的理化性质,各指标符合GB 15196—2015《食品安全国家标准 食用油脂制品》的有关规定,具有应用为食用油脂的潜力。
2.9.2 DPPH自由基清除能力(见图6)
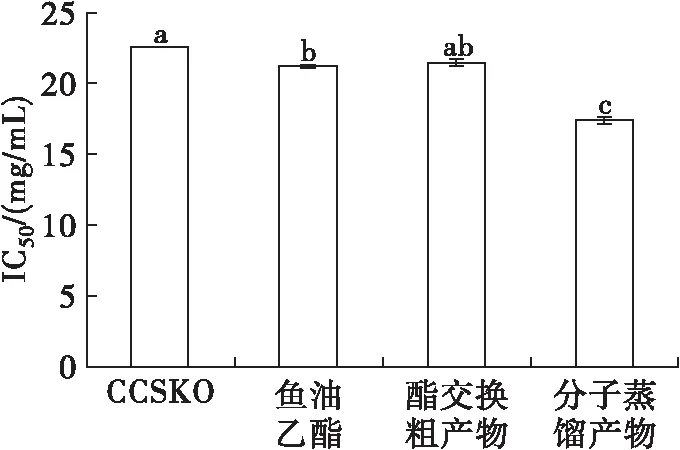
图6 油脂样品对DPPH自由基的清除能力
自由基与心血管、癌症、糖尿病等疾病产生及发展有密不可分的联系[26]。由图6可知,4种油脂的DPPH自由基清除能力的IC50值由大到小为:CCSKO ((18.04±0.04) mg/mL) > 酯交换粗产物((17.13±0.16)mg/mL)>鱼油乙酯((16.99±0.08) mg/mL) > 分子蒸馏产物((13.92±0.18)mg/mL),CCSKO的DPPH自由基清除能力最弱,分子蒸馏产物的最强。CCSKO中含有一定量α-生育酚、γ-生育酚和δ-生育酚[27],酯交换和分子蒸馏后,这些抗氧化物质浓度升高,产物的DPPH自由基清除能力增强。
2.9.3 ABTS自由基清除能力(见图7)
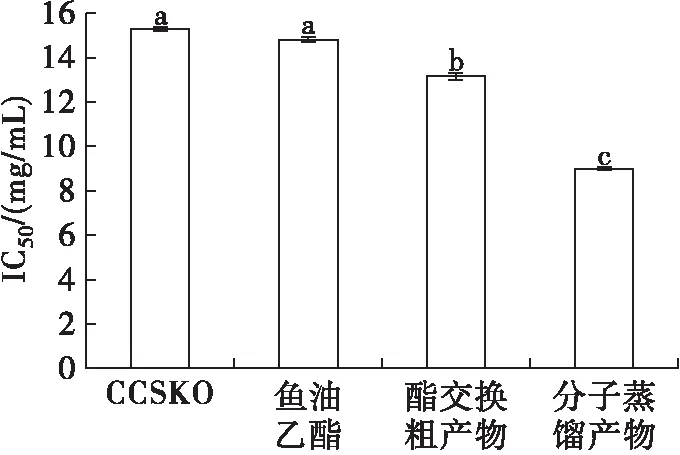
图7 油脂样品对ABTS自由基的清除能力
由图7可知,4种油脂的ABTS自由基清除能力IC50值由大到小为CCSKO ((15.28±0.10)mg/mL)>鱼油乙酯((14.79±0.10)mg/mL)> 酯交换粗产物((13.15±0.12)mg/mL) > 分子蒸馏产物((8.99±0.05)mg/mL)。分子蒸馏产物的IC50值最小,其ABTS自由基清除能力最强,这与DPPH自由基的清除能力趋势大致相同。分子蒸馏产物相比于原料油脂有更强的ABTS自由基清除能力。
3 结 论
本研究在无溶剂体系中通过脂肪酶Novozyme 435催化酯交换反应,成功将EPA/DHA掺入到CCSKO中制备成结构脂质。通过单因素试验研究各反应因素的影响,优化后的反应条件为:底物摩尔比1∶1,反应温度60℃,反应时间8 h,酶载量10%。在最佳反应条件下,含EPA/DHA SL含量为(24.34±0.33)%,且脂肪酶重复操作稳定性良好。分子蒸馏产物中的中、长碳链脂肪酸总含量比例约为3∶1,其中EPA和DHA含量分别为(11.91±0.44)%和(7.67±1.11)%。结构脂质中含量较高的TAG为CC-EPA((11.07±0.11)%)、CC-DHA((6.71±0.21)%)、CLa-EPA((7.78±0.51)%)和CLa-DHA((5.99±0.25)%)。分子蒸馏产物酸价(KOH)为(0.39±0.08)mg/g,皂化值(KOH)为(250.31±1.02)mg/g,碘值(I)为(54.87±0.86)g/100 g,过氧化值为(1.12±0.01)mmol/kg,对DPPH自由基及ABTS自由基的清除能力IC50值分别为(13.92±0.18)mg/mL及(8.99±0.05)mg/mL,表明分子蒸馏产物符合食用油脂制品的国家标准并具有一定的抗氧化能力。综上所述,酶法改性CCSKO,加入EPA/DHA合成一种新的结构脂质,可显著提高CCSKO的营养价值及理化性质,所合成的结构脂质具有在食品领域的应用潜力。
