内源性蛋白酶对花生蛋白纤维化凝胶的影响
2020-12-15张宏声陈业明华欲飞孔祥珍张彩猛李兴飞
张宏声,陈业明,华欲飞,孔祥珍,张彩猛,李兴飞
(江南大学 食品学院,江苏 无锡 214122)
许多食源蛋白,包括乳清蛋白[1]、大豆蛋白[2]、燕麦蛋白[3]和卵蛋白,已经被证实在pH 2和高温(80~90℃)下可发生纤维化,并通过静电作用、范德华力、氢键、疏水作用等相互作用形成凝胶。由于其优良的生物相容性和生物降解性,该凝胶可广泛应用于食品(如增稠)和药品(如生物活性成分的载体)领域。有研究表明,乳清蛋白纤维化后,黏度和凝胶性显著增强,在食品加工中可以作为良好的凝胶剂和增稠剂[4]。纤维化蛋白可对功能性成分起到保护、增溶和递送等作用[5]。纤维化蛋白还可运载抗肿瘤药物,实现对肿瘤的靶向治疗,也可以搭载检测材料,对肿瘤做早期诊断[6]。另外,科学家们已经利用纤维化蛋白开发出新一代生物传感器[7]。
研究证实蛋白质发生纤维化需要一个前提:蛋白需水解生成多肽产物——纤维化蛋白的组装单元[8]。Wilson等[9]研究发现,花生发芽过程中,内源性蛋白酶可水解自身蛋白。基于此,本研究将系统考察未发芽状态下花生内源性蛋白酶对于自身蛋白的水解作用,并考察多肽产物是否可形成纤维化蛋白。同时,考察蛋白质量浓度对于纤维化蛋白形成的影响。
1 材料与方法
1.1 实验材料
花生,购于山东聊城。浓盐酸、三羧基氨基甲烷、甲醇、甘油、十二烷基硫酸钠(SDS)、硫酸钾、硼酸、无水硫酸铜、浓硫酸,购于国药集团化学试剂有限公司;磷钨酸、抑肽素(Pepstatin A,天冬氨酸蛋白酶抑制剂),购于Sigma-Aldrich公司。
Himac CR21GⅡ型冷冻离心机,日本日立公司;MODEL BE-210 型垂直电泳仪,日本BIO CRAFT公司;凝胶成像仪,美国Bio-Rad公司;K9840半自动凯氏定氮仪;MCR301旋转流变仪,奥地利安东帕有限公司;Optima XPN型超速离心机,贝克曼库尔特商贸(中国)有限公司;Jem-2100型透射电子显微镜,日本电子株式会社。
1.2 实验方法
1.2.1 花生蛋白的制备
根据陈雅静[10]的方法,称取50 g花生,加入450 g去离子水,置于冰箱(4℃)浸泡18 h。手工去红衣后,去离子水清洗3次。去红衣花生仁中加去离子水至总质量300 g,15 000 r/min下打浆2 min,4层纱布过滤除渣,得到花生浆。花生浆通过离心(4℃,7 000 r/min,15 min)可分成上浮Ⅰ、清液Ⅰ和沉淀Ⅰ。离心可使花生浆中的大部分油脂进入上浮Ⅰ,淀粉等颗粒状成分进入沉淀Ⅰ,而蛋白成分主要集中在清液Ⅰ中。
对清液Ⅰ进行超速离心(4℃,50 000 r/min,30 min),可分成一层薄薄的上浮Ⅱ(清液Ⅰ中的残留油脂)、清液Ⅱ(清液I中的可溶性糖、离子、游离氨基酸和小肽等成分)和沉淀Ⅱ(主要为花生球蛋白)。沉淀Ⅱ的蛋白质含量为50.14%(凯氏定氮法),为本研究的花生蛋白原料。在沉淀Ⅱ中加入去离子水,配成100、50 g/L和25 g/L的花生蛋白溶液。溶液呈现透明状态,说明油脂脱除充分。
1.2.2 pH对内源性蛋白酶水解花生蛋白的影响
将25 g/L蛋白溶液分成6等份,利用1 mol/L盐酸溶液将其pH分别调至 7、6、5、4、3、2,并于60℃(本研究室已确定的内源性蛋白酶活性的较佳温度条件)水浴水解4 h,冷却至室温,作为Tricine-SDS-PAGE分析的样品。
1.2.3 Tricine-SDS-PAGE分析
将1.2.2所得样品的蛋白质量浓度调节为4 mg/mL,并取500 μL加入等体积电泳样品溶解液搅拌均匀,加入2%二硫苏糖醇(DTT)搅匀,沸水浴中热处理5 min,冷却至室温即可上样。
电泳胶的浓缩胶4%,分离胶16%。样品在进入浓缩胶之前电压为30 V,进入分离胶后电压调为100 V。电泳指示剂距分离胶前沿0.5 cm时关闭电泳仪,进行固定、染色、脱色。用凝胶成像仪拍照,Image Lab 4.0.1软件分析条带的强度。
1.2.4 花生蛋白纤维化pH条件的初探
将50 g/L蛋白溶液分成6等份,利用1 mol/L或2 mol/L的盐酸溶液将其pH分别调至7、6、5、4、3、2,在60℃水浴水解12 h,放入冰水浴,观察凝胶形成情况。
1.2.5 花生蛋白纤维化与内源性蛋白酶之间关系的确认
将100 g/L蛋白溶液分成2等份,一份中加入抑肽素(Pepstatin A)至终浓度为100 μmol/L,另一份作为对照。用2 mol/L的盐酸溶液将上述溶液调节至pH 3,在60℃水浴热处理,并在0、6、12 h和24 h时,取样置于冰水浴冷却,随后置于4℃保存。
利用上述对照样品的方法,将50 g/L和25 g/L的蛋白溶液进行处理,考察蛋白质量浓度对花生蛋白纤维化的影响。
1.2.6 透射电子显微镜观察
将待测样品用pH 3的盐酸溶液稀释至蛋白质量浓度为0.25 g/L,同时将未水解花生蛋白稀释至蛋白质量浓度10 g/L并调节pH为3。将稀释的样品滴加到专用铜网的碳膜上,尽量摊平,15 s后用滤纸吸去多余的液体,用1 mg/mL的磷钨酸溶液进行处理,15 s后用滤纸再次吸去多余液体,放入常温干燥箱干燥,待样品干燥后进行透射电子显微镜观察,操作电压为200 kV。
1.2.7 黏度分析
利用旋转流变仪分析黏度。测定参数为:剪切速率变化范围0.1~100 s-1,测试过程中记录剪切应力,每10 s记录一个点,共计60个点。根据Ostwald-Dewaele方程对黏度曲线进行拟合,按下式计算蛋白溶液的表观黏度。
ηa=kγn-1
(1)
式中:ηa为蛋白溶液表观黏度,Pa·s;γ为剪切速率,s-1;k为黏度系数;n为流变指数。n-1 小于0说明体系为假塑性流体(剪切变稀);k值越大,体系黏度越大。
1.2.8 数据处理
实验数据测定3次,使用Excel 2016处理数据求平均值,使用Origin8.5拟合曲线和绘图。
2 结果与分析
2.1 pH对内源性蛋白酶水解花生蛋白的影响(见图1)
由图1可知,制备所得花生蛋白(泳道C的未处理花生蛋白)的主要成分为Ara h 1(66 kDa)和花生球蛋白(42 kDa条带为球蛋白酸性肽链,21 kDa条带为球蛋白碱性肽链)。在pH 2~5的范围内, Ara h 1发生明显的降解,尤其是在pH 3。Wilson等[9]发现花生种子中内源性天冬氨酸蛋白酶可有效水解Ara h 1,在pH 2.6~3时水解活性最强,与本研究相符。花生球蛋白的酸性肽链(42 kDa)和碱性肽链(21 kDa)在pH 2时降解最多,但降解程度不大,pH 3时次之,其他pH不明显。在pH 3时,出现了最多的新条带和强度增强的条带(箭头),是花生蛋白酶解形成的多肽产物,相对分子质量分别为25、19、17、13 kDa和12 kDa。
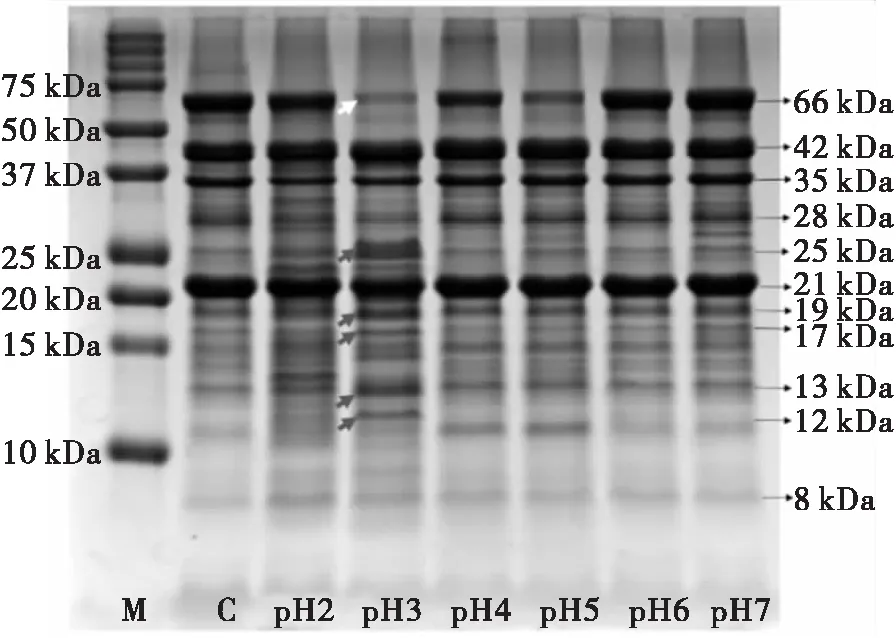
注:M.蛋白质标准品;C.未处理花生蛋白;pH 2~pH 7.相应pH下60℃水解4 h的花生蛋白溶液。
2.2 花生蛋白纤维化pH条件的初探
按1.2.4方法对50 g/L花生蛋白溶液进行60℃水浴水解12 h及冰水浴处理,结果显示,蛋白溶液只能在pH 3条件下形成透明状的凝胶,这应与pH 3时形成最多的多肽产物相关。另外,透明状凝胶的形成基本可说明花生蛋白纤维化的发生,此结果将在后续的研究中进行证明。后续研究将在pH 3和 60℃条件下进行。
2.3 花生蛋白纤维化与内源性蛋白酶之间关系的确认
首先,利用Tricine-SDS-PAGE考察了抑肽素对内源性蛋白酶水解花生蛋白的影响,结果如图2所示。
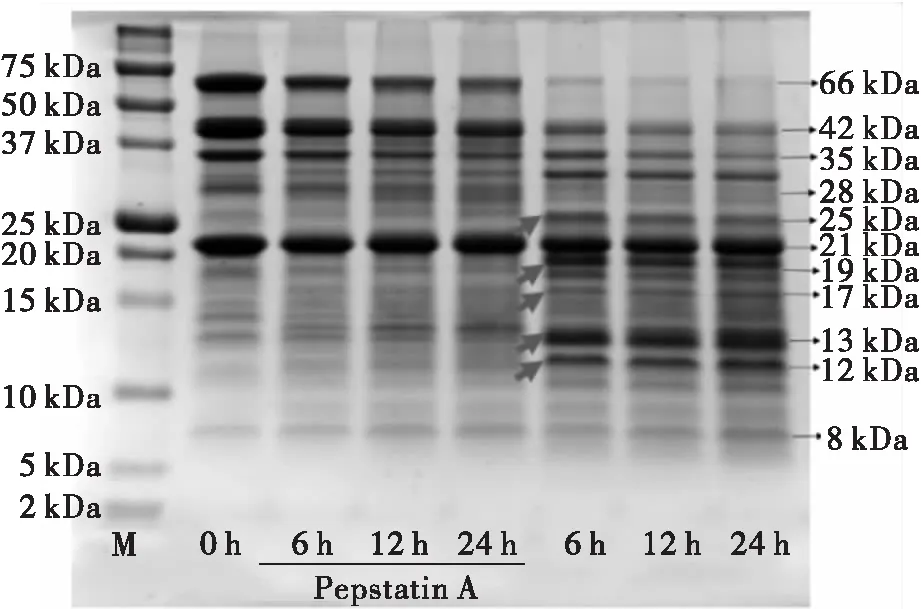
注:M.蛋白质标准品。
由图2可知,抑肽素可明显抑制Ara h 1和花生球蛋白的水解,但是Ara h 1和花生球蛋白还是发生了一定程度的水解。这与以下3个因素相关:①未被抑肽素抑制的天冬氨酸蛋白酶的水解作用;②其他种类的内源性蛋白酶的水解作用;③酸水解作用。对于第2个因素,是因为我们发现丝氨酸蛋白酶抑制剂和巯基蛋白酶抑制剂也具有一定的酶水解抑制作用。图2显示,未添加抑肽素的对照样品水解形成的多肽产物与图1相同。结果说明,在pH 3和60℃条件下,主要是天冬氨酸蛋白酶的水解作用生成多肽产物(25、19、17、13 kDa和12 kDa),而只有少量的酸水解。该结论也可由图1的结果所支持,因为pH 3时生成的多肽产物很有限和有规律。而酸水解比较随机,多肽产物多种多样。水解24 h和冰水浴后,添加抑肽素的100 g/L蛋白体系依然呈现流动状态,而对照样品则是结实的透明凝胶状态。另外,水解6 h的对照样品也形成了结实的透明凝胶。
蛋白质形成纤维状结构后,其长径比将急剧增大。与蛋白质聚集体相比,纤维状结构可更有效地形成物理缠结网络,从而可急剧增大体系的黏度[11]。因此,本研究通过测定花生蛋白溶液热处理过程中的黏度变化,初步确定花生蛋白是否发生了纤维化,结果见图3。
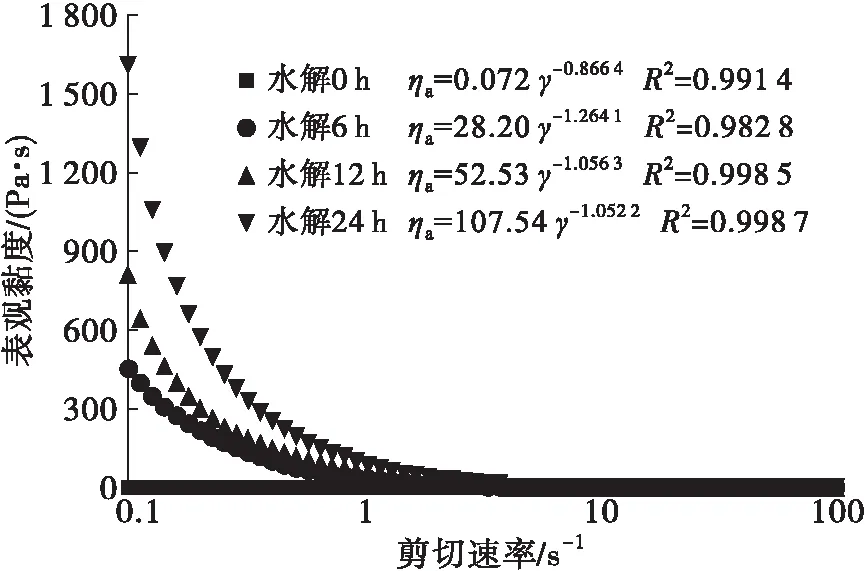
注:反应体系为100 g/L蛋白溶液。
由图3可知,花生蛋白溶液的初始黏度系数k为0.072,6 h后k增加至28.20。此时,将花生蛋白体系置于冰水浴冷却,即可形成透明凝胶。随时间延长,蛋白体系的黏度持续增加,24 h后k为107.54。该结果明确显示,蛋白体系黏度发生了急剧的增大,与Mohammadian[12]、Zhang[13]等的研究结果相似。图4为蛋白溶液体系加入抑肽素后体系黏度变化情况。
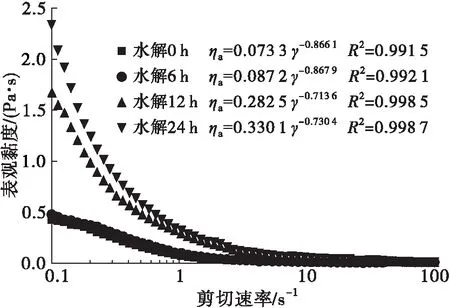
注:反应体系为100 g/L蛋白溶液。
由图4可知,添加抑肽素的蛋白溶液体系初始黏度系数k为0.073 3,6 h后k为0.087 2,即使是24 h后,k也仅为0.330 1。以上结果分析可知:在pH 3和60℃条件下,酸水解作用非常微弱,内源性蛋白酶导致的蛋白水解是多肽产物生成的主导因素,与上述推论相符;另外,可初步确定形成的透明凝胶是纤维状微结构。
2.4 花生蛋白透明凝胶的微观结构(见图5)
由图5可知,未水解的样品主要是一些球状的蛋白,大小在10 nm左右,与花生球蛋白尺寸大小相当,说明花生球蛋白基本保持原始的球状结构。水解12 h的蛋白体系中,蛋白组装形成了长度大于1 μm、直径小于10 nm的纤维状结构,纤维之间出现了一些交叉和相互作用。水解24 h的蛋白体系中,纤维状结构出现增长的趋势,并且相互之间交错缠结。Sasso等[14]制备的乳清蛋白纤维长度在1~10 μm,直径在2~10 nm的范围内。大豆分离蛋白[15]、菜豆蛋白[16]、酪蛋白[17]和米糠蛋白[13]等自组装形成纤维的长度与直径基本都在此范围内。这些结果明确说明,在pH 3和60℃条件下,内源性蛋白酶导致的花生蛋白水解,可形成纤维状结构的透明凝胶,其结构与pH 2和80~90℃条件下得到的纤维状结构相似。

注:反应体系为100 g/L蛋白溶液;反应条件为pH 3和60℃。
2.5 蛋白质量浓度对花生蛋白纤维化的影响(见图6)
Veerman等[18]认为蛋白浓度增大,则意味着组装单元的浓度增大,从而增大了组装单元相互作用的概率,有利于蛋白纤维化。
由图6可知,蛋白质量浓度为50 g/L时,体系初始黏度系数k为0.068,6 h后k为14.19,12 h后k为29.73,24 h后k为57.95。12 h的样品在冰水浴静置后,可形成透明凝胶。该结果说明,50 g/L蛋白溶液体系可形成纤维状结构的凝胶。蛋白质量浓度为25 g/L时,体系的初始黏度系数k为0.086 6,6 h后k为0.087 6,12 h后k为0.088 8,24 h后k为0.089 6。24 h的样品在冰水浴静置后,依然呈现液体状态,说明25 g/L蛋白溶液体系不能形成纤维状结构。
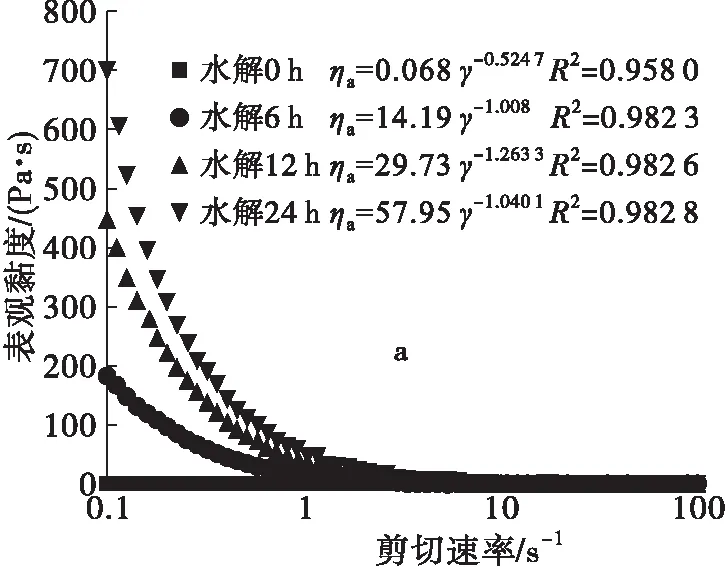

注:a.反应体系为50 g/L蛋白溶液;b.反应体系为25 g/L蛋白溶液;反应条件为pH 3和60℃。
3 结 论
研究发现,在pH 3和60℃时,内源性蛋白酶对花生蛋白的水解作用最强,可生成相对分子质量分别为25、19、17、13 kDa和12 kDa的多肽产物。此时,起主要水解作用的是天冬氨酸蛋白酶。在蛋白质量浓度为100 g/L时,水解6 h后可形成纤维化结构的透明凝胶,水解12 h蛋白纤维的直径小于10 nm,长度超过1 μm。内源性蛋白酶水解花生蛋白对上述凝胶形成起主导作用,酸水解作用(pH 3、60℃)非常微弱。蛋白质量浓度对于纤维化凝胶形成影响较大,在花生蛋白质量浓度为50 g/L和100 g/L时可形成凝胶,浓度越大,形成时间越短;蛋白质量浓度为25 g/L时水解24 h也不能形成凝胶,黏度几乎不变。
