根霉脂肪酶系统分离优化实验研究
2015-01-16张红亚赵纪耀陈四华
孟 军,张红亚,张 勇,赵纪耀,王 涛,陈四华
(安徽建筑大学 环境与能源工程学院/水污染控制与废水资源化省级重点实验室,安徽 合肥 230022)
根霉脂肪酶系统分离优化实验研究
孟 军,张红亚,张 勇,赵纪耀,王 涛,陈四华
(安徽建筑大学 环境与能源工程学院/水污染控制与废水资源化省级重点实验室,安徽 合肥 230022)
利用固态发酵法生产根霉脂肪酶,对影响此酶分离的多种条件进行了优化研究,其中包括浸提固液比、浸提时间、硫酸铵饱和度和分子排阻凝胶层析的洗脱流速。得出了优化后条件为浸提固液比为1∶3,浸提时间为120 min,硫酸铵饱和度为40%,洗脱流速为1.5 mL/min的结论。
脂肪酶;柱层析;系统分离
1 引言
脂肪酶是一类特殊的酯键水解酶,可将脂肪分解成甘油和脂肪酸,机理主要是脂肪酶对甘油三酸酯的催化水解反应是亲核反应,脂肪酶也是一种弱的亲核试剂[1]。脂肪酶广泛应用于食品、轻纺、皮革、精细化工、有机合成、医药等领域[2~4]。根霉属微生物是脂肪酶的重要生产菌,从根霉菌中已分离到30多种脂肪酶,且有多种根霉脂肪酶已被制成商品化酶制剂[5]。此外,根霉脂肪酶大多具有高度的1、3位置专一性,因而常用于油脂加工,以提高油脂的品质[6]。
目前,脂肪酶的分离纯化方法主要有双水相萃取分离法[7]、膜分离法[8]、硫酸铵—丙酮协同法[9]、免疫纯化法[10]、界面亲和层析法[11]。但这些方法都有各自的缺点,如双水相萃取分离法的关键是找到与该种脂肪酶对应的双水相;膜分离法存在易堵塞的现象,重复使用率不高;硫酸铵—丙酮协同法有酶回收率较低的现象;免疫纯化法是一种价格较昂贵的方法;界面亲和层析法的载体较昂贵,机械强度低[12]。
本实验根霉脂肪酶成功筛选的基础上进一步对该酶的分离纯化方法进行研究,旨在找出一种分离步骤少,方法简单,成本低廉,分离能力强的分离纯化方法,为该类脂肪酶性质的研究开拓道路。
2 实验的材料与方法
菌种:实验室自筛根霉。
仪器与设备:蛋白质纯化仪(GE公司)。
2.1 粗脂肪酶液制备
培养基:斜面培养基;产孢培养基;产酶基础培养基[13]。
粗脂肪酶液的制备:根霉菌株接种于斜面培养基,置于28 ℃恒温箱中培养96 h,转至产孢培养基,置于28 ℃恒温箱中培养96 h,转至产酶基础培养基,于250 mL三角烧瓶中,28 ℃培养96 h,后用离子浓度为1/15 mol/L的磷酸盐缓冲液浸提后既得脂肪酶液。
2.2 酶活力的测定及活力单位定义
脂肪酶活力的测定及酶活定义参见Gandhi N N[14]等。
2.3 固液比的优化
称量130 g经过发酵的固体发酵培养基并研碎后均分成五份,放在五个三角烧瓶中,分别按固液比1∶1、1∶2、1∶3、1∶4、1∶5顺序加入pH值为7.5的磷酸盐缓冲液浸提酶液,时间为4 h,然后测定各瓶浸提液中的酶活并记录。
2.4 浸提时间的优化
称量26 g的经过发酵的固体培养基并用将其研碎,后加入90 mL缓冲液浸提,开始计时,每隔0.5 h测一次浸提液的酶活力。
2.5 硫酸铵盐析饱和度的优化
取五份脂肪酶液,每份为100 mL,分别按10%,20%,30%,40%,50%饱合度加入粉末状的硫酸铵盐后,搅拌均匀,在5 000 r/min离心15 min,沉淀用pH值为7.5的磷酸盐缓冲液10 mL溶解。分别测定上清液和其对应的沉淀的酶活为U1,U2。
2.6 Sephacryl S-300 HR 柱层析洗脱流速的优化
粗分离得到的脂肪酶样品经透析袋透析后取1 mL样,在10 000 r/min下离心15 min,然后上样进行分析,洗脱速度分别采用0.5 mL/min、1.0 mL/min、1.5 mL/min,2.0 mL/min,2.5 mL/min。在紫外280 nm下监测记录峰形,收集最高峰对应的流出液,检测其脂肪酶酶活。
3 结果与分析
3.1 脂肪酶粗分离的浸提固液比
从图1中可以看出,随着浸提固液比的增大,溶解在浸提液中脂肪酶的酶活力逐渐升高,固液比为1∶3时浸提液中脂肪酶的酶活力最高,以后随着浸提固液比的增大,浸提液中酶活力逐渐变小,为了脂肪酶能够最大程度的溶解在浸提液和减少脂肪酶下游分离的难度,该固体发酵脂肪酶的最佳浸提固液比为1∶3。
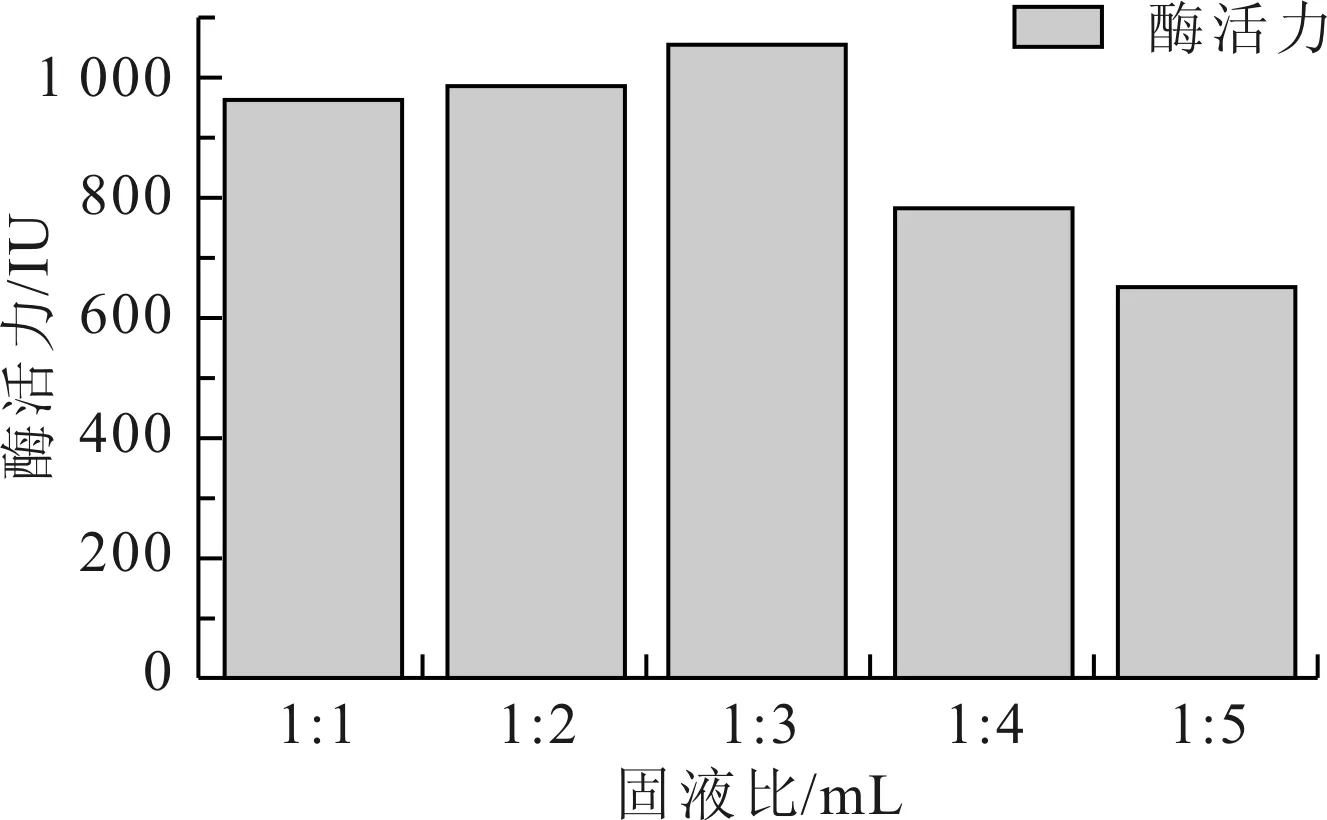
图1 浸提固液比对提取脂肪酶的影响
3.2 脂肪酶粗分离的最优浸提时间
从图2中可以看出从120 min起到180 min时,溶解在浸提液中脂肪酶的量已经稳定。在120 min后,浸提液中酶活力没有变化,所以浸提120 min就可以提取培养基中的大部分脂肪酶,可定120 min浸提时间为最优浸提时间。

图2 浸提时间对提取脂肪酶的影响
3.3 硫酸铵分级沉淀最佳饱和度的确定
在硫酸铵饱和度梯度下分离的脂肪酶液,所对应的上清液和沉淀的酶活力结果见图3,由图可知随着硫酸铵饱和度的升高,上清液的酶活力逐渐降低,沉淀部分的酶活力逐渐升高,从40%硫酸铵饱和度开始,脂肪酶分离得到的上清液就未检测到酶活,而沉淀部分的酶活趋于稳定,所以最佳硫酸铵饱和度为40%。

图3 硫酸铵饱和度对分离脂肪酶的影响
3.4 Sephacryl S-300 HR柱层析分离脂肪酶最佳洗脱流速的测定
从图4中可以看出,Sephacryl S-300 HR柱层析在选定的五个洗脱流速下都可以分离得到纯的脂肪酶。随着洗脱流速的增加,分离得到的酶液酶活力也是逐渐增高,在洗脱流速达到1.5 mL/min时,分离的酶液酶活力达到最高,后随着洗脱流速的增大,分离的酶液酶活力反而变小,同时与光吸收的变化也是一致的。在洗脱流速为1.5 mL/min时,280 nm紫外光下收集的分离液不仅光吸收值最大,而且脂肪酶活力最高,从而可以得出洗脱流速为1.5mL/min时为Sephacryl S-300 HR柱层析纯化粗脂肪酶的最佳洗脱流速。
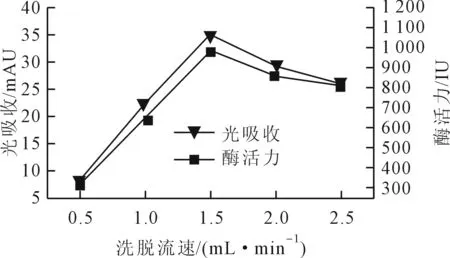
图4 柱层析的洗脱流速对分离脂肪酶的影响
4 结语
本文对根霉脂肪酶分离实验进行系统优化。经实验测得最佳浸提固液比为1∶3,最优浸提时间为120 min,在40%饱和度的硫酸铵可使脂肪酶沉淀达到最大。最后选用美国GE公司的蛋白质纯化仪配置的Sephacryl-S 300HR柱层析,优化了洗脱流速,最佳洗脱流速为1.5 mL/min。
从实验中发现,该菌产酶量低,通过Sephacryl-S 300HR洗脱下来的脂肪酶不能直接检测,只能采取冷冻干燥后检测酶活。这也使得我们的实验进展延迟,没能继续对纯酶的性质进行研究。建议以后可以对根霉菌的发酵培养基进行优化提高产酶量,也可以尝试通过各种诱变方法提高产酶量。
[1]Khare S K,Nakajima . Immobilization of Rhizopus japonicus lipase on celite and its application for enrichment of docosahexaenoic acid in soybean oil[J].Food Chemistry ,2000,68:153~157.
[2]彭立凤.微生物脂肪酶的应用[J].生物工程进展,1999,19(5):61~65.
[3]马歌丽,高建奇,张志刚,等.根霉脂肪酶产生菌筛选及发酵培养基研究[J]. 饲料工业,2006,27(22).
[4]Patel R. N., Biocatalysis: Synthesis of Chiral Intermediates for Pharmaceuticals[J].Current Org.Chem,2006(10):1289~1321.
[5]逄淑召,王 群,王 智,等.荧光假单孢菌Pseudomonas fluorescence 5963产脂肪酶条件的优化[J].生物加工过程,2004(1):62~65.
[6]颜兴和,王 栋,徐 岩.根霉脂肪酶的研究进展[J].工业微生物,2005,35(3):45~49.
[7]杨建军,马晓迅.双水相系统分离纯化南极假丝酵母脂肪酶[J].化学工程,2009,37(5):49~52.
[8]鞠辉军,汪学军,刘均洪.微生物脂肪酶的纯化方法[J].河南化工,2004(6):1~3.
[9]李燕妮,曹红光.硫酸铵-丙酮协同沉淀法纯化南极假丝酵母产脂肪酶[J].化学与生物工程,2006(5):36~37,48.
[10]阎金勇,丁 双,杨江科,等.微生物酶分离纯化研究进展[J].现代化工,2007(6):19~23.
[11]Baisida A,Sabuquilo P,Amisen P,etal A single step purification immobilization and hyperactivation of lipases via interfacial absorption on strongly hydrophobic supports[J].Biotechnol and Bioeng,1998,58(5):486~493.
[12]兰立新,肖怀秋.微生物脂肪酶生物学特性及分离纯化研究进展[J].江苏调味副食品,2009(5):1~5.
[13]刘 斌,蔡敬民,吴茜茜,等.根霉产脂肪酶液态发酵条件及部分酶学性质研究[J].安徽农业科学,2003(6):992~993,1002.
[14]Gandhi N N,Sawant S B ,Joshi J B.Study on the lipozyme-catalyzed synthesis of butyl laurate[J].Biotechnol Bioeng,1995(46):1~12.
Research on the Optimization of SystematicSeparationof Rhizopus Chinensis Lipase
Meng Jun, Zhang Hongya, Zhang Yong, Zhao Jiyao, Wang Tao, Chen Sihua
((1.SchoolofEnvironmentandEnergyEngineering,AnhuiJianzhuUniversity/ProvincialKeyLaboratoryofWaterPollutionControlandwastewaterresourcesregeneration,Hefei230022,China)
By using solid state fermentation, the article aims to produce rhizopus lipases and researches on a variety of conditions that affect this enzyme separation, whichincludethe solid-to-liquidof extraction, time of extraction, saturation of ammonium sulfateand elution flow rate of molecular exclusion gel chromatography. After Optimization,theconditionsare that the solid-to-liquid ratiois 1∶3,time of extraction is 120 minutes,saturation of ammonium sulfate is 40% and elution flow rate is1.5mL/min.
lipase; column chromatography; systematic separation
2015-10-29
孟 军(1988—),男,安徽合肥人,硕士研究生,主要从事水处理理论与技术研究。
Q556
A
1674-9944(2015)12-0277-02
