右心室前乳头肌和调节束结合部起源室性心律失常的心电图和心内电生理特点
2020-12-12蒋晨曦马长生龙德勇姚艳桑才华李松南郭雪原杜昕董建增
蒋晨曦 马长生 龙德勇 姚艳 桑才华 李松南 郭雪原 杜昕 董建增
右心室起源的特发性室性心律失常以流出道或三尖瓣环最为多见,而其他部位起源者仅占10%以下[1]。而在传统的X线影像或心脏三维电解剖标测系统指导下对乳头肌等非典型部位的解剖结构无法准确定位,相关临床经验和研究较少。近年来随着心腔内超声(intracardiac echocardiography,ICE)技术的应用,乳头肌起源的室性心律失常得到了越来越多的关注[2]。调节束(moderator band,MB)为走行于右心室腔内、连接其间隔侧和游离壁侧的条索状肌束。而前乳头肌(anterior papillary muscle,APM)是三尖瓣乳头肌系统中最发达、形态位置最恒定的一组[3],其顶部连接三尖瓣前侧壁腱索,而根部与MB游离壁侧插入点相连(图1)。APM-MB结合部为这两大肌性结构的交界处,且有右束支(right bundle branch,RBB)-浦肯野纤维系统走行,其解剖和电生理条件有其特殊之处。在临床实践中发现与邻近部位如APM体部相比,本研究旨在分析该部位起源室性心律失常的心电图和标测存在一定特点。
1 对象与方法
1.1 研究对象
本研究纳入2017年7月至2019年6月于首都医科大学附属北京安贞医院行电生理检查及导管消融术的8例起源于APM-MB结合部的室性心律失常患者,另外2例起源于APM体部患者为心电图特点比较。所有患者均除外器质性心脏病。本研究符合赫尔辛基宣言要求并通过北京安贞医院伦理委员会伦理审查,所有患者均签署知情同意书。
1.2 解剖模型构建
术前停用除胺碘酮以外的抗心律失常药5个半衰期以上,停用胺碘酮3个月以上。术中不常规使用镇静及麻醉药物。在心脏三维电解剖标测系统和ICE(CARTOSOUND,Biosense Webster)引导下构建右心室及其腔内结构模型。建模、标测和消融均以3.5 mm冷盐水灌注标测及射频消融导管(NaviStar SmartTouch,Biosense Webster)完成,并使用可调弯鞘(Agilis NxT,St Jude Medical)置于三尖瓣环水平以增加标测导管消融在右心室内操作的稳定性。
将10 F ICE探头(So u ndSt a r,Biose nse Webster)置入右心室内以准确显示其各腔内结构位置并指导标测消融导管操作。这些结构的构建和导管在这一区域的导航以APM长轴扇面为主,将ICE探头置于室上嵴水平,扇面指向心尖方向,通过旋转超声扇面调整其偏向间隔侧或游离壁侧(图2)。如该扇面上可同时显示APM长轴及MB游离壁侧,其交界处即为APM-MB结合部。如该扇面仅显示MB短轴面,则需逆时针调整扇面使其更偏向游离壁侧直至APM显现。
1.3 电生理检查和导管消融
于上述解剖模型构建完成后,在室性期前收缩(premature ventricular contraction,PVC)或室性心动过速(ventricular tachycardia,VT)发作时行激动标测寻找其最早激动点。无自发PVC或VT即予异丙肾上腺素(0.5~2.0 g/min)并予右心室心尖或流出道程序刺激诱发。激动标测在CARTOSOUND系统引导下进行。在最早点及邻近部位行起搏标测,初始刺激输出为5 mA、脉宽2 ms,如不能夺获局部心肌则增加至10 mA或20 mA。
确定最早点后予35 W、冷盐水流速17 ml/min功率模式释放射频能量。射频能量发放5 s以内PVC消失或VT终止者视为有效消融靶点,并于该处巩固消融60 s。如PVC或VT仍存在,则继续进行激动标测寻找最早激动点并予消融。消融终点为等待30 min、并予异丙肾上腺素及右心室心尖及流出道程序刺激无PVC或VT发作。所有患者随访6个月以上,术后3个月内每月行经胸超声心动图及24 h动态心电图检查,此后每6个月重复上述检查。
1.4 统计学分析
所有数据采用SPSS 25.0软件进行统计分析。所有符合正态分布的连续变量以平均值±标准差表示,不符合正态分布的变量以例(比)表示。连续变量符合正态分布者以Studentt检验进行比较,不符合正态分布者以非参数Mann-WhitneyU检验进行比较。分类变量以χ2检验或Fisher确切概率法进行比较。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
入选本研究的8例APM-MB起源室性心律失常患者年龄为(42.6±14.3)岁,6例(6/8)为男性。室性心律失常均表现为频发PVC、短阵VT,未记录到持续30 s以上VT发作,无心室颤动、其他血流动力学不稳定心律失常或猝死病史。所有患者临床病史、体格检查及心电图、胸部X线影像、超声心动图均无器质性心脏病证据,左心室舒张末期内径和左心室射血分数均正常。1例患者既往曾因同种形态PVC行射频消融术未成功,其他7例患者均为初次消融。
2.2 心电图特点
图3 所示为A P M-M B 结合部窦性心律和PVC时QRS波形态。PVC时QRS波时限为133~161(143.1±11.1)ms,类本位曲折时间(intrinscoid deflection time,IDT)为46~58(51.1±3.7)ms,最大曲折指数(maximum deflection time,MDI)为(0.36±0.40)。所有患者QRS波均表现为左束支传导阻滞(left bundle branch block,LBBB)图形,胸前导联(简称“胸导”)移行均晚于V5,且均晚于窦性心律,V6导联QRS波振幅低于窦性心律 [(0.51±0.14)mV比(0.90±0.21)mV,P<0.001]且差异有统计学意义。肢体导联(简称“肢导”)额面电轴指向左上方,故Ⅰ、aVL导联QRS波主波均为正向,Ⅱ、Ⅲ、aVF导联则以负向为主。而所有患者下壁导联中至少有一个导联QRS波下降支可见切迹。与之相比,2例起源于APM体部的PVC患者其心电图也具有上述QRS波窄、IDT短、胸导移行晚、肢导电轴指向左上等特征,但其下壁导联下降支均无切迹。
2.3 激动标测和起搏标测特点
8例患者中ICE探头置于室上嵴、对向心尖方向的APM长轴扇面均可准确定位APM-MB结合部,并与APM体部或MB体部等邻近部位相区分。于APM-MB结合部记录到最早激动点提前体表QRS波起点12~25 (18.5±4.9)ms(表1)。5例(5/8)于局部V波之前可见浦肯野电位(purkinje potential,PP),但其中仅2例于窦性心律下也可见PP(图4~5)。所有患者于最早激动点处均未见碎裂电位或其他收缩期前电位。所有患者于最早激动点处起搏标测12/12导联或11/12导联形态相同,且下壁导联下降支均可见切迹,但于APM体部起搏时仅4例可见切迹(8/8比4/8,P<0.001)。

图1 前乳头肌-调节束结合部解剖结构 图示为CARTOSOUND 系统重建的右心室(灰色)、前乳头肌(浅绿色)、调节束(深绿色)和后乳头肌(浅红色)解剖结构,左图为右前斜位,右图为左前斜位,箭头所示为前乳头肌-调节束结合部

图2 心腔内超声显示前乳头肌相关结构 上行为CARTOSOUND 系统重建的右心室(灰色)、前乳头肌(浅绿色)和调节束(深绿色)解剖结构,图示均为左前斜位(LAO),心腔内超声探头置于室上嵴附近、扇面对向心尖方向,从游离壁侧向间隔侧依次产生以下扇面:A.前乳头肌扇面,仅见前乳头肌及其腱索(实心箭头);B.前乳头肌-调节束结合部,前乳头肌(实心箭头)和调节束纵切面(空心箭头)均可见;C.略向间隔侧旋转,前乳头肌体部消失,仅可见其根部及与之相连的调节束纵切面(空心箭头);D.继续向间隔侧旋转,仅可见调节束横断面(空心箭头)
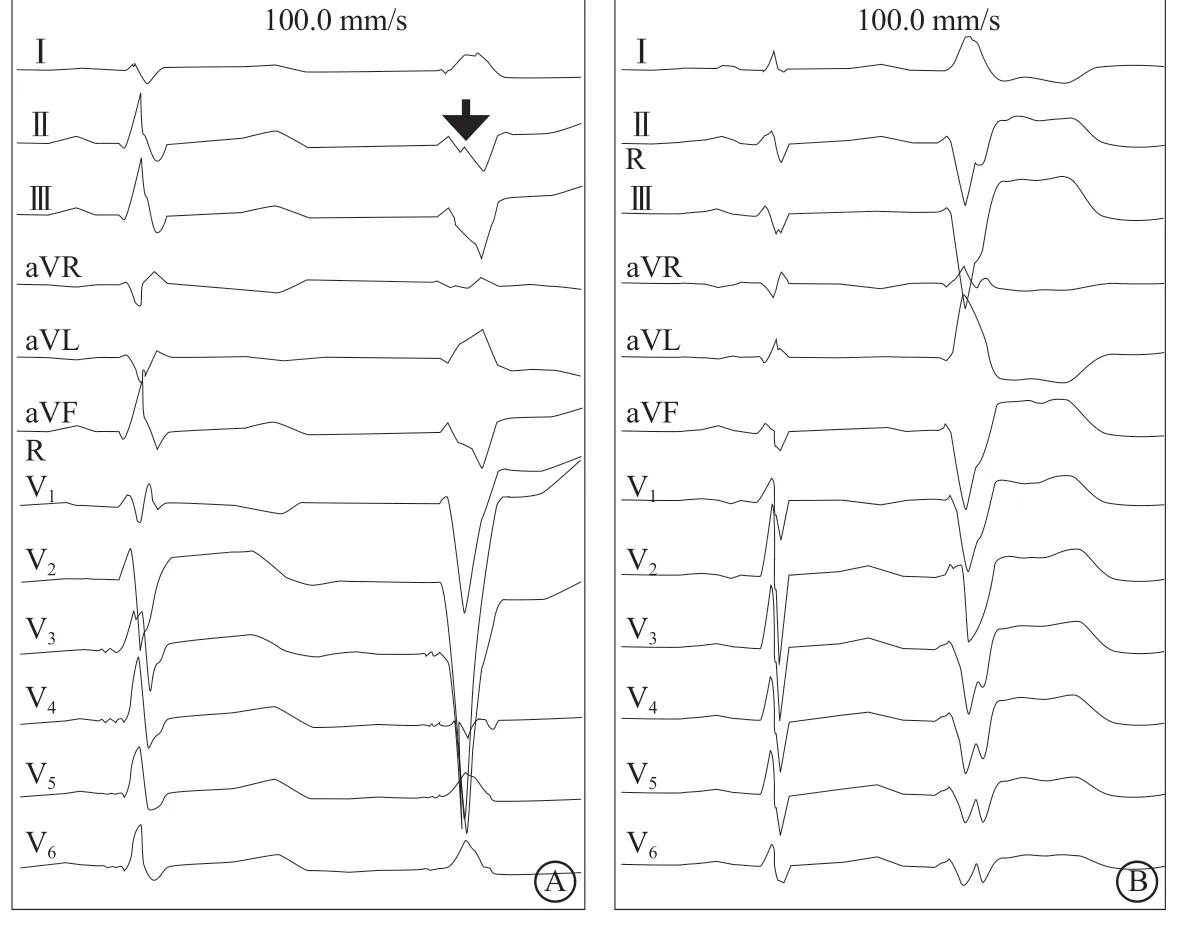
图3 心电图特点 A.前乳头肌-调节束起源的室性期前收缩及其窦性心律下QRS 波形态,其额面电轴指向左上,类本位曲折较短,呈左束支阻滞图形且移行晚于窦性心律,注意其下壁导联下降支存在切迹(箭头所示);B.起源于前乳头肌体部的期前收缩也具有类似的QRS 波特点,但下壁导联下降支无切迹

图4 激动标测 A.于CARTOSOUND 系统上由心腔内超声构建前乳头肌和调节束后可准确引导标测消融导管到前乳头肌-调节束结合部(蓝点)最早激动点处,左图为右前斜位,右图为左前斜位;B.最早激动点处心腔内超声影像,超声探头置于室上嵴水平,可见标测消融导管(箭头所示)位于前乳头肌-调节束结合部;C.期前收缩下标测最早激动点处点图,较体表QRS 波起点提前12 ms,局部可见浦肯野电位,该处消融期前收缩消失
2.4 消融结果及随访
8例患者于最早激动点行射频消融后6例(6/8)患者PVC消失,另2例患者仍存在PVC但QRS波形态略有改变、且最早激动点有所变化,重新标测最早激动点并消融后PVC消失(图5)。所有患者术中均达到消融终点。随访(15.0±8.9)个月,1例(1/8)复发相同形态PVC,于二次术中标测见起源点仍位于APM-MB结合部,消融后未再复发。术中有3例(3/8)出现右束支传导阻滞且随访过程中均未恢复,其于最早激动点处均可记录到PP。无心脏压塞、三尖瓣反流或其他并发症发生。
3 讨论
本研究的主要发现包括:(1)APM-MB结合部起源的特发性室性心律失常具有一些独特的体表心电图特点,如QRS波时限较窄、IDT较短、移行晚于窦性心律等,尤其是下壁导联下降支存在切迹,有助于和邻近部位如APM体部起源者鉴别;(2)ICE有助于APMMB起源特发性室性心律失常的标测和消融,使用APM长轴切面可准确、简单地实现该解剖区域定位和贴靠;(3)APM-MB起源特发性室性心律失常最早激动点较之体表QRS波起点的提前程度较小,并且常见PP,该处消融可有效消除室性心律失常,但可能遗留右束支传导阻滞。
三尖瓣环的结构和二尖瓣不同,除隔瓣侧有牢固纤维结构外尤其是游离壁侧并无连续完整的纤维瓣环,而是由瓣叶联合而成[4]。其瓣叶分界也不如二尖瓣明确,且变异较大,常需通过乳头肌及腱索区分。在连接三尖瓣的三组乳头肌结构中,隔侧乳头肌常缺如,后组乳头肌变异较大,常常仅为多个小乳头肌,而APM恒定且最为发达[2-3]。MB为右心室腔内连接游离壁与间隔侧的一显著肌束,由坐落于间隔室壁的隔缘肉柱发出。APM根部插入MB并与之相结合形成MB游离壁侧插入点(图1)。RBB于MB内自间隔侧走行向游离壁侧,故窦性心律下APM-MB结合部激动常早于右心室心尖,且有报道该部位可触发恶性室性心律失常[5-6]。

图5 消融中QRS 波形态改变 术前室性期前收缩形态,最早点位于前乳头肌-调节束结合部,该处可见浦肯野电位,领先体表QRS 起点14 ms(A 图),于该处消融后仍存在期前收缩但先后变为(B 图)及(C 图)的另外两种形态,分别领先18 ms 和11 ms,也均可见浦肯野电位。这三种形态室性期前收缩最早激动点均位于前乳头肌-调节束结合部,位置接近,QRS 波形态也仅有轻度差别,分别予以消融后所有期前收缩方消失

表1 8 例患者标测、消融和随访结果
Crawford等[7]曾对起源于右心室乳头肌的PVC进行了研究,其中2例起源于APM。Sadek等[5]则对起源于MB的特发性室性心律失常进行了研究,其中8例起源于APM-MB结合部。本研究观察到的起源于APMMB结合部的PVC具有QRS波较窄、额面电轴指向左上、IDT短、胸导移行晚等体表心电图特点与这些既往报道相符。但这些既往报道均认为APM-MB结合部和APM体部起源PVC从体表心电图不易鉴别。而在本研究中,所有起源于APM-MB结合部的患者下壁导联均可见下降支切迹,但在APM体部起搏时仅4/8可见该切迹。同时,2例起源于APM体部的PVC也未见该切迹。这种切迹的产生机制可能与经由MB向间隔侧的传导有关,因MB在间隔侧连接隔缘肉柱,其对侧肌束走行向右心室流出道高处支撑肺动脉瓣,因此,从APMMB结合部向间隔侧传导可产生正向成分而于下壁导联出现切迹[8-9]。这一切迹有助于APM-MB结合部起源PVC与APM体部起源者鉴别。
APM-MB结合部作为右心室乳头肌部位,为一心腔内的跳动结构,单纯使用传统的心脏三维电解剖标测系统或X线影像无法显示,而在ICE引导下则易于辨识定位。本研究采用APM长轴扇面来引导导管操作,这是因为该扇面可全程显示导管长轴,有助于判断其贴靠,而且通过顺时针或逆时针旋转看APM和MB的结构是否显示,易于分清APM体部、APM-MB结合部和MB体部。另外,该部位起源PVC提前时间较短,提示很可能为肌束深部起源,2例患者放电后QRS波形态有变化也支持这一点,而且,复发病例也可能与之相关。最早激动点处常可记录到PP,且放电后右束支传导阻滞常见,这与RBB走行是一致的。但在窦性心律下不一定可见到PP,可能因为APM-MB结合部已为RBB末梢,窦性心律下PP融入V波之内,而PVC时PP移至V波之前而显现。既往也有基础研究报道这一部位RBB或浦肯野纤维可能与致心律失常机制有关[10]。
本研究具有以下局限性:(1)样本量较小。但APM-MB结合部做为室性心律失常的少见部位,国际上尚无专门报道,既往研究中涉及该部位例数亦均不多于本研究。虽然8例已可总结出前述心电图和电生理特点,但仍有待于将来更大样本量研究证实。(2)术前未常规行心脏磁共振等检查,不能除外早期致心律失常性右心室心肌病等可能。但经病史、体格检查和超声心动图等已可除外对心电图和标测有显著影响的器质性心脏病,因此并不影响本研究结果。
APM-MB结合部起源的特发性室性心律失常在体表心电图和心腔内标测等方面均具有一些特点,并可经心脏三维电解剖标测系统结合ICE引导下行射频消融术有效消除。
