首次手术方式对短期内两次应用对比剂的冠心病患者临床预后的影响
2020-12-12刘一飞康伊艾冠男王兆丰徐培张玉婕杨晓旭顾崇怀赵昕任丽丽
刘一飞 康伊 艾冠男 王兆丰 徐培 张玉婕 杨晓旭 顾崇怀 赵昕 任丽丽
随着冠状动脉介入治疗技术的发展,接受冠状动脉造影(coronary angiography, CAG)及经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)的患者逐年增多,这些检查和治疗方式均需使用对比剂。因此,近年来对比剂诱导的急性肾损伤(contrast induced acute kidney injury,CI-AKI)逐渐被关注。欧洲心脏病学会(European Society of Cardiology,ESC)2018年心肌血运重建指南[1]推荐,所有接触对比剂的患者均应行CI-AKI风险评估(Ⅰ,C)。CI-AKI约占医院获得性AKI的11%,是住院患者急性肾功能衰竭的第三位常见原因[2]。在一般人群中,CI-AKI的平均发病率约为3.3%。在接受CAG或PCI的患者中,CI-AKI发病率高达20%~50%[3]。CI-AKI的发生延长了患者住院时间,增加了患者不良心脏事件发生率及死亡率[2]。
伴有难治性心绞痛或血流动力学不稳定等高危因素的急性冠状动脉综合征患者,早期急诊PCI可显著降低主要不良心脏事件发生率,提高存活率[1,4]。但是,研究表明急诊PCI是CI-AKI发生的独立危险因素,急诊PCI患者CI-AKI发生率高于择期PCI患者[5]。既往研究多关注单次PCI的患者,然而,临床上有较多患者由于完全血运重建等原因,需要住院期间行多次PCI。短期内两次应用对比剂的患者,首次手术方式对其CI-AKI发生特点及临床预后少有报道。本研究旨在分析首次PCI方式对于冠心病患者,短期内行两次PCI接触对比剂后围术期CI-AKI发生情况及远期预后的影响。
1 对象与方法
1.1 研究对象
本研究回顾性分析2010年1月至2015年1月就诊于北部战区总医院心内科的冠心病患者23 444例,筛选其中具有完整随访资料且30 d内两次行PCI接触对比剂的患者601例,按照首次接触对比剂的手术方式分为:A组(首次手术方式为急诊PCI,113例)和B组(首次手术方式为择期PCI,488例)。
1.2 纳入与排除标准
纳入标准:(1)入院诊断为冠心病,行CAG或PCI;(2)行CAG示多支血管病,30 d内需行分次PCI患者;(3)急诊PCI处理靶血管病变,30 d内需要行非靶血管PCI的患者[6];(4)发病时间>24 h的急性心肌梗死患者,血栓负荷较重,靶血管经皮冠状动脉腔内血管成形术后,30 d内行PCI达到完全血运重建的患者;(5)随访资料完整的患者。排除标准:(1)严重肝、肾功能等器官功能障碍者;(2)对比剂过敏者;(3)严重进展性疾病或预后不良使患者处于恶病质状态的疾病,或者因疾病预计寿命不足半年者;(4)1年内卒中病史;(5)2个月内有严重外伤或行外科大手术者;(6)主动脉夹层、动脉瘤、动静脉畸形等患者;(7)合并心肌病、心脏瓣膜病、结构性心脏病患者;(8)免疫系统疾病、造血或凝血功能障碍患者;(9)严重出血倾向者;(10)多器官功能衰竭者;(11)随访资料不全者。
1.3 临床资料收集
收集记录入选患者的年龄、生命体征、既往史等临床资料及住院期间用药情况。实验室检测指标包括:血细胞分析、心肌酶谱、肝功能、围术期肾功能。估算的肾小球滤过率(estimated-glomerular filtration rate,eGFR)采用适合中国人群的改良MDRD公式进行计算:eGFR[ml/(min·1.73 m2)]=186×血肌酐值-1.154×年龄-0.203×0.742(女性)。
1.4 CAG及PCI
入院患者经桡动脉或股动脉入径,采用Judkins法行CAG。由有经验的术者根据冠状动脉病变类型及病变程度,决定是否需要行PCI。依据指南及相关研究,综合患者病变类型、生命体征等因素,对入选患者制定个体化手术策略,并由2名有经验的心血管介入术者综合判定,评估决定患者分次PCI的时机。记录患者冠状动脉病变及支架情况,并进行SYNTAX评分。对比剂种类的选择由术者决定:(1)低渗对比剂碘佛醇、碘普罗胺;(2)等渗对比剂为碘克沙醇。术中抗凝药物(比伐芦定、普通肝素)的选择,应根据患者既往病史、术前检查化验指标、有无出血或缺血高危因素等综合判断[7]。
1.5 随访与研究终点
患者出院后通过门诊就诊、电话等方式进行随访,记录随访期间患者症状、用药和终点事件发生情况。研究终点:(1)分次PCI围术期CI-AKI发生情况;(2)随访期间全因死亡以及主要不良心血管事件(major adverse cardiovascular events, MACE)。MACE定义为心原性死亡、再发心肌梗死、支架内再狭窄、支架内血栓形成。CI-AKI定义为排除其他病因的前提下,应用对比剂72 h内肾功能发生损伤,血清肌酐水平升高0.5 mg/dl(44.2 μmol/L)或相对比例升高25%以上[8]。
1.6 统计学分析
所有数据采用SPSS 22.0进行统计学分析处理。正态分布计量资料采用均数±标准差表示,组间比较采用t检验;偏态分布计量资料采用四分位间距表示,组间比较采用秩和检验。计数资料以百分率表示,组间比较采用卡方(χ2)检验。采用logistic多因素回归分析筛选危险因素,事件生存率分析采用Kaplan-Meier法。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床基线资料比较
A组患者中ST段抬高型心肌梗死患者、吸烟者比例、入院心率均高于B组;B组患者年龄、入院收缩压均高于A组患者,差异均有统计学意义(均P<0.05,表1)。两组患者性别、体重、既往疾病史(高血压病、糖尿病、脑血管病史等)等其他资料比较,差异均无统计学意义(均P>0.05,表1)。
2.2 两组患者住院期间药物及实验室检查情况
A组患者利尿药使用比例高于B组患者,而钙通道阻滞药(calcium channel blockers,CCB)、血管紧张素转换酶抑制药(angiotensin-converting enzyme inhibitor,ACEI)/血管紧张素Ⅱ受体拮抗药(angiotensinⅡreceptor blockers, ARB)应用比例均低于B组患者,差异均有统计学意义(均P<0.05)。A组患者eGFR水平较B组患者高(P<0.001)。
两组空腹血糖、心肌酶、肝功、肾功、离子、血细胞分析等实验室检测指标比较,差异均无统计学意义(均P>0.05,表2)。
2.3 两组患者手术情况比较
A组患者在两次PCI对比剂用量、多支病变患者比例、术前基础肌酐值均低于B组患者,差异均有统计学意义(均P<0.05,表3)。A组患者第1次术后CI-AKI发生率、第2次术后CI-AKI发生率均显著高于B组患者,差异均有统计学意义(均P<0.001,表3)。
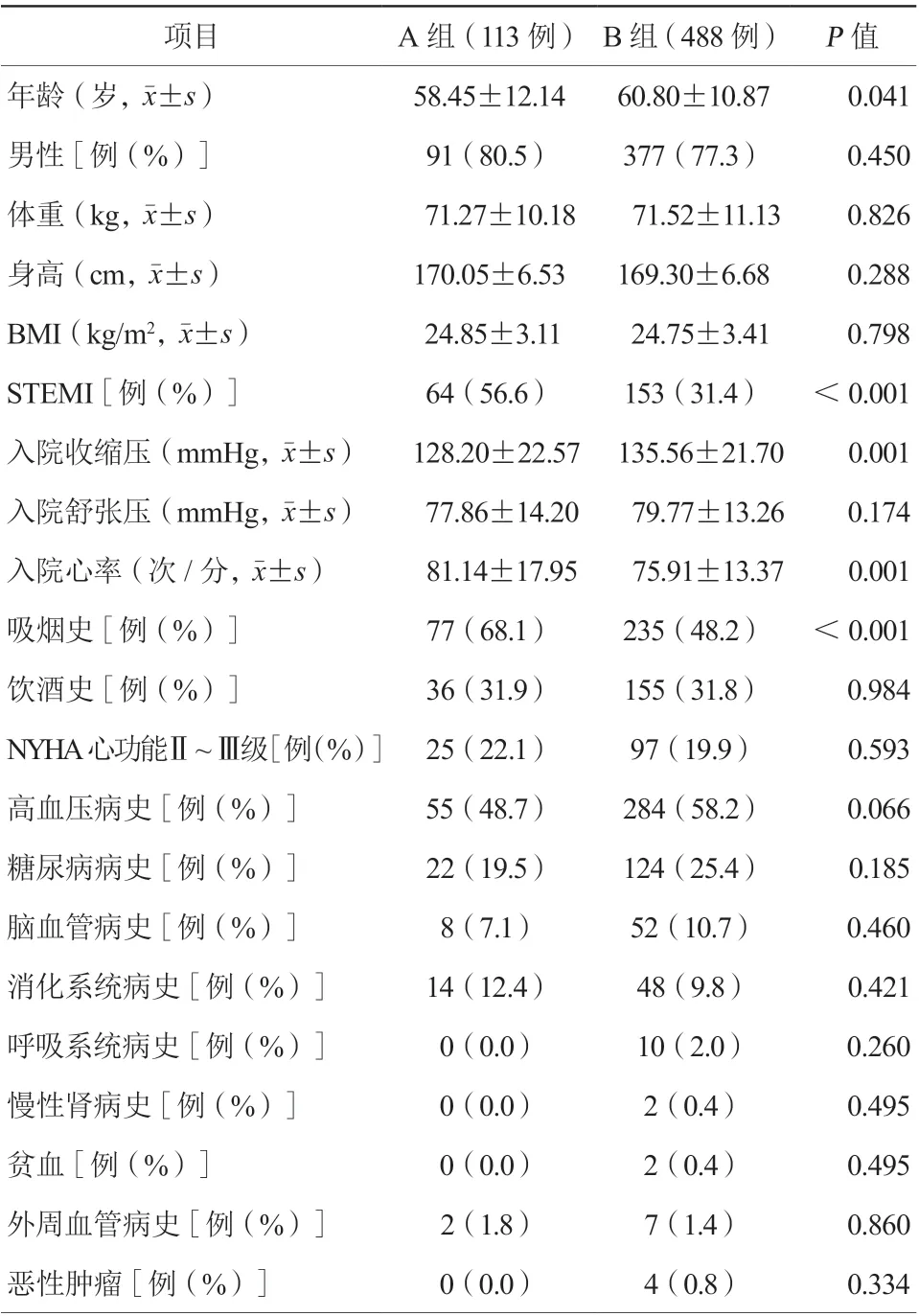
表1 两组患者基线资料情况比较
2.4 A组患者CI-AKI相关因素回归分析
A组患者第1次术后CI-AKI、第2次术后CI-AKI发生率均明显高于B组患者(均P<0.001)。为探究A组患者术后CI-AKI发生率较高的原因。本研究纳入两组患者间差异有统计学意义的临床变量及既往研究中相关因素,构建logistic回归模型,进一步分析冠心病患者中急诊PCI患者术后CI-AKI发生率较高的原因,明确急诊PCI患者发生CI-AKI的危险因素。结果显示:年龄(OR1.058, 95%CI1.000~1.118,P=0.049)是首次手术方式为急诊PCI患者第1次术后CI-AKI发生的独立危险因素(表4);eGFR(OR1.015,95%CI1.000~1.030,P=0.048)是首次手术方式为急诊PCI患者第2次术后CI-AKI的独立危险因素(表5)。
2.5 两组患者住院期间及随访期间的终点事件分析
A组患者MACE发生率高于B组患者,但差异无统计学意义(P=0.135)。A组患者支架内再狭窄发生率高于B组患者(P=0.037,表6)。

表2 两组患者住院期间应用药物及实验室检查比较
3 讨论
CI-AKI约占医院获得性AKI的11%,为住院患者急性肾功能衰竭的第三位常见原因[2]。CI-AKI与冠心病患者PCI术后临床不良事件发生密切相关,PCI术后发生CI-AKI的患者1个月死亡风险增加13倍,1年死亡风险增加6倍[9-10]。影响CI-AKI发生的危险因素较多,研究表明,急诊PCI是CI-AKI发生的独立危险因素,急诊PCI患者CI-AKI发生率明显高于择期PCI患者[11]。
本研究入选北部战区总医院心内科行PCI且30 d内两次接触对比剂的冠心病患者601例,按照首次接触对比剂的手术方式分组。本研究中急诊PCI患者年龄略低,与GRACE研究[12]相符。GRACE研究显示ST抬高型心肌梗死患者发病年龄比其他急性冠状动脉综合征发病年龄较轻。研究表明,吸烟对血管内皮细胞有直接侵袭作用,内皮细胞结构和功能的改变会过早启动动脉粥样硬化,加速冠心病的病程,且吸烟者的冠状动脉斑块脂质体积高于未吸烟者,导致斑块破裂的风险增加[13],因此吸烟者急性冠状动脉事件发生风险大幅增加。这与本研究结果相同,急诊PCI患者中吸烟者比例较高。本研究中,A组患者入院心率较快,考虑其原因为急性冠状动脉事件发生时机体处于应激状态,交感神经系统激活及疼痛、焦虑等因素均可使心率增快[14]。发生急性冠状动脉事件的患者血流动力学不稳定,冠状动脉血流受阻,严重缺血导致一过性的心肌顿抑、心肌细胞坏死导致左心室收缩和舒张功能障碍、心功能不全等症状。本研究中急诊PCI患者血流动力学不稳定,入院血压较低;纽约心脏病协会心功能Ⅱ~Ⅲ级患者比例、N末端B型脑钠肽前体水平均高于B组患者,所以A组患者利尿药使用比例较高。A组中具有高血压病史的患者比例低于B组患者,故急诊PCI患者住院期间CCB、ACEI/ARB应用比例较低。冠心病患者发生率随着年龄增长显著上升, 冠状动脉病变支数随年龄增加而增加,年龄>60岁患者多支血管病变发病率远远高于单支血管病变[15]。本研究发现,B组患者年龄较大、多支病变的比例较高。多支病变比例高,术中对比剂的使用剂量必然大幅增加。急诊PCI时多数仅处理罪犯血管,住院期间完善非罪犯血管的常规血运重建[1]。因此,B组的对比剂用量显著高于A组。

表3 两组患者住院期间手术及围术期CI-AKI 发生情况

表4 A 组患者第1 次术后CI-AKI 发病相关危险因素

表5 A 组患者第2 次术后CI-AKI 发病相关危险因素
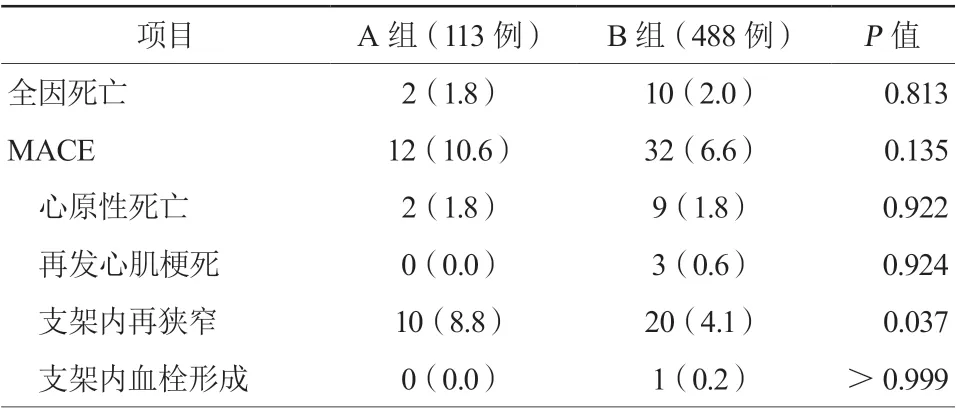
表6 两组患者PCI 术后随访结果[例(%)]
Naruse等[16]研究显示,即使对比剂用量未超过最大对比剂用量,急诊PCI术后CI-AKI仍普遍发生。本研究中,A组第1次术后CI-AKI发生率、第2次术后CI-AKI发生率,均显著高于B组患者。本研究与多项研究结果相符,即急诊PCI接触对比剂的患者CI-AKI发病率高于择期PCI患者[4,7,11]。分析可能原因如下:(1)对比剂直接毒性作用,对比剂的高渗作用增加髓质转运负荷及髓质代谢水平,进而增加了耗氧量;此外对比剂可激活血管收缩因子(肾素-血管紧张素-醛固酮系统、钙离子、内皮素等),加重肾血管收缩,同时对比剂增加血液黏稠性,导致肾血流变慢,影响部分肾单位供血供氧,造成局部肾组织缺血、缺氧,持续的需氧增加、供氧减少导致肾小管损伤[3]。(2)急诊PCI患者,通常起病急、病情重、伴有剧烈胸痛症状,同时还伴胸闷、气短、大汗等症状,容易导致体液丢失、电解质紊乱、有效循环血容量不足,合并血流动力学不稳定、心力衰竭等CI-AKI高危因素。由于需要紧急手术,术前水化治疗等预防性治疗措施有限,因此CI-AKI发生率较择期PCI患者高。(3)本研究中,A组患者既往合并糖尿病病史的比例低于B组,但是A组患者入院空腹血糖水平高于B组。急诊PCI患者由于发病时易出现剧烈胸痛、过度恐惧等症状,使交感神经-肾上腺髓质系统兴奋,肾上腺皮质激素、儿茶酚胺等激素释放入血,致使糖原分解增加,胰岛素分泌减少。因此,急诊PCI患者常引起血糖代谢紊乱,进而出现应激性高血糖(stress hyperglycemia,SHG)。研究显示高血糖是急诊PCI术后发生CI-AKI的独立危险因素[16]。SHG可增强急诊PCI患者因缺血缺氧所致的氧化应激反应,加重肾小管内皮细胞损伤,内皮细胞受损后释放细胞因子,进一步增强氧化应激反应,形成正反馈效应;同时高血糖的高渗作用直接增加肾髓质负担,与对比剂一起引起肾小管损伤,这些因素显著增加了CI-AKI发生率[17-18]。SHG可持续数天至1个月不等,随着病情的转归大多数患者血糖水平能够恢复正常。在本研究中,A组患者第1次手术与第2次手术间隔时间大约为1周,考虑患者仍处于SHG期,短期内两次应用对比剂加重了患者肾损伤,因此第2次术后A组CI-AKI发生率仍高于B组患者。既往研究表明,急诊PCI合并SHG的患者术后1周、1个月超声心动图各项指标均明显劣于非SHG患者,临床事件发生率以及12个月内MACE发生率均明显高于非SHG患者[18]。因此,急诊PCI患者应尽量减少对比剂用量、围术期充分水化治疗、无论是否合并糖尿病病史,均应监测患者血糖水平,综合患者的临床状况,制定个体化血运重建策略。
对首次手术方式为急诊PCI患者行多因素回归分析,年龄是首次手术方式为急诊PCI患者第1次术后CI-AKI发生的独立危险因素。一项纳入186 455例患者的Mate分析指出,年龄>65岁的患者CI-AKI发病率可达13.6%,比低于65岁的患者CI-AKI发生风险增加2.5倍[19]。一项纳入592例急诊PCI患者的多中心、前瞻性研究发现,年龄是CI-AKI发生的独立危险因素,患者每增加5岁,CI-AKI发生率增加14%,同时发现年龄与随访1年的死亡风险相关[20]。分析原因为:(1)随着年龄增长,全身动脉粥样硬化进展,血管内皮细胞功能紊乱,导致基础肾功能降低;(2)高龄患者多病共患的比例和风险大幅增加,常伴随用药剂量及种类过多。长期服用多种药物的药毒性作用致使肾功能下降,加之身体基础状况差、器官功能退化等多种因素,使得高龄成为对比剂肾病的高危因素之一。
同时,本研究发现,A组患者eGFR水平高于B组。eGFR为首次手术方式为急诊PCI患者第2次术后CI-AKI发生的独立危险因素。一项纳入1061例患者的研究提示,较高水平的eGFR可促进急诊PCI患者CI-AKI发生[4]。既往研究中,急诊PCI术后CI-AKI发生率达22.7%,同时发现在eGFR≥60 ml/(min·1.73m2)的人群中,eGFR水平越高,CI-AKI发生率越高[21]。然而,Merhan等[22]研究显示,eGFR每降低20 ml/(min·1.73 m2),CI-AKI发生率增加1倍。McCullough等[23]研究提示,eGFR>60 ml/(min·1.73m2)的患者CI-AKI发生风险<5%。这与本研究存在不同,可能与本研究为单中心、回顾性研究有关;由于地域不同,纳入患者人群不同,两组样本量不完全匹配,可能造成偏倚,故仍需多中心、大样本、前瞻性的研究进一步验证。
既往研究显示,急诊PCI术后支架内再狭窄发生率为8.0%[24]。本研究中,A组患者支架内再狭窄率达8.8%,明显高于B组(4.1%),结合相关研究及本研究人群的特殊性,可能原因为:(1)急诊PCI患者多数血栓负荷严重,防止术中无复流事件发生,仅采用较大压力扩张释放支架,未使用球囊充分后扩张。易导致支架贴壁不良,造成支架内再狭窄。(2)SHG可显著增加急诊PCI患者术后支架内再狭窄发生率。高血糖可减弱人体内皮依赖性血管扩张功能,诱导出现氧化应激状态,增加凝血酶形成和血小板蛋白分泌,增强血小板聚集[25]。
综上所述,急诊PCI患者往往心肌受损较重、临床症状危重,通常伴有血流动力学不稳定、合并疾病较多等危险因素。相较于择期PCI患者,急诊PCI患者常缺乏足够水化治疗时间及其他预防策略。因此,急诊PCI患者CI-AKI发生率较高,进而导致较高的MACE发生率。使用水化治疗等策略可以预防CI-AKI的发生。但是,急诊PCI患者围术期过度水化治疗易诱发或加剧心力衰竭事件发生,增加MACE的发生。所以,对于此类患者在临床工作中应加强关注,遵循循证医学和现行指南综合防治,综合判定患者病情,实施个体化、精细化的CI-AKI预防策略[26],降低PCI术后CIAKI发生率,最大程度地改善患者预后。
