没食子酸诱导肌原纤维蛋白巯基含量和表面疏水性变化对蛋白凝胶特性的影响
2020-12-12林世文王乐田刘登勇
贾 娜,林世文,王乐田,刘登勇
(渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁省食品安全重点实验室,辽宁 锦州 121013)
肌原纤维蛋白是肌肉蛋白的主要成分,其主要特性之一是在加热过程中可形成三维立体的凝胶网状结构。热诱导凝胶网络的形成是影响乳化型肉制品质量的关键,良好的凝胶结构能够提高产品的保水保油性,使产品质地均匀、理化性质稳定。然而在加工和贮藏过程中,蛋白质容易受到活性氧的攻击而发生氧化,导致其结构发生改变,功能特性降低,从而使肉的嫩度、风味、口感、保水保油性降低,产品质地变差,货架期缩短[1-2]。
肉类制品中添加抗氧化剂是防止蛋白质氧化的有效手段之一。相较于人工化学合成抗氧化剂,天然抗氧化剂因更加安全和健康而备受关注[3]。植物提取物是天然抗氧化剂的良好来源,多酚为其中发挥抗氧化作用的主要组分[4]。迷迭香、黑加仑以及白葡萄提取物等都被证实具有良好的抑制肉品氧化的作用[5-7]。然而,多酚在肉品中发挥抗氧化作用的同时,还能以共价和非共价的方式与蛋白质发生相互作用而改变蛋白质的空间结构、功能基团和聚合形式,从而影响蛋白质的功能特性以及产品的感官性状和营养价值[8]。如高添加量的绿原酸、迷迭香酸、表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)以及绿茶提取物均能够与肌原纤维蛋白发生相互作用,改变蛋白的氨基酸侧链基团、二级结构、三级结构,与蛋白发生交联,最终导致其不能形成良好的凝胶网络结构,削弱其凝胶特性[9-12]。二硫键和疏水相互作用是凝胶形成过程中的2 个主要作用力[13-14],因此,研究多酚对肌原纤维蛋白巯基和表面疏水性的影响,阐明二者变化与凝胶特性之间的内在联系,可为拓展多酚在肉制品中的应用提供理论依据。
没食子酸学名为3,4,5-三羟基苯甲酸,有良好的抗氧化性[15]。因此,本研究选择没食子酸为抗氧化剂,添加不同量的没食子酸到肌原纤维蛋白中,测定蛋白质巯基含量、表面疏水性、凝胶强度、凝胶保水性和流变特性,并对凝胶的微观结构进行观察,研究没食子酸诱导肌原纤维蛋白巯基和表面疏水性变化对蛋白凝胶特性的影响。
1 材料与方法
1.1 材料与试剂
猪背最长肌购于当地超市;没食子酸 美国Sigma公司;氯化钠、磷酸盐、三氯乙酸、氯化镁、磷酸二氢钠、乙二胺四乙酸二钠、氯仿、甲醇等均为国产分析纯。
1.2 仪器与设备
Allegra 64R冷冻离心机 美国Beckman公司;FE20 pH计、PL203型电子分析天平 梅特勒-托利多仪器(上海)有限公司;T25数显型均质机 德国IKA集团;UV2550紫外-可见分光光度计 日本Shimadzu公司;TA-XT2i质构仪 英国Stable Micro Systems公司;DKS24电热恒温水浴锅 上海森信实验仪器有限公司;Discovery DHR-1流变仪 美国TA公司;S4800场发式扫描电镜 日本日立公司。
1.3 方法
1.3.1 肌原纤维蛋白的提取及没食子酸-肌原纤维蛋白混合体系的制备
提取的肌原纤维蛋白溶于含有0.6 mol/L NaCl的磷酸缓冲溶液(pH 6.0、10 mmol/L),向其中添加不同量的没食子酸制备没食子酸-肌原纤维蛋白反应体系,蛋白最终质量浓度为40 mg/mL,没食子酸最终添加量为10、50、100 μmol/g和200 μmol/g蛋白,对照组为未添加没食子酸的肌原纤维蛋白。
1.3.2 蛋白质巯基含量的测定
参照Ellman[17]的方法进行测定,将1.3.1节制备的肌原纤维蛋白溶液稀释至质量浓度为10 mg/mL,用于测定巯基含量。取蛋白溶液1 mL与8 mL的Tris-甘氨酸混合,均质后离心15 min(4 ℃、10 000 r/min),取上清液4.5 mL与0.5 mL浓度为10 mmol/L的Ellman试剂反应,反应30 min后(旋涡混合,静置30 min)用紫外分光光度计在412 nm波长处测量吸光度。用13 600 L/(mol·cm)的摩尔吸光系数表示巯基含量。
1.3.3 表面疏水性的测定
参照Chelh等[18]的方法,将1.3.1节制备的肌原纤维蛋白溶液稀释至质量浓度为5 mg/mL、用于测定表面疏水性。取1 mL的蛋白溶液与200 μL质量浓度为1 mg/mL的溴酚蓝(溶于去离子水)于室温下搅拌10 min,然后离心15 min(4 ℃、6 000 r/min),取上清液稀释10 倍后用紫外分光光度计在595 nm波长处测量吸光度。表面疏水性用下式表示:

1.3.4 溶解度的测定
由于研究范围较大,辐射距离较长,整段天际线所包含的构成要素数量及形式过多。因此以道路分隔及既有街区为基础,将整段天际线较为均匀地划分为7段样本,每段长度约500~700m。一方面控制样本尺度以便于受访人在之后的调查问卷中进行评价判断,另一方面增加样本数量为后续天际线评价定量化、规律化的探讨提供了基础。
将1.3.1节制备的肌原纤维蛋白溶液用磷酸缓冲溶液(10 mmol/L,pH 7)稀释至10 mg/mL,量取5 mL于15 mL离心管中,在4 ℃的冰箱放置2 h,在10 000 r/min冷冻离心20 min。量取1 mL上清液,用双缩脲法测定蛋白质浓度,按下式计算溶解度:

1.3.5 蛋白凝胶制备
称取蛋白质(40 mg/mL)样品15 mL,装于密封的玻璃瓶中(25 mm×40 mm),在72 ℃水浴加热10 min,形成凝胶后取出,在冰浴中冷却1 h。在4 ℃的冰箱中贮存备用。
1.3.6 凝胶强度和保水性的测定
用TA-XT plus型质构分析仪测定肌原纤维蛋白凝胶的凝胶强度。采用Salvador等[19]的方法测定凝胶保水性,称取离心管的质量,记为m0。取一定质量凝胶(5~8 g)放入离心管底部,此时离心管的质量,记为m1。4 ℃、3 000 r/min离心10 min后,用中性滤纸吸干离心管中凝胶析出的水分,称取此时离心管质量,记为m2。计算公式如下:

1.3.7 流变特性的测定
将按方法1.3.1节制备的肌原纤维蛋白溶液(40 mg/mL)均匀涂抹在测试平台上。测试参数设置为:频率0.1 Hz,应变力为2%,上下板的夹缝为1 mm,升温程序为20~80 ℃,升温速率为1 ℃/min。测试平板外蛋白与空气接触处,用盖板密封。
1.3.8 肌原纤维蛋白凝胶微观结构的测定
参照李明清[20]的方法并适当修改。将凝胶样品紧密粘贴在扫描电镜样品台上,用E-1010型离子溅射镀膜仪将样品表面喷金,放入扫描电镜的样品盒中待检,加速电压5 kV,放大10 000 倍,进行扫描结果观察。
1.4 统计分析
2 结果与分析
2.1 没食子酸对肌原纤维蛋白巯基含量的影响
肌原纤维蛋白中巯基基团数量较多,其中肌球蛋白含有42 个巯基[21],易受到活性氧的攻击转化为二硫键。因此,巯基对于稳定蛋白质的空间结构有着重要的作用。如图1所示,没食子酸显著降低了肌原纤维蛋白巯基含量(P<0.05),但随着没食子酸添加量的增加,巯基含量变化不显著(P>0.05)。有研究表明,酚类物质易被氧化形成醌,然后可与巯基通过Michael加成生成巯基-醌加成产物,因此,巯基含量减少可能是由于没食子酸与巯基发生了共价交联[22]。绿原酸、迷迭香酸、EGCG均被证实可促进肌原纤维蛋白巯基含量的降低,其原因也是由于生成了巯基-醌加成产物[9-11],这与本研究的结果一致。此外,巯基之间形成二硫键是导致巯基含量降低另一主要原因。疏水基团的暴露可促进蛋白质发生疏水性聚集,从而导致蛋白结构更加紧密,巯基之间更容易发生交联形成二硫键[23]。有研究证实,鳕鱼肌动球蛋白表面疏水性增加会导致疏水基团暴露,从而促进蛋白变性聚集,进一步导致巯基交联[24]。

图1 没食子酸添加量对肌原纤维蛋白巯基含量的影响Fig. 1 Effect of added gallic acid on the sulfhydryl group content of myofibrillar protein
2.2 没食子酸对肌原纤维蛋白表面疏水性的影响
表面疏水性可反映疏水性氨基酸在蛋白质表面的分布情况,与蛋白质的功能特性密切相关,一般用蛋白质中疏水性氨基酸与溴酚蓝的结合量表示表面疏水性的大小。没食子酸对肌原纤维蛋白表面疏水性的影响如图2所示,随着没食子酸添加量的增大,表面疏水性显著增加(P<0.05),当没食子酸添加量为200 μmol/g时,表面疏水性达到最大值。表面疏水性增加是因为没食子酸与肌原纤维蛋白相互作用,改变蛋白构象,使蛋白结构展开,包埋在内部的疏水性氨基酸暴露在表面[25]。疏水相互作用是肌原纤维蛋白热诱导凝胶形成过程中的主要作用力之一[26],因此表面疏水性适当增加,可使更多的疏水基团参与到热诱导凝胶形成的过程中,从而有利于凝胶特性;但表面疏水性增加程度较大,会导致蛋白质稳定性降低,蛋白质与水的相互作用减弱,容易发生疏水性聚集,蛋白质发生变性,不利于凝胶网络结构的形成。Cao Yungang等[9]研究表明,绿原酸在低添加量时对肌原纤维蛋白表面疏水性的影响不大,而在150 μmol/g时,表面疏水性显著增加,可见高添加量的绿原酸促进了蛋白结构展开,与本研究结果相类似。而迷迭香酸、EGCG降低了肌原纤维蛋白的表面疏水性[10-11],与本研究结果相反,这主要是由于酚的种类和添加量不同所致。

图2 没食子酸添加量对肌原纤维蛋白表面疏水性的影响Fig. 2 Effect of added gallic acid on the surface hydrophobicity of myofibrillar protein
2.3 没食子酸对肌原纤维蛋白溶解度的影响
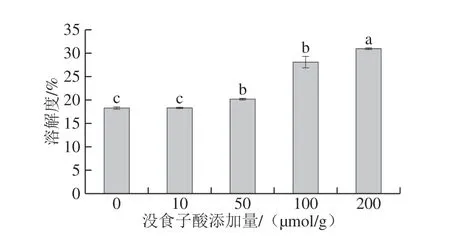
图3 没食子酸添加量对肌原纤维蛋白溶解度的影响Fig. 3 Effect of added gallic acid on the solubility of myofibrillar protein
由图3可知,没食子酸添加量为10 μmol/g时,肌原纤维蛋白的溶解度与对照组相比没有显著差异(P>0.05),随着没食子酸添加量的增加,蛋白的溶解度也显著增大(P<0.05)。由此可知,没食子酸对蛋白质的溶解度具有一定的促进作用。通常,蛋白质溶解度增加有利于提高蛋白质的功能特性,但从本研究结果来看,50、100、200 μmol/g没食子酸使凝胶强度和保水性显著降低(P<0.05)。因此,可能是由于没食子酸导致巯基-醌共价交联产物的形成以及肌原纤维蛋白发生疏水性聚集,蛋白质结构被破坏,促使小分子蛋白质片段溶出,从而导致溶解度增加。
2.4 没食子酸对肌原纤维蛋白凝胶强度和保水性的影响

图4 没食子酸添加量对肌原纤维蛋白凝胶强度和保水性的影响Fig. 4 Effects of added gallic acid on the gel strength and waterholding capacity of myofibrillar protein gels
如图4所示,当没食子酸添加量为10 μmol/g时,凝胶强度较对照组有所增长,但差异不显著(P>0.05)。随着没食子酸添加量的增大,凝胶强度显著降低(P<0.05),添加量为200 μmol/g时,比对照组和添加10 μmol/g时的凝胶强度降低了73.2%和73.8%(P<0.05)。凝胶保水性的变化趋势与凝胶强度相似,即没食子酸添加量为10 μmol/g时,保水性无显著变化(P>0.05),当没食子酸添加量增加时,保水性显著降低(P<0.05)。以上结果说明低添加量的没食子酸(10 μmol/g)对蛋白凝胶特性影响不大,而中、高添加量的没食子酸(50、100、200 μmol/g)对凝胶形成有破坏作用,甚至导致不能形成完整的凝胶结构。
如前所述,10 μmol/g没食子酸使表面疏水性适度提高,因而可以增加凝胶过程中的疏水相互作用,而表面疏水性过度增加则会导致蛋白质变性聚集,不能充分溶胀,从而不利于凝胶的形成。此外,在热诱导凝胶形成过程中,肌原纤维蛋白巯基转化成二硫键也是维持凝胶的主要作用力之一。一般认为,酚氧化成醌以后与巯基的共价交联具有两方面的作用,一是二者过度交联能够减少凝胶形成过程中二硫键的生成,因而不利于凝胶形成[7];另外,也有观点认为低添加量的酚有利于凝胶形成,因为酚与巯基发生非二硫键共价交联,酚在蛋白之间起到连接的作用,增加了蛋白质的聚合,因此有利于凝胶特性[9-10]。从本研究结果来看,10、50、100、200 μmol/g没食子酸使巯基含量降低的效果相同,因此,一方面没食子酸有可能起到连接蛋白的作用,但是添加量为50、100、200 μmol/g时,凝胶强度和保水性降低,这可能是由于疏水相互作用导致的蛋白变性起主导作用,掩盖了没食子酸对蛋白的连接作用;另一方面,没食子酸也有可能通过阻碍二硫键交联而削弱肌原纤维蛋白形成凝胶的能力,但添加量为10 μmol/g时,凝胶强度和保水性无显著变化,则可能也是由于适度增加的疏水相互作用起主导作用,增强了凝胶特性。因此,与巯基-醌共价交联产物的形成相比,没食子酸导致的疏水性增加可能是造成蛋白凝胶特性改变的主要因素。结合蛋白凝胶的微观结构来看,随着没食子酸添加量的增加,蛋白凝胶表面变得粗糙,孔隙变大,蛋白之间的相互连接减少,从而降低了蛋白凝胶的强度和保水性。Tang Changbo等[27]研究表明低浓度的迷迭香酸对肌原纤维蛋白凝胶强度影响不大,而高浓度的迷迭香酸则会形成巯基-醌和氨基-醌加合物,阻断肌原纤维蛋白的二硫键交联,降低蛋白的持水能力及凝胶强度,这与本实验没食子酸对肌原纤维蛋白凝胶强度的影响结果相似。此外,绿原酸和EGCG也被证实在高添加量时能够降低肌原纤维蛋白的凝胶强度和保水性[9,11]。
2.5 没食子酸对肌原纤维蛋白凝胶流变特性的影响
流变特性是评价肌原纤维蛋白凝胶黏弹性的常用指标,储能模量(G’)又称弹性模量,用来反映凝胶形成过程中的弹性,损耗模量(G”)又称黏性模量,可反映凝胶形成过程中的黏度。由图5所示,对照组的G’在45 ℃和50 ℃时有2 个明显的转变峰,峰值在45 ℃时,为凝胶开始形成阶段,是由肌球蛋白头部的亚基变性导致的,峰值在50 ℃时,是由于肌球蛋白尾部的聚集、变性,分子热运动加剧,流动性增强,G’降低,随后随着温度的升高,肌原纤维蛋白最终形成不可逆的凝胶网络结构[28]。当没食子酸添加量为10 μmol/g时,在50 ℃以前G′的趋势与对照组相同,在50 ℃之后G’高于对照组,说明最终形成的凝胶弹性较大,可能的原因为没食子酸促进大部分肌球蛋白分子展开,增强了蛋白与蛋白以及蛋白与没食子酸之间的交联作用,从而产生了不可逆的热诱导凝胶结构。当没食子酸添加量为50、100、200 μmol/g时,45 ℃和50 ℃的峰几乎消失,50 ℃之前的曲线变得平缓,说明没有形成凝胶网络结构,主要是由于高添加量的没食子酸可能通过生成巯基-醌加成物以及促进疏水基团严重暴露而导致肌原纤维蛋白发生变性、聚集,阻碍了肌原纤维蛋白热诱导形成三维网状凝胶结构,从而降低了G’[29]。温度超过50 ℃,没食子酸添加量为50 μmol/g时,最终仍能形成弱的凝胶结构,但添加量为100~200 μmol/g时,完全不能形成凝胶结构。由此可见,流变特性的变化结果与前面凝胶特性的变化相一致。G”的变化趋势与G’相似,即没食子酸添加量为10 μmol/g时,曲线形状与对照组相似,仍能形成较好的凝胶网络结构,而添加量为50、100、200 μmol/g时,峰值消失,曲线趋于平缓,几乎不能形成凝胶网络结构。与本研究结果相似,高浓度的绿原酸、EGCG、迷迭香酸也导致肌原纤维蛋白凝胶形成过程中G’降低[9-11]。

图5 没食子酸对肌原纤维蛋白凝胶流变特性的影响Fig. 5 Effect of added gallic acid on the rheological properties of myofibrillar protein gels
2.6 没食子酸对肌原纤维蛋白凝胶微观结构的影响

图6 没食子酸添加量对肌原纤维蛋白凝胶微观结构的影响Fig. 6 Effect of added gallic acid on the microstructure of myofibrillar protein gels
蛋白凝胶的微观结构是凝胶状态的直观反映。对照组(图6a)的肌原纤维蛋白凝胶结构均匀、较致密、孔隙小形状规则。没食子酸添加量为10 μmol/g(图6b)时,肌原纤维蛋白凝胶的微观结构变得更加致密、光滑和均匀,有较好的成胶能力。没食子酸添加量增大到50、100、200 μmol/g时(图6c~e),凝胶网络结构发生明显变化,逐渐变得粗糙松散、不均匀,孔隙越来越大,凝胶断裂,伴有片层状结构出现,可能的原因为中、高添加量的没食子酸与肌原纤维蛋白发生相互作用,阻碍了蛋白分子之间的交联,从而使蛋白胶束分布不均匀,蛋白网络结构较差[30]。此外,还有可能是疏水基团过度暴露,导致蛋白质发生疏水性聚集、变性,最终不能形成良好的凝胶网络结构。通过微观结构发现添加高添加量的没食子酸导致凝胶三维网状结构较差,凝胶的弹性降低,蛋白的成胶能力越来越弱,甚至完全不能形成凝胶,这也与凝胶强度、保水性以及流变特性的结果一致。
3 结 论
随着没食子酸添加量的增加,肌原纤维蛋白的巯基含量降低,表面疏水性增加。没食子酸添加量较低(10 μmol/g)时,与对照相比,凝胶强度与保水性均无显著变化,流变特性无明显变化;没食子酸添加量较高(50、100、200 μmol/g)时,凝胶强度与保水性显著降低,流变曲线转变峰消失,趋于平缓。微观结构结果进一步证实了高添加量没食子酸对凝胶特性的不利影响,凝胶出现片层状结构及孔洞。总体来说,低添加量没食子酸对蛋白的凝胶特性无负面影响,而高添加量则不利于凝胶化,可能是由于高添加量的没食子酸诱导肌原纤维蛋白巯基和表面疏水性发生变化,从而对凝胶特性产生不利影响,并且表面疏水性的变化可能对凝胶特性的改变起主导作用。
