果胶、BSA及壳寡糖相互作用及对BSA负载效果的影响
2020-12-12范丽萍张立彦陈列欢
范丽萍,张立彦,陈列欢
(1.嘉应学院生命科学学院,广东 梅州 514015;2.华南理工大学食品科学与工程学院,广东 广州 510640;3.仲恺农业工程学院动物科技学院,广东 广州 510225)
由于蛋白质或肽类功能食品或药物在胃肠道环境中耐受性差,易变性或降解[1],且不易在肠部吸收,不能实现靶向或定点释放,降低其功能性或治疗效果。蛋白质或肽作为两性电解质,可以通过静电作用与易解离的高分子聚合物形成聚电解质复合物(polyelectrolyte complexes,PEC),实现包埋或负载,以改善其耐受性、稳定性及易吸收性[2],成为近年来研究的热点。例如,壳聚糖(chitosan,CS)可与聚阴离子聚合物形成具有pH敏感性、酶敏性的PEC[3-5],用于蛋白质或肽类等的包埋及负载,实现其在胃肠道内的输送及控释。其水解产物壳寡糖(chiooligosaccharide,COS)(聚合度2~20)也具有CS类似的解离性质,但具有比CS更好的水溶性、生物降解性、低溶血活性以及低细胞毒性等特性[6],与果胶形成的复合物pH敏感性更高,适应的pH值范围更宽[7],因此比CS更适合作为载体使用,受到越来越多的关注[8-9]。
目前,关于蛋白质负载的方法有温孵式和并入式2 种[10]。在多组分体系及静电复合作用为主的情况下,同性电荷组分间的竞争作用普遍存在,显著影响目标物的结合效率及包埋效果[11]。目前的研究多以探讨阴、阳离聚电解质相互作用及复合条件影响为主[12-16],并未考虑多组分体系内蛋白质与同性电荷分子组分间的相互作用,以及对负载效果的影响。
基于上述,本实验选取COS、果胶及其复合物为负载载体,牛血清白蛋白(bovine serum albumin,BSA)为负载蛋白质模型,探讨不同复合方式下上述物质二元及三元复合物显微状态及超微结构、分子间作用及BSA复合率和负载率,考察果胶、COS、BSA分子间的相互作用及对BSA负载效果的影响,为探究果胶及COS复合物负载BSA的机制及效果奠定研究基础。
1 材料与方法
1.1 材料与试剂
COS(平均分子质量1.2 kDa,脱乙酰度90.14%)浙江金壳生物化学有限公司;果胶(P9135-100G,半乳糖醛酸含量不少于74.0%,酯化度66.7%) 美国Sigma-Aldrich公司;BSA 上海伯奥生物科技有限公司;其余试剂均为分析纯。
1.2 仪器与设备
PHS-25 pH计 上海雷磁仪器厂;BS224S分析天平 德国赛多利斯集团;TGL-16超速离心机 上海安科仪器有限公司;SHA-BA恒温振荡器 常州澳华仪器有限公司;LGJ-10冷冻干燥机 北京松源华兴科技发展有限公司;Model752紫外-可见分光光度计 上海现科分光仪器有限公司;CX31型光学显微镜 日本Olympus公司;Tensor 37傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 德国Bruker公司;COXEM EM-20台式扫描电镜 韩国Coxem公司。
1.3 方法
1.3.1 COS、果胶及BSA二元及三元PEC的制备
1.3.1.1 果胶/BSA静电复合溶液的制备
室温下,向含有NaCl、质量浓度为2.5 mg/mL的果胶溶液中加入一定体积pH 3.5、25 mg/mL BSA溶液,振荡均匀,使最终复合溶液中果胶质量浓度为2 mg/mL、NaCl浓度为30 mmol/L,BSA质量浓度为5 mg/mL,pH值为3.5。该方法简记为“果胶+BSA”。
1.3.1.2 COS/果胶复合溶液制备
室温下,向含有NaCl、质量浓度2.5 mg/mL的果胶溶液中加入一定体积的pH 3.5、10 mg/mL的COS溶液,振荡均匀,使最终复合溶液中果胶和COS的质量浓度分别为2 mg/mL和1.2 mg/mL,NaCl浓度为30 mmol/L,pH值为3.5。方法简记为“果胶+COS”。
1.3.1.3 COS+BSA混合溶液制备
室温下,向pH值为3.5,25 mg/mL的BSA溶液中加入一定体积的pH 3.5、10 mg/mL的COS溶液,调整溶液体积、pH值并振荡均匀,使最终复合溶液中BSA和COS的质量浓度分别为5 mg/mL和1.2 mg/mL。方法简记为“COS+BSA”。
1.3.1.4 COS、果胶及BSA三元复合溶液的制备
果胶+BSA+COS:向含有NaCl、pH 3.5、质量浓度为2.5 mg/mL的果胶溶液中加入一定质量浓度25 mg/mL的BSA溶液,振荡均匀后再加入一定体积pH 3.5、质量浓度为10 mg/mL的COS溶液,振荡均匀。最终复合溶液中果胶的质量浓度为2 mg/mL,NaCl浓度为30 mmol/L,BSA质量浓度为5 mg/mL,COS质量浓度为1.2 mg/mL,pH 3.5。
COS+BSA+果胶:取一定体积、pH 3.5、质量浓度为10 mg/mL的COS溶液与BSA溶液(25 mg/mL,pH 3.5)均匀混合后,加入质量浓度为2.5 mg/mL的果胶溶液(pH 3.5),振荡均匀。
COS+果胶+BSA:将上述COS/果胶复合溶液高速离心(8 000 r/min),沉淀经冷冻干燥后浸泡于pH 3.5、5 mg/mL的BSA溶液中,30 min后取出复合物,沥净溶液,再次冻干后备用。
以上复合方式下,各物质浓度条件是在前期研究中得出的较稳定复合条件,复合溶液体系中果胶、COS及BSA、NaCl的浓度均一致,仅比较不同复合顺序对三物质分子间相互作用的影响,不考察Na+、Cl-对3 种大分子物质间相互作用的影响。
1.3.2 溶液浊度的测定
将复合溶液振荡10 s后,在600 nm波长处测定透光度T,并计算溶液浊度:

1.3.3 复合溶液状态观察
将试管中的复合溶液振荡15 s混匀,拍照记录溶液中复合物的宏观状态。复合溶液振荡15 s后,滴加在载玻片上,利用光学显微镜观察溶液及微粒的微观状态(放大40 倍),并拍照对比。
1.3.4 PEC得率的计算方法
COS/果胶溶液PEC得率计算:将COS/果胶复合溶液于磁力搅拌器上搅拌2 h,高速离心(8 000 r/min)后取沉淀,冻干。PEC得率按下式计算[17]:
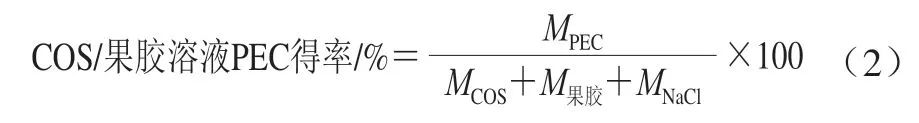
负载BSA的PEC得率计算:将各复合方式所得PEC高速离心分离,收集沉淀物并冷冻干燥,得率按下式计算:
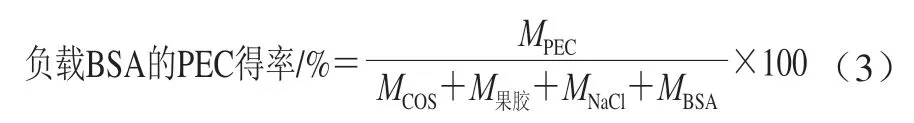
1.3.5 PEC对BSA的负载率及BSA复合率计算
将不同复合方式所得溶液进行离心(8 000 r/min)分离,采用双缩脲法测上清液中BSA溶液的浓度。PEC对BSA的负载率及BSA复合率按下式计算[17]:

1.3.6 PEC扫描电镜观察
将果胶、COS、BSA及各PEC贴在样品台上,喷金后用扫描电镜观察表观形态并拍摄照片。
1.3.7 果胶、COS、BSA及各PEC的FTIR测定
取适量果胶、COS、BSA及各PEC冻干物,粉碎后直接压片测定其FTIR。
1.4 数据处理及分析
采用Microsoft Excel 2007软件求取实验数据,采用SPSS 19.0软件的新复极差分析法Duncan比较各处理间差异的显著性(P<0.05)。
2 结果与分析
2.1 果胶、COS及BSA不同复合方式所得溶液的浊度比较
COS与CS类似,在pH值低于6.2时分子中的氨基质子化形成—NH3+,可与果胶分子上的—COO-通过静电相互作用自组装形成PEC[18]。而BSA在其等电点(pI 4.7)以下的溶液中带正电荷,也可与果胶发生自组装形成PEC[19]。

图1 不同复合方式下溶液的浊度Fig. 1 Turbidities of complex solutions complexes obtained with different methods
由图1可以看出,复合方式对溶液浊度及状态有较大影响,各溶液状态及浊度差别很大。果胶与BSA复合后溶液呈乳白色胶体状态(果胶+BSA),浊度最高。而COS与BSA所形成的溶液澄清透明(COS+BSA),浊度在10以下,这是因为pH 3.5条件下两者都带正电而未发生复合反应。果胶与BSA复合后再添加COS(果胶+BSA+COS),所形成的复合溶液呈淡黄色(受COS颜色影响),溶液浊度与果胶+BSA差异不显著(P>0.05),溶液静置后PEC会沉淀析出。COS与BSA混合后再与果胶复合(COS+BSA+果胶),所形成的复合溶液浊度显著低于果胶+BSA(P<0.05),与果胶+BSA+COS的浊度值差别不大(P>0.05),但溶液状态差异较大。在本研究条件下,果胶与COS复合后形成纳米级极微小颗粒,溶液呈半透明胶体状态。
2.2 不同复合溶液及微粒显微状态比较
由图2可知,果胶与BSA形成的PEC呈尺寸较小的不规则颗粒,伴有少量大块团聚物,尺寸在微米级(COS+BSA为澄清溶液,显微镜下无法观察其微观状态,因此未列出)。果胶与BSA复合再加入COS后,PEC聚集成颜色较深、结构较致密、尺寸更大的不规则微米级颗粒。分析原因,在pH 3.5、NaCl浓度为30 mmol/L时,BSA带正电荷,果胶分子带部分负电荷且分子链刚性较小,易卷曲、折叠[20],可包裹椭圆形BSA形成较小的颗粒。果胶在与BSA形成PEC后再加入COS时,COS中的—会与颗粒表面果胶分子中游离—COO-结合,并使PEC颗粒团聚,形成较大的三元PEC。同时,链状COS也有可能与表面的BSA竞争果胶分子上的作用位点,使果胶分子拉长,三元PEC颗粒变大。COS+BSA+果胶形成的PEC颗粒不均匀,有较大团块出现,且结构较致密,与图1中显示的溶液宏观状态相对应。COS与果胶复合溶液中观察不到明显的PEC,此时PEC微粒太小,而有些则可能是水溶性的[21]。
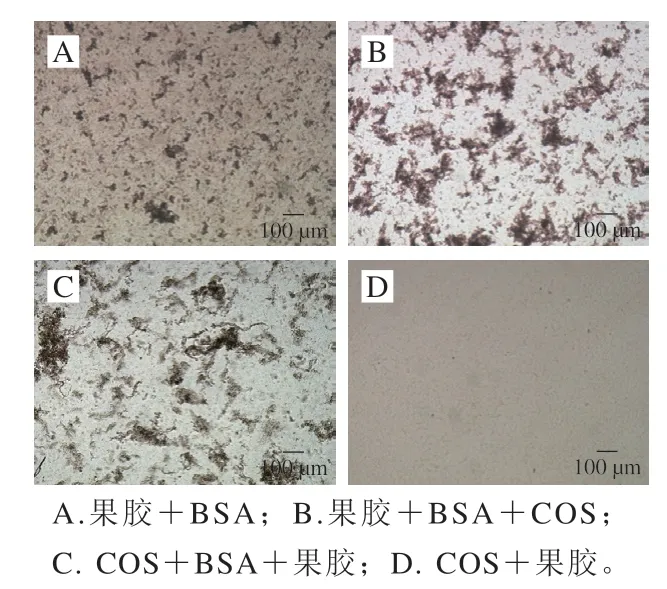
图2 不同复合方式下所得复合体系的微观状态Fig. 2 Microscopic morphology of complexes obtained with different methods
2.3 复合方式对BSA负载效果的影响

图3 不同复合方式下BSA的负载率、复合率和PC得率Fig. 3 Loading and complexation rates of BSA and yield of BSA-loading PEC obtained with different methods
由图3可知,果胶+BSA复合时BSA负载率最高,为44.96%,其他3 种复合方式下负载率均较低且无显著性差异(P>0.05)。不同复合方式下BSA参与复合的复合率差异显著(P<0.05),高低顺序为果胶+BSA>果胶+BSA+COS>COS+BSA+果胶>果胶+COS+BSA。COS+BSA+果胶和COS+果胶+BSA方式PEC得率最高且无显著性差异(P>0.05),果胶+BSA+COS时得率明显降低(P<0.05)。
果胶+BSA方式下,BSA负载率和复合率最高,表明果胶分子与BSA结合非常充分,但再添加COS之后(果胶+BSA+COS),BSA负载率和复合率、PEC得率都明显降低,说明PEC上部分BSA被COS替代,COS会与BSA竞争结合PEC表面的果胶分子。
COS+BSA+果胶方式下BSA复合率和负载率较前2 种方式都有所下降,由此可推测小分子且电荷密度较高的COS更易占据果胶分子上的负电荷基团位点,优先结合果胶。此方式下PEC得率较高的原因可能是因为COS为直链分子,与果胶形成的PEC为网状或链状,分子较展开[7],暴露的游离—COO-较果胶+BSA中PEC多(BSA为椭圆状分子,与果胶形成的PEC颗粒较小[22](图2),果胶分子卷曲包裹,游离的—COO-易被包埋),更易于再进一步结合COS或BSA而使PEC得率提高。
果胶/COS的PEC冻干后结构致密、不易解离,BSA主要吸附在果胶/COS的PEC结构上[16],导致BSA复合率和负载率都不高,但得率较高。
2.4 不同复合方式所得PEC的超微结构观察

图4 果胶、COS、BSA及不同复合方式所得PC扫描电镜图Fig. 4 SEM photographs of pectin, chiooligosaccharide, BSA and BSA-loading complexes obtained with different methods
由图4可以看出,果胶为胶态颗粒,COS为球状颗粒,而BSA则为片状物。果胶+BSA形成PEC主要呈现内嵌圆形、椭圆形或不规则弧形等小孔隙的胶体样结构,孔隙分布较均匀,孔径约在3~20 μm之间,表明形成的PEC较均匀。5 000 倍观察图可见网状结构中孔隙壁较厚,表面较光滑但有凹陷,推理认为在本研究条件下果胶较柔软、易包裹BSA分子[20],使得孔壁较光滑。
PEC+BSA形成二元PEC再与COS复合(果胶+BSA+COS),所得三元PEC中可见明显的蜂窝孔状结构,孔隙呈较规则的圆形或椭圆形,但孔隙分布及孔径都较不均匀,继续放大可见部分孔隙壁层较薄,表面光滑均匀。结合图3的结果,这可能是因为COS与颗粒表面果胶分子上游离—COO-复合,或与已复合的BSA竞争结合位点,形成网状结构[7],导致微粒表层及内部PEC结构不均匀,这也是微粒核-壳结构的体现。
COS+BSA+PEC复合时,所形成的三元PEC呈胶体样网状结构,孔隙不规则且较少,孔壁表面粗糙、有褶皱。从图中可以看出PEC超微结构更接近果胶+BSA+COS溶液中PEC的网状结构,只是壁层较厚,可推测果胶分子趋向于先与COS结合并形成网状结构,而后再与BSA复合,使壁膜增厚。由此佐证图3的推测:COS、BSA与果胶分子竞争性结合,果胶分子更倾向于结合电荷密度更高的直链分子COS。沈亚丽[23]认为带相反电荷分子之间的静电吸引作用与两者分子所带电荷密度呈线性正相关关系,可以为上述推测提供支持。
以冻干的COS/果胶溶液PEC吸附BSA(果胶+COS+BSA),PEC表现为均匀规则的密集网状结构,内有细小且均匀的不规则孔隙,孔壁较厚且光滑。对比发现,COS与果胶溶液PEC(果胶+COS)冻干后结构致密(图4H),BSA加入后三元PEC却呈网状结构,其原因值得探讨。
2.5 不同复合方式所得复合物的FTIR分析

图5 果胶、COS、BSA及不同复合方式所得图Fig. 5 FTIR spectra of pectin, chiooligosaccharide, BSA and complexes obtained with different methods
由图5可知,COS的吸收特征峰与CS基本相同,分子上的O—H伸缩振动吸收峰和N—H伸缩振动吸收峰在3 750~3 050 cm-1处重叠成的一个宽峰,在1 632 cm-1处为未酰化2-氨基葡萄糖胺中的N—H的伸缩振动峰(酰胺I带),1 520 cm-1处为N—H的弯曲振动峰(酰胺II带)[24];果胶分子上的羧酸O—H缔合伸缩振动在3 700~3 100 cm-1区出现强峰,在1 748 cm-1处和1 647 cm-1处分别为酯羰基C=O及羧基—COO-的伸缩振动峰[23,25];BSA的特征峰为3 287 cm-1氨基峰、1 645 cm-1(C=O键伸缩(酰胺I带))、1 535 cm-1(C—N键伸缩及N—H键合(酰胺II带)和1 394 cm-1(N—H振动(酰胺III带)的乙酰氨基峰[26]。3 种物质以不同方式复合后,所得复合物的红外光谱图不甚相同。
果胶与BSA复合时(PEC+BSA),果胶分子C—H伸缩振动峰及酯羰基C=O分别红移到2 912 cm-1和1 737 cm-1,且峰高度显著减弱,表明这些基团被包裹,果胶分子卷曲。另外,果胶1 647 cm-1处的羧基和BSA 1 535 cm-1处的酰胺II带合并为1 522 cm-1较小的吸收峰,BSA的酰胺III带也发生了红移(1 387 cm-1),说明果胶分子上的—COO-与BSA分子上的—NH3+之间通过静电作用结合[27],但BSA的二级结构基本没变(酰胺I带由1 645 cm-1红移至1 651 cm-1,仍为无规卷曲结构)[28-29]。
PEC+BSA+COS三元PEC的—OH伸缩振动峰较PEC+BSA二元PEC进一步蓝移到3 469 cm-1处且峰强度变大,C—H伸缩振动峰则红移到2 943 cm-1处且峰强度增大,这是COS加入的体现。与PEC+BSA相比,PEC酰胺I带吸收峰位置及强度基本未变,反映此复合方式时COS结合量较少。PEC的酰胺II带蓝移到1 543 cm-1,其他各特征峰的波数变化不大,而强度略有增加(例如酰胺I带及II带),表明COS也主要以静电作用结合在PEC+BSA的PEC上。
对于COS+BSA+果胶方式形成的PEC,C—H伸缩振动峰较果胶+BSA+COS中的PEC稍微红移(2 935 cm-1)且峰强度变大,推测此时PEC微粒表面的果胶和/或COS的量较多且更伸展,易被检测到。PEC酰胺II带特征峰红移至1 531 cm-1处,其他各特征峰的强度明显变大(尤其是酰胺I带及II带吸收峰),表明各分子之间的作用力没有改变。对比各物质红外光谱图发现COS+BSA+果胶三元PEC的结构更接近多糖分子或有COS加入时的PEC,可进一步证明2.3节关于COS、BSA及果胶竞争结合的推测。另外,复合物酰胺I带向高波数移动(1 654 cm-1),表明BSA分子二级结构由无规卷曲结构向α-螺旋转变[29],这可能是由于此方式下COS加入使得果胶结构变化,BSA为了更好地与果胶结合而发生结构改变。
COS与果胶复合时(COS+果胶),所形成的PEC的—OH伸缩振动峰红移到3 352 cm-1处,但强度显著减弱,表明此时两分子之间存在较强的氢键[25],这与有BSA参与的PEC结构显著不同,推测是由于BSA为椭圆形分子,与果胶结合后使果胶分子卷曲,分子上易与COS形成氢键的基团被包埋;另外,COS+果胶二元PEC酰胺II带吸收峰强度非常小,表明此时COS分子上的游离氨基—NH2充分复合,含量减少,信号降低[30]。在COS/果胶复合物上吸附BSA(COS+果胶+BSA),三元PEC的—OH伸缩振动峰显著蓝移,推测BSA加入破坏了果胶及COS之间的氢键;果胶及COS其余各特征峰基本消失,表明此时PEC表面主要吸附覆盖了BSA,红外光谱表现BSA的基本特征;PEC酰胺II带吸收峰几乎消失,说明此时PEC中的游离氨基被完全复合;PEC的酰胺I带吸收峰由BSA的1 645 cm-1红移到1 628 cm-1,推测BSA结构由无规卷曲结构转变为β-折叠[26],可能是BSA为了适应COS/果胶复合物构造而发生了结构改变。
3 结 论
不同复合方式下,果胶、COS及BSA复合顺序不同,所形成的二元及三元PEC结构、状态及对BSA的结合效果显著不同,其红外光谱差异也较大。
在果胶质量浓度为2 mg/mL、NaCl浓度为30 mmol/L,BSA质量浓度为5 mg/mL,pH值为3.5条件下,三者之间主要通过静电作用进行结合,其中COS会与BSA竞争结合果胶分子上的负电位点,降低PEC对BSA的复合及负载。
在三元物质复合过程中,为了与果胶有效结合,BSA的二级结构会发生改变,其加入会破坏果胶与COS之间形成的氢键。
