鹅骨胶原蛋白钙螯合肽的分离纯化及结构鉴定
2020-12-12周名洋何雨欣孙杨赢潘道东曹锦轩
周名洋,何雨欣,孙杨赢,潘道东,曹锦轩
(宁波大学食品与药学学院,浙江省动物蛋白食品精深加工技术重点实验室,浙江 宁波 315800)
金属离子在许多代谢过程中起着重要作用,如稳定结构和控制氧化还原进程等。在所有的二价金属离子中,钙离子的作用尤为突出,如提供骨架和充当信使等。缺钙会导致骨质疏松、高血压和肠癌等疾病[1],严重危害人们的身体健康。如今人口老龄化严重,缺钙人群比例大,离子钙是主要的补钙剂,但它会在肠道形成磷酸钙沉淀,生物利用度较低[2]。近年来有机钙补剂如钙螯合肽已经成为研究热点[3],这些小分子肽耗能少、转运速度快,而且是不易饱和的载体[4],应用前景广泛。目前,国内外很多学者已从大豆、罗非鱼、鳕鱼、虾、猪血浆等食源性原料中分离得到具有钙螯合功能的生物活性肽[5-10]。
鹅骨是鹅肉加工过程中的副产物,营养丰富,其蛋白质含量丰富,约为17%[11]。研究表明90%以上的骨蛋白是胶原蛋白[12],而几乎所有骨胶原都是I型胶原蛋白[13]。蒋金利等[14]研究发现小分子鹅骨胶原多肽可以有效促进大鼠骨髓间充质干细胞增殖及向成骨细胞分化,从而起到抑制骨质疏松的作用。然而,从鹅骨胶原蛋白水解物中分离纯化出特定的钙螯合肽的研究却鲜有报道。
本研究以鹅骨胶原蛋白为原料,采用碱性蛋白酶制备钙螯合肽,通过现代色谱分离技术进行纯化,利用液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)、紫外光谱(ultroviolet spectroscopy,UV)和傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)测定其氨基酸序列和结构,合成结构明确的鹅骨胶原蛋白活性肽,并对其活性进行验证。为鹅骨胶原肽补钙剂的制备、结构解析和补钙机理研究提供一定的实验支撑。
1 材料与方法
1.1 材料与试剂
鹅骨胶原蛋白(纯度约90%)由实验室自制;碱性蛋白酶 索莱宝生物科技有限公司;水合茚三酮(分析纯) 国药集团化学试剂有限公司;乙腈、三氟乙酸(均为色谱级) 上海阿拉丁生化科技股份有限公司;0.22 μm滤膜 海门市康健实验器材厂;SephadexG-25美国GE公司;聚乙二醇 美国Particle Sizing Systems公司;其他试剂均为分析纯。
1.2 仪器与设备
H H-4 恒温水浴锅 苏州威尔实验用品有限公司;1515凝胶渗透色谱仪 美国Waters公司;ALPHA2-4LSCp冷冻干燥机 德国Christ公司;1260高效液相色谱仪 美国Agilent公司;NexION 2000电感耦合等离子体质谱(inductively coupled plasma mass spectrometry,ICP-MS)仪 美国PerkinElmer公司;LC-MS/MS仪 加拿大SCIEX公司;Tecan infinite M200 Pro多功能酶标仪 瑞士Tecan公司;FE20实验室pH计 梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 鹅骨胶原蛋白的酶解
鹅骨胶原蛋白的酶解参考Feng Mengmeng等[15]的方法。称取1.0 g冻干的鹅骨胶原蛋白,用去离子水配制成质量分数为1%的鹅骨胶原蛋白溶液,90 ℃加热10 min,用1 mol/L的NaOH溶液和1 mol/L的HCl溶液调节溶液pH值至8.0。酶解条件:温度55 ℃、pH 8.0、碱性蛋白酶与鹅骨胶原蛋白质量比1∶50,时间6 h,酶解过程中每15 min用1 mol/L的HCl溶液调节溶液pH值,并维持至pH值恒定。酶解结束后将酶解液立即放置于95 ℃沸水中灭酶10 min,冷却至室温,3 000×g离心10 min,取上清液低温冷冻干燥,得到鹅骨胶原蛋白酶解冻干粉,-20 ℃备用。
1.3.2 水解度的测定
采用茚三酮比色法[16]测定鹅骨胶原蛋白的水解度。水解度计算公式如下:

式中:0.17 mmol/g为鹅骨胶原蛋白中游离氨基的含量;5.79为胶原蛋白折算系数[17];N为原料中的氮含量;7.6 mmol/g为鹅骨胶原蛋白水解度常数。
水解液中游离氨基含量通过甘氨酸标准曲线计算得到,原料中氨基含量通过凯氏定氮法计算得到[17]。鹅骨胶原蛋白水解度常数是参考谢丽蒙等[18]的方法,根据氨基酸组成含量计算得出。
1.3.3 鹅骨胶原蛋白及酶解物中氨基酸组成测定
采用氨基酸自动分析仪测定鹅骨胶原蛋白和酶解物的氨基酸组成。取1.0 g的鹅骨胶原蛋白及其酶解物于玻璃试管中,加入6 mol/L HCl溶液,试管抽真空,置于110 ℃恒温干燥箱内水解24 h。用氨基酸自动分析仪测定[19]。
1.3.4 分子质量分布的测定
采用凝胶渗透色谱(gel permeation chromatography,GPC)法测定鹅骨胶原蛋白酶解后分子质量分布。
样品制备:取0.3 g鹅骨胶原蛋白酶解物放入5 mL的样品瓶中,加入含0.1 mol/L硝酸钠的超纯水,超声分散后待测。
色谱条件:1515高效液相色谱仪,色谱柱包括Ultrahydrogel 120 Pkgd、Ultrahydrogel 250 Pkgd和Ultrahydrogel 500 Pkgd,Waters 2414示差折光检测器,以含0.1 mol/L硝酸钠的超纯水为流动相,35 ℃条件下以1 mL/min流速洗脱,标准品为窄分布聚乙二醇,分子质量分别为330 000、176 000、82 500、44 000、25 300、20 600、12 600、7 130、4 290、1 400、633 u和430 u。
1.3.5 钙螯合量测定
鹅骨胶原多肽的钙螯合活性的测定参考Cao Yong等[20]的方法。分别称取适量1.3.1节冷冻干燥后的鹅骨胶原多肽粉、无水CaCl2和Na2HPO4,加入一定量蒸馏水,混匀,最终使鹅骨胶原多肽、无水CaCl2和Na2HPO4浓度分别为1 mg/mL、5 mmol/L和0.2 mol/L,调节溶液pH值至8.0,在37 ℃水浴中搅拌2 h,10 000×g离心10 min,取上清液,通过ICP-MS测定上清液钙离子浓度,同时做空白对照。钙螯合量计算公式如下:

1.3.6 Sephadex G-25
凝胶过滤色谱将鹅骨胶原蛋白酶解物进行Sephadex G-25葡聚糖凝胶分离纯化,柱型:1.6 cm×60 cm,样品质量浓度100 mg/mL,上样量为0.5 mL,洗脱速率0.4 mL/min,检测波长220 nm,分别收集各组分,冻干后测定鹅骨胶原蛋白酶解物钙螯合活性。
1.3.7 反向高效液相色谱
将Sephadex G-25分离获得的具有较高钙螯合能力的活性肽进一步经1260高效液相色谱仪纯化,选用ZORBAX Eclipse XDB C18(150 mm×21.2 mm,7 mm)色谱柱。流动相A:水(含0.05%三氟乙酸);流动相B:乙腈(含0.05%三氟乙酸),样品质量浓度为10 mg/mL,上样量100 μL,检测波长214 nm,流速1 mL/min,洗脱条件:100%~80% A,0%~20% B,20 min;80%~75% A,20%~25% B,70 min;75%~10% A,25%~90% B,5 min;10%~85% A,90%~15% B,5 min;85% A,15% B,15 min。每次洗脱结束平衡色谱柱30 min,按图谱收集各组分。
1.3.8 钙螯合肽序列
通过LC-MS/MS测定鹅骨胶原蛋白钙螯合肽的分子质量和氨基酸序列。
使用SCIEX公司的TripleTOF 5600液质联用系统进行质谱分析。C18捕获柱:5 mm×0.3 mm,5 μm,分析柱:75 μm×150 mm,3 μm,线性梯度分离:0 min,95% A,5% B;15 min,95%~65% A,5%~35% B;1 min,65%~20% A,35%~80% B;5 min,20% A,80% B;0.1 min,20%~95% A,80%~5% B;8.9 min,95% A,5% B。流动相A:3%二甲基亚砜(dimethyl sulfoxide,DMSO)、97%水,0.1%甲酸;流动相B:3%DMSO、97%乙腈、0.1%甲酸。柱流速为300 nL/min。
质谱IDA模式分析时,每个扫描循环中包含一个MS全扫描(m/z350~1 500,离子累积时间250 ms),以及40 个MS/MS扫描(m/z100~1 500,离子累积时间50 ms)。MS/MS采集的条件为母离子信号大于120 cps,电荷数为+2~+5。离子重复采集的排除时间为18 s。
TripleTOF 5600 产生的质谱数据通过Mascot Daemon(V2.3.2)进行检索。检索参数如下:Type of search选择MS/MS Ion Search;Fixed modifications选Carbamidomethyl;Variable modifications选择Acetyl、Deamidated、Oxidation;Digestion选Trypsin。检索结果以P<0.05为标准进行筛选。
1.3.9 肽的合成及验证
经质谱鉴定的多肽由生工生物工程(上海)股份有限公司合成,合成肽的纯度和分子质量分别通过反向高效液相色谱配备SHIMADZU Inertsil ODS-SP(4.6 mm×250 mm,5 μm)和电喷雾电离质谱测定,并通过1.3.5节中方法测定合成多肽的钙螯合活性。
1.3.10 UV分析
将鹅骨胶原肽和肽钙螯合物溶于磷酸盐缓冲液,配制成合适浓度,通过UV分析鹅骨胶原肽、钙螯合反应的主要位点,扫描波长范围200~400 nm。
1.3.11 FTIR分析
参考Hasni等[21]的方法稍加修改。在研钵中加入约1 mg的样品,再加入100 mg干燥KBr充分研磨成粉末状,混匀。用FTIR分析鹅骨胶原肽钙螯合位点,波长范围400~4 000 cm-1。
1.4 统计分析
数据统计采用SPSS 18.0进行ANOVA分析,图形制作采用Origin 8.0。
2 结果与分析
2.1 鹅骨胶原蛋白酶解
碱性蛋白酶酶解制备的鹅骨胶原蛋白钙螯合肽,水解度高达52.17%,鹅骨胶原蛋白酶解液的钙螯合活性为48.97 mg/g。Narin等[3]制备的罗非鱼肉蛋白钙螯合肽,酶解6 h水解度最大,达到47.8%,此时钙螯合活性为40~50 mg/g,与本实验结果相似。鹅骨胶原蛋白酶解物具有较高的钙螯合活性,可用于进一步的分离纯化。
2.2 氨基酸组成分析
鹅骨胶原蛋白及酶解物的氨基酸组成如表1所示。鹅骨胶原蛋白总氨基酸质量分数约为80.98%,酶解后总氨基酸质量分数上升达到91.43%。鹅骨胶原蛋白中Gly质量分数最高,约为29%,Pro次之,为9.53%,符合胶原蛋白的氨基酸特征[22],人体必需氨基酸占氨基酸总量的11.18%;鹅骨胶原酶解物中含量最高的也是Gly,但含量比酶解前低,约为24%,Glu的质量分数次之,为12.67%,各种人体必需氨基酸的含量均增大,总量高达24.94%。Liu Fengru等[23]发现Glu、Asp、Ser、Thr、Met和Tyr等对钙离子鳌合活性贡献较大,而这些氨基酸在鹅骨胶原蛋白中含量丰富,质量分数达到20.71%,说明鹅骨胶原蛋白是制备钙鳌合肽的良好来源,酶解后胶原多肽中这些氨基酸的含量均升高,总量高达35.05%,说明鹅骨胶原蛋白酶解物具有良好的钙螯合活性。

表1 鹅骨胶原蛋白及多肽氨基酸组成Table 1 Amino acid composition of collagen and collagen peptides from goose bone
2.3 鹅骨胶原蛋白酶解物分子质量分布

图1 鹅骨胶原蛋白酶解物GPC(A)聚乙二醇标准曲线(B)Fig. 1 GPC profile of goose bone collagen hydrolysate (A) and standard curve of polyethylene glycol (B)

表2 鹅骨胶原蛋白酶解物分子质量分布Table 2 Molecular mass distribution of goose bone collagen hydrolysate
如图1所示,A为鹅骨胶原蛋白酶解物GPC,结合B聚乙二醇分子质量标准曲线,计算得到鹅骨胶原蛋白酶解物的分子质量分布,如表2所示,分子质量低于7 000 u的鹅骨胶原肽占总体的85.54%,分子质量在3 000 u以下的占总体的64.96%。研究表明,小分子多肽具有更高的生物活性,易被人体吸收[24],而且多肽的分子质量大小也能影响金属螯合活性[25],Jiang等[26]研究了卵黄高磷蛋白肽分子质量与钙螯合活性的关系,发现1 000~3 000 u的组分的钙螯合活性高于酪蛋白磷酸肽,Liu Fengru等[23]也有相似的发现,在不同分子质量麦胚蛋白肽组分中,低于2 000 u的组分,钙螯合活性最高。分子质量大小对多肽钙螯合活至关重要,这也解释了凝胶纯化的组分钙螯合能力显著高于鹅骨胶原蛋白酶解物的原因。
2.4 鹅骨胶原蛋白钙螯合肽的分离纯化
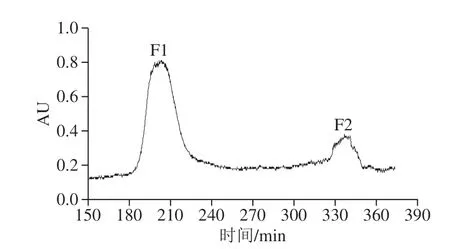
图2 SephadexG-25凝胶过滤色谱Fig. 2 Sephadex G-25 gel filtration chromatogram
如图2所示,鹅骨胶原蛋白酶解物经SephadexG-25凝胶柱洗脱得到2 个组分,即F1和F2。收集各组分冻干,进行钙螯合活性验证。由表3可知,组分F1具有较高的钙螯合能力(55.84 mg/g),显著高于F2(P<0.05),因此,选择组分F1进行液相分离。

表3 鹅骨胶原肽钙螯合活性Table 3 Calcium-chelating activity of goose bone collagen peptides

图3 反向高效液相色谱Fig. 3 Reverse high-performance liquid chromatogram
如图3所示,SephadexG-25纯化组分F1经反向高效液相色谱分离图谱,0~10 min内出现的是溶剂峰,而样品峰主要集中在95~125 min内,样品峰中杂峰少,说明经Sephadex G-25纯化后的样品纯度较高,分别收集2 个洗脱峰F1-1和F1-2。通过钙螯合实验,发现峰F1-1的钙螯合活性更强,达到65.19 mg/g显著高于F1-2(P<0.05),因此收集组分F1-1。
2.5 质谱鉴定结果
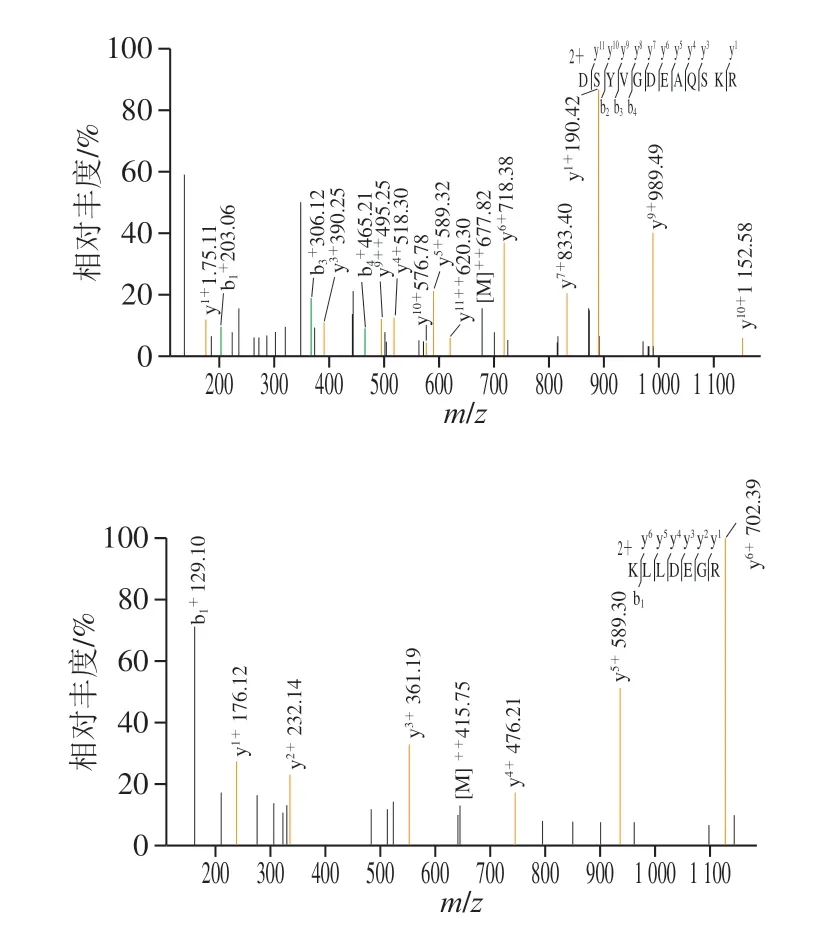
图4 DSYVGDAQSKR和KLLDGR二级质谱图Fig. 4 Tandem mass spectra of DSYVGDEAQSKR and KLLDEGR
将F1-1组分进行LC-MS/MS鉴定,通过搜索NCBI水禽蛋白数据库、Mascot比对质谱和可信度分析,从鉴定结果中选择氨基酸序列为DSYVGDEAQSKR和KLLDEGR的活性肽作为鹅骨胶原蛋白钙螯合肽,分子质量分别为1353.62u和829.47u,如图4所示。 DSYVGDEAQSKR和KLLDEGR来源于tr|U3IRK7|U3IRK7_ANAPL(41-52)和tr|U3I3T1|U3I3T1_ANAPL(123-129)。
将DSYVGDEAQSKR和KLLDEGR进行化学合成,纯度为98.24%和97.19%。对合成肽进行钙螯合活性验证,钙螯合能力分别为70.08 mg/g和68.18 mg/g,均显著高于(P<0.05)鹅骨胶原蛋白酶解物的钙螯合量,活性肽中酸性氨基酸的含量高,具有更好的钙螯合活性。Huang Shunli等[27]从乳清蛋白水解产物中分离得到分子质量为204 u的二肽EG,钙螯合能力为67.81 μg/mg;Jeon等[28]从小球藻蛋白水解物中分离纯化得到序列为NSGC的钙螯合肽,钙螯合能力为0.166 mmol/L;Wang Li等[29]从小麦胚芽蛋白水解物中分离得到了一种新型钙螯合肽FVDVT,钙螯合能力高达(89.94±0.75)%。这些钙螯合肽的分子质量均低于3 000 u,且氨基酸序列中含有Asp、Glu、Ser和Thr。Kumagai等[30]和Liu Fengru等[23]研究发现Asp和Glu是主要的钙螯合位点,此外Ser、Thr、Met和His等也对钙离子螯合活性贡献较大。
2.6 UV分析
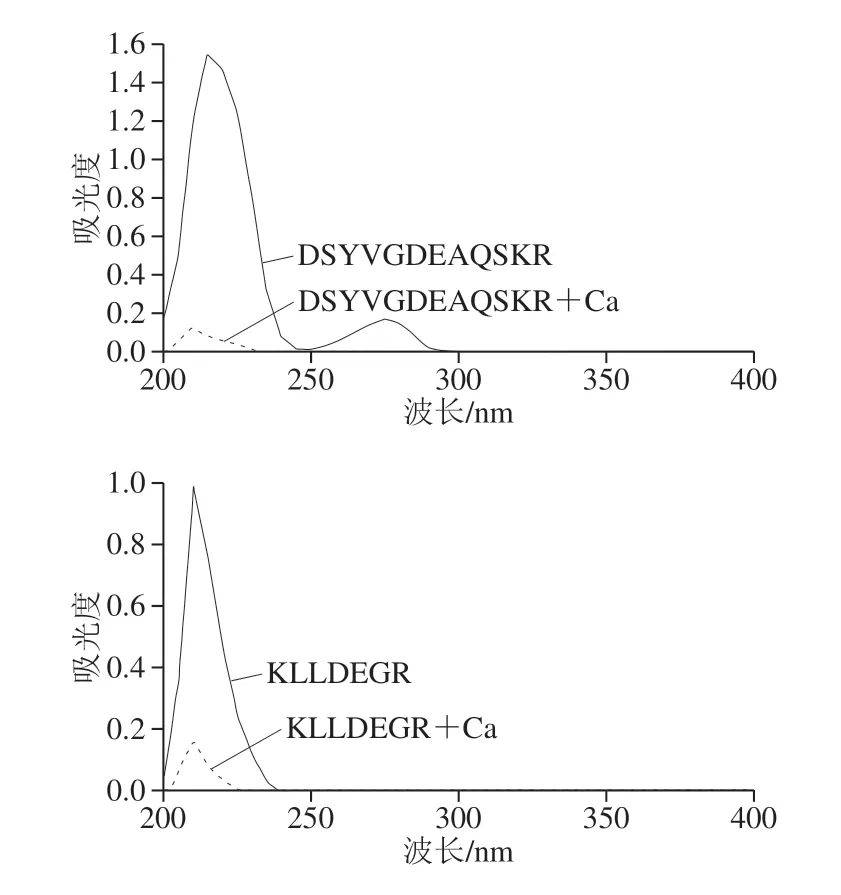
图5 鹅骨胶原蛋白钙螯合肽及其钙螯合物的UV图Fig. 5 UV absorption spectra of calcium-chelating peptide from goose bone collagen and peptide-calcium chelate
如图5所示,钙离子加入后,鹅骨胶原肽的UV发生显著变化,说明鹅骨胶原肽与钙离子发生了螯合反应。在210 nm波长附近出现最大吸收峰,这说明鹅骨胶原肽中存在羧基、羰基和肽键,在与钙离子螯合后,最大吸收峰的吸收强度降低,出现减色效应,这可能是羧基和氨基与钙离子螯合作用的结果。这与Liu Guo等[31]的研究结果一致。
2.7 FTIR分析
如图6所示,酰胺有2 个最重要的振动模式,分别是酰胺I带(C=O伸缩振动,1 690~1 630 cm-1)和酰胺II带(N—H弯曲振动(40%~60%)和C—N伸缩振动(18%~40%),1 655~1 590 cm-1)[32]。鹅骨胶原肽DSYVGDEAQSKR、KLLDEGR的酰胺I带和酰胺II带的峰值分别为1 655.59、1 547.59 cm-1和1 667.16、1 541.82 cm-1。钙离子加入后,鹅骨胶原肽钙螯合物的酰胺I带和酰胺II带发生红移,峰值变小为1 638.23、1 544.70 cm-1和1 638.23、1 617.98 cm-1,可能是鹅骨胶原肽氨基酸残基上的羧基参与钙螯合。鹅骨胶原肽钙螯合物的N—H键波数分别为3 465.46 cm-1和3 413.19 cm-1高于鹅骨胶原肽的N—H键波数3 290.93 cm-1和3 284.18 cm-1,可能是钙离子的加入影响了鹅骨胶原肽的N—H键,使N—H键发生了蓝移。推测鹅骨胶原肽主要通过氨基酸残基上的羧基和氨基螯合钙离子。这与Hu Huo[33]和Liu Fengru[23]等的结果相似。

图6 鹅骨胶原蛋白钙螯合肽及其钙螯合物的FTIR图Fig. 6 Infrared spectra of calcium-chelating peptide from goose bone collagen and peptide-calcium chelate
3 结 论
本研究从鹅骨胶原多肽中分离筛选纯化出钙螯合活性肽DSYVGDEAQSKR、KLLDEGR,分子质量分别为1 353.62、829.47 u,钙螯合量分别为70.08 mg/g和68.18 mg/g,钙螯合活性良好。氨基酸分析表明鹅骨胶原多肽富含Glu(12.67%)和Asp(7.47%)。UV和FTIR结果表明鹅骨胶原肽DSYVGDEAQSKR、KLLDEGR主要通过氨基酸残基上的羧基和氨基与钙离子螯合。
