淫羊藿苷与补肾固齿丸对大鼠慢性牙周炎牙槽骨重建的比较研究
2020-12-12廖丹葛颂
廖丹, 葛颂
遵义医科大学附属口腔医院,贵州 遵义(563000)
牙周病是中老年人牙齿丧失的最主要原因[1]。目前临床上牙周病以牙周基础治疗及牙周手术治疗为主,重度、急性、伴有系统病等患者需选择增加药物辅助治疗。中成药补肾固齿丸能达到扶正祛邪、固齿强身的目的,固齿丸治疗牙周炎,特别是青少年牙周炎有较好的临床疗效,可减缓牙槽骨的吸收、延迟复发[2]。随着对中药逐步深入研究,治疗骨质疏松药物淫羊藿苷(icariin,ICA)[3]引起了广泛的关注。研究表明ICA 有促进成骨、提高新骨量,促进骨成熟,促进成骨细胞增殖、牙周膜干细胞增殖及骨向分化的作用,并且从作用机制层面探讨了ICA 对成骨细胞的促进作用[4⁃10]及对破骨细胞的抑制作用[4]。动物实验表明ICA 作为生物活性因子结合生物支架在促进成骨及骨成熟方面有显著效果[11],联合抗炎药物可治疗种植体周围炎细菌诱导的骨丢失[5]。但是在体内慢性牙周炎症情况下,ICA 作为独立影响因素是否仍具有促进成骨作用以及对成骨、破骨细胞的影响尚不明确。为探究临床慢性牙周炎患者口服ICA 的治疗效果及可能机制,本研究使用不同浓度的ICA 和补肾固齿丸给慢性牙周炎模型SD 大鼠连续灌胃1、2 个月,以补肾固齿丸为参照,检测血清骨转换标志物骨钙素(osteocalcin,OCN)水平,观察机体骨代谢情况;显微CT(micro computed tomogra⁃phy,Micro⁃CT)扫描实验牙后三维重建,观察牙周骨立体结构、微结构改变,测量分析牙槽骨高度吸收值;应用HE 染色和甲苯胺蓝染色从组织学角度观察治疗前后牙周组织变化,多角度评价ICA 改善慢性牙周炎牙周组织的效果,为中药治疗牙周病在临床获得更好的牙周组织修复再生提供依据。
1 材料与方法
1.1 实验动物、试剂、器械与设备
60 只健康普通级雄性SD 大鼠,体质量170~190 g,购于第三军医大学实验动物中心,实验动物质量合格证SCXK(渝)2102⁃0005。
ICA 由江苏南通飞宇生物科技有限公司提供(批号:FY17420110),补肾固齿丸药粉由成都九芝堂金鼎药业有限公司提供(批号:Z⁃51021248)。
牙周探针、龈下洁治器械、手术剪、持针器、一次性使用口腔器械盒、骨钳、12 号灌胃针、50 mL 烧杯、Micro⁃CT(Scanco Medical,瑞士)、硬组织切磨系统(EXAKT Verteriebs,德国)。
1.2 建模方法
60 只大鼠随机分成2 组:正常组9 只,牙周炎模型组51 只,正常组不做任何处理,牙周炎模型组予10%水合氯醛按0.3 mL/100 g 腹腔注射麻醉,取仰卧位,固定于鼠板,消毒,铺巾,用探针锐性分离右侧上颌第二磨牙牙龈,用4⁃0 无菌医用丝线牙周结扎2 圈,置丝线于龈下,术后予高糖饮食2 个月。定期检查丝线结扎情况,若有脱落应及时重新结扎。正常组予普通饮食2 个月。每2 周测量尾静脉血血糖,数值均小于随机血糖值16.7 mmol/L。本实验研究所有动物实验已通过遵义医科大学动物实验中心的动物实验伦理审查。
1.3 组织学观察建模情况
建模结束后,正常组、牙周炎模型组分别选取3 只处死,迅速分离右侧上颌骨,4%多聚甲醛固定24 h,通过病理组织切片观察实验大鼠右侧上颌第二磨牙牙周组织的变化,确定建模是否成功。
1.4 ICA 与补肾固齿丸治疗大鼠实验性牙周炎
1.4.1 实验分组 建模成功后,牙周炎模型组剩余的48 只大鼠去除结扎丝线,龈下刮治器刮除实验牙及两颗邻牙牙周软垢及牙石,双蒸水注射器冲洗,正常饲养1 周后随机分为4 组,每组12 只。分别为慢性牙周炎组(periodontitis group,P 组)、ICA低剂量组(ICA low dose group,L 组)、ICA 高剂量组(ICA high dose group,H 组)及补肾固齿丸组(Bu⁃Shen⁃Gu⁃Chi⁃Wan group,B 组)。剩余6 只正常大鼠为正常组(normal group,N 组),采用相同方法进行牙周基础治疗。基础治疗后所有大鼠正常饲养1周后开始给药。给药方案:①P 组和N 组,双蒸水10 mL/(kg·d),ig;②L 组,20 mg/(kg·d)[12],ig;③H组,ICA 40 mg/(kg·d),ig;④B 组,补肾固齿丸0.8 g/(kg·d)[13],ig;。
1.4.2 血清骨转换标志物测定 血清的收集与保存:分别于灌胃1个月、2个月,各组大鼠12 h禁食禁饮,颈总动脉放血收集血浆,4 ℃离心3 000 r/min,10 min,EP 管分装血清,立即送至遵义医科大学附属医院检验科通过德国Roche 公司cobas e601 全自动电化学发光免疫分析仪检测血清OCN水平。
1.5 Micro⁃CT 三维影像学分析
1.5.1 设备及方法 Micro⁃CT:电压70 kVp,电流200 μA,功率14 W,分辨率15.0 μm,曝光时间300 ms。VGstudio Max3.0 软件重建/分析采集的扫描数据。各组大鼠处死后,分离出右侧上颌牙槽骨,置于4%多聚甲醛中保存备用。固定1 周后送至四川大学华西口腔医学院口腔疾病研究国家重点实验室扫描Micro⁃CT,获取图像,每个样本扫描80~90 min。图像采集完成后,选取右侧上颌第二磨牙根分叉区作为兴趣区(the region of interest,ROI),软件分析,三维重建,获取数据。
同时测量右侧上颌第二磨牙牙冠6 个位点的釉质牙骨质界到牙槽嵴顶的距离(cement⁃to⁃enam⁃el junction⁃ alveolar bone crest,CEJ⁃ABC)。VGstu⁃dio Max3.0 软件分析断层图像,将实验牙牙体长轴与Y 轴平行,面近远中向长轴与X 轴平行,面与Z 轴平行。测量实验牙6 个位点分别为:近颊尖(mesio⁃buccal cusp,MBC)/近 腭 尖(mesio⁃palatal cusp,MPC)、颊沟(buccal groove,BG)/腭沟(palatal groove,PG)、远颊尖(disto⁃buccal cusp,DBC)/远腭尖(disto⁃palatal cusp,DPC)。测量某位点的CEJ⁃ABC 时,使Y 轴通过该位点,并在该面测量该处的CEJ⁃ABC。计算6 个位点的总值作为上颌第二磨牙的牙槽骨吸收值,进行统计学分析。由于本实验部分实验牙颊面颈部釉质缺损较大,CEJ⁃ABC 测量误差较大,因此计算实验牙腭侧3 个位点的总值作为上颌第二磨牙的牙槽骨吸收值。
1.5.2 检测指标 ①骨体积分数(bone volume/tis⁃sue volume,BV/TV):骨性结构的体积与样本总体积的比值,即矿化组织的比值(%),该数值越大,表明骨小梁含量越多。②骨小梁数目(trabecular number,Tb.N):用于描述骨量变化(mm⁃1),在骨小梁厚度一定的前提下,数量越多,骨量越多。③骨小梁分离度(trabecular separation,Tb.Sp):指骨小梁之间的平均距离(mm),用于描述骨小梁结构形态,骨小梁之间的距离越大,分离度越大。④骨小梁厚度(trabecular thickness,Tb.Th):指骨小梁的平均厚度(mm),当发生骨质疏松时,Tb.Th 数值变小。⑤牙槽骨吸收值(alveolar bone absorption):以CEJ⁃ABC 作为牙槽骨吸收的参考标准,吸收值越大,说明牙槽骨丧失越明显。
1.6 组织学观察
将每组大鼠牙槽骨标本扫描micro⁃CT 后行对半切开,一部分行常规脱钙后进行HE 染色,另一部分仅酒精梯度脱水后制作硬组织切片,行甲苯胺蓝染色,镜下观察实验牙牙周组织情况。
1.7 统计学分析
使用SPSS18.0 软件,所有定量资料数据用x±s表示,多组间均数比较,采用单因素方差分析,两组间均数比较,采用LSD 法检验,检验水准α=0.05。
2 结 果
2.1 大鼠牙周炎模型的建立
病理组织学观察显示(图1),相较于正常组,牙周炎模型组SD 大鼠上颌第二磨牙牙龈增生,结合上皮向根方增殖、延伸,附着丧失严重,大量炎性细胞浸润,牙槽嵴顶高度降低,牙槽骨吸收明显。而正常组结合上皮位于釉牙骨质界处,无明显炎性细胞浸润,牙槽嵴顶未见吸收。
2.2 给药后各组血清骨转换指标的测定
如表1 所示,与N 组相比,P 组的血清OCN 水平明显升高;与P 组相比,L 组、H 组和B 组OCN 水平明显下降,差异有统计学意义(P<0.05),提示ICA 有减缓实验性大鼠慢性牙周炎牙槽骨吸收的可能性。灌胃2 个月与1 个月相比,H 组、B 组血清OCN 水平降低,提示随着用药时间延长,一定浓度的ICA 可能减缓实验性牙槽骨吸收的作用越明显。

Figure 1 Pathological observation of normal group and periodontitis model group after modeling图1 建模结束后正常组与牙周炎模型组病理学观察

表1 给药1、2 个月各组血清OCN 浓度Table 1 Serum OCN concentrations in each group 1 month and 2 months after administration ng/mL,x±s
2.3 Micro⁃CT 扫描结果
2.3.1 三维重建结果 给药1 个月和2 个月,各治疗组(B、H、L 组)牙槽嵴顶高度均大于P 组(图2)。2.3.2 ROI 骨参数定量分析 给药1 个月时,相较于N 组,P 组BV/TV、Tb.Th、Tb.N 值明显减小,Tb.Sp明显增大,差异有统计学意义(P<0.05);与P 组相比,H 组、L 组及B 组BV/TV、Tb.N 值明显增大,H组、B 组Tb.Th 值明显增大、Tb.Sp 值明显减小,差异有统计学意义(P<0.05);而L 组Tb.Th 值稍增大、Tb.Sp 值稍减小,差异无统计学意义(图3)。
给药2 个月,相较于N 组,P 组各参数值变化趋势与1 个月一致,差异均有统计学意义(P<0.05);H 组、L 组及B 组BV/TV、Tb.N、Tb.Th、Tb.Sp值变化趋势与给药1 个月相似,并且BV/TV、Tb.N、Tb.Sp 值变化与P 组相应指标差异有统计学意义(P<0.05)。除L 组外,H 组、B 组Tb.Th 与P 组差异有统计学意义(P<0.05)。
各治疗组Tb.N、Tb.Sp 给药2 个月与给药1 个月的差异(图3)具有统计学意义(P<0.05)。
骨参数定量分析结果显示,H 组、L 组及B 组具有不同程度的牙槽骨修复甚至再生,H 组新生牙槽骨较L 组有所增加,H 组与B 组新生骨量无明显差异,而给药2 个月较1 个月成骨效果更佳。
2.3.3 各组牙槽骨吸收值比较分析 P 组大鼠牙槽骨吸收值较N 组升高,差异有统计学意义;L 组及H 组较P 组牙槽骨吸收值降低,差异有统计学意义(P<0.05),B 组牙槽骨吸收值在给药1 个月时稍降低,差异无统计学意义,在灌胃2 个月时明显降低,差异有统计学意义(P<0.05)(表2)。
2.4 HE 染色
给药1 个月(图4),相较于N 组,P 组牙龈上皮增生明显,固有层内见明显炎症细胞浸润,但较建模时有所减少,结合上皮向根方增殖移位,牙周袋形成;牙槽骨表明见凹坑状吸收陷窝和破骨细胞,牙周膜纤维变性,可见纤维断裂。B 组、H 组、L 组均表现牙龈上皮少量增生,固有层少量中性粒细胞浸润;有类骨质形成,骨化中心可见成骨细胞成排排列;成纤维细胞活跃。
给药2 个月(图5),P 组表现出牙龈增生明显,固有层内见明显炎症细胞浸润,但较给药1 个月时有所减少,结合上皮附着向根方移位;牙槽骨表面见凹坑状吸收陷窝及逐渐凋亡的破骨细胞。B 组较牙周炎组表现牙龈上皮未见明显增生,固有层少量中性粒细胞浸润;有类骨质形成,可见骨化中心成骨细胞成排排列;可见新生牙周膜纤维束埋入新形成的牙槽骨中;大量活跃的成纤维细胞。H组、L 组牙龈上皮增生不明显,固有层内少量中性粒细胞浸润;有类牙骨质形成,可见骨化中心成骨细胞成排排列;大量活跃的成纤维细胞。

Figure 2 Three⁃dimensional reconstruction of Micro⁃CT in each group 1 and 2 months after treatment图2 给药1、2 个月后各组Micro⁃CT 三维重建图像
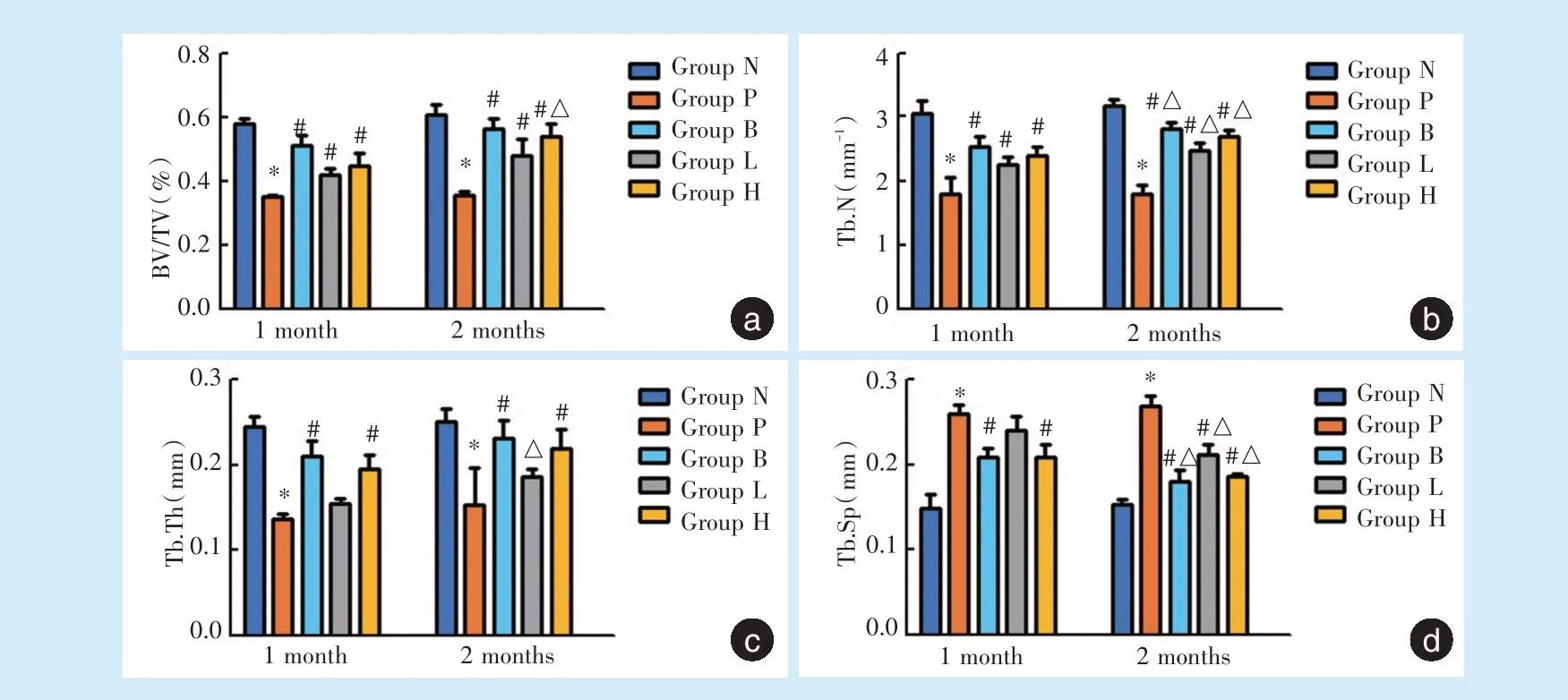
Figure 3 Quantitative analysis of micro⁃CT measurement parameters in each group 1 month and 2 months after administration图3 给药1、2 个月各组micro⁃CT 测量参数定量分析
2.5 硬组织切片甲苯胺蓝染色
甲苯胺蓝染色(toluidine blue staining,TB)结果显示,灌胃1 个月,P 组多为原有的淡紫色牙槽骨,几乎看不到类骨质及新生牙槽骨,H、L 组及B 组均观察到类骨质形成。与1 个月相比,灌胃2 个月时,H、L、B 组的新生牙槽骨更多,能看到与原矿化骨之间有明显的分界线,在新生骨边缘有浅蓝色的类骨质,牙周炎组仍未见明显新牙槽骨形成(图6、图7)。
3 讨 论
如何改善破坏的牙周组织,促进牙槽骨修复再生是牙周病治疗中的关键环节之一。近年来随着牙周组织工程的发展,牙周组织再生有了新的希望[14]。大量研究表明,生物活性因子ICA 在牙体牙髓牙周病学、口腔种植、口腔正畸等多个口腔医学领域有一定的作用,如口服给予ICA 对大鼠正畸牙齿移动(orthodontic tooth movement,OTM)有积极的影响[12]。Wu 等[15]使用磷酸钙骨水泥支架构建ICA 递送系统,并装载BMSCs,作用于去卵巢大鼠的颅骨缺损,同时25 mg/(kg·d)ICA 灌胃,局部用药联合全身系统性给药达到最佳的骨修复效果。杨卫等[16]使用25 mg/kg ICA 口服给药观察ICA 对骨质疏松牙周炎小鼠牙槽骨吸收的影响,发现ICA口服给药在有效预防骨质疏松发生的同时,可减少牙周炎引起的牙槽骨吸收,并认为此作用来自或部分来自ICA 对成骨细胞的分化和矿化作用。本实验用不同浓度的ICA 和补肾固齿丸给慢性牙周炎模型实验大鼠连续灌胃,通过血清骨转换标志物检测、Micro⁃CT 扫描、组织学观察等多种方法探究其对牙槽骨吸收的作用效果,为中药防治牙周炎提供一定的实验依据。

表2 Micro⁃CT 测量各组牙槽骨吸收值比较Table 2 Micro⁃CT measurement of alveolar bone absorption in each group

Figure 4 Observation of improvement in periodontal tissue 1 month after treatment by HE staining图4 HE 染色观察给药1 个月牙周组织改善情况
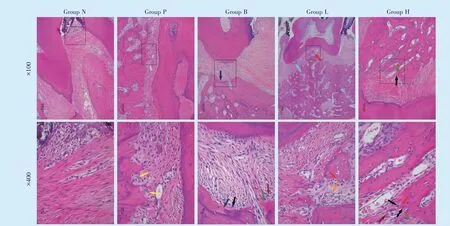
Figure 5 Observation of improvement in periodontal tissue after 2 months of treatment图5 HE 染色观察给药2 个月牙周组织改善情况

Figure 6 Observation of improvement in periodontal tissue 1 month after treatment by toluidine blue staining图6 甲苯胺蓝染色观察给药1 个月牙周组织改善情况
在牙周炎的发生发展过程中,牙槽骨不断的进行骨转换,包括了骨吸收与骨形成连续复杂的过程,在此过程中骨吸收与骨形成相互偶联,OCN则是反映骨转换的标志物,当牙槽骨吸收活跃时,牙槽骨骨转换率升高,血清中的OCN 浓度可能升高。Yang 等[17]等观察补肾固齿丸对大鼠实验性牙周炎牙槽骨重建的影响,结果发现补肾固齿丸组的血清OCN 浓度显著低于牙周炎模型组,认为给予补肾固齿丸能够降低大鼠牙槽骨的骨转换率,减缓牙周炎进程中的牙槽骨吸收。本实验选用OCN 作为骨转换敏感指标,探究在ICA 用药情况下SD 大鼠慢性牙周炎模型牙槽骨骨代谢情况。与N 组大鼠比较,P 组大鼠血清OCN 水平明显升高;H组、L 组及B 组较P 组血清OCN 水平明显下降,差异有统计学意义。提示给予ICA 和补肾固齿丸能降低大鼠牙槽骨的骨转换率,改善牙周骨代谢,减缓牙周炎进程中的牙槽骨吸收。
组织病理形态计量法为金标准,CT 测量结果与病理结果高度一致,是目前评价骨结构较常用的方法[18]。Micro⁃CT 可清晰扫描骨小梁立体结构,进行3D 重建,并精确计量骨参数,分析骨组织的“质”与“量”,同时进行各种数据测量。本实验计量了ROI 的骨小梁的数目(Tb.N)、骨小梁分离度(Tb.Sp)以及骨小梁厚度(Tb.Th)反映根分叉区ROI牙槽骨的质,以骨体积分数(BV/TV)来反映新生牙槽骨的量,当骨质疏松时,Tb.N、Tb.Th、BV/TV 均会减小。同时测量标本腭侧3 个位点CEJ⁃ABC 之和反应牙槽骨吸收程度,探讨用药前后牙槽骨吸收的变化。在实验性牙周炎模型SD 大鼠灌胃1、2 个月后,对各组BV/TV、Tb.N、Tb.Sp 以及Tb.Th 进行单因素方差分析,结果显示补肾固齿丸能促进实验性牙周炎的牙槽骨修复与丁一等[13]的实验结果相一致。而本研究结果表明,高剂量ICA 同样可促进实验性牙周炎的修复改建,促进作用与B 组相比,差异无统计学意义;L 组与B 组有显著差异,差异有统计学意义;给药2 个月较给药1 个月成骨效果更佳。所有骨参数分析结果均表明ICA 在减缓牙槽骨吸收的进程中发挥积极作用。形态学分析结果显示,P 组大鼠牙槽骨吸收值较正常组升高,差异具有统计学意义;H 组、L 组牙槽骨吸收值较P 组降低,差异具有统计学意义,B 组牙槽骨吸收值在给药1 个月稍降低,而在给药2 个月时明显降低,差异有统计学意义。结果同样显示ICA 在一定程度上能改善牙周牙槽骨吸收和骨破坏。同时还发现,无论在骨参数方面还是骨吸收值方面,ICA 高剂量组改善牙槽骨吸收效果优于低剂量组。
HE 染色结果显示,在给药1、2 个月,H、L、B 组均观察到牙龈上皮增生不明显,上皮及固有层内少量炎性细胞浸润,有新生牙骨质及牙槽骨形成,成骨细胞成排排列,偶见少量破骨细胞,而P 组形成深牙周袋,大量炎性细胞浸润,牙槽骨形成骨吸收陷凹。硬组织切片显示H、L、B 组均观察到浅蓝色的类骨质,而P 组不明显。
本研究以SD 大鼠为实验对象,“丝线结扎+高糖饮食”2 个月成功建立大鼠慢性牙周炎模型,分别给予ICA、补肾固齿丸治疗1、2 个月后,通过检测大鼠血清骨代谢标志物变化,显微CT 三维重建定量分析各组骨参数以及釉⁃牙骨质界⁃牙槽嵴顶(CEJ⁃ABC)的距离,制作组织切片镜下观察牙周组织变化。各项指标结果分析认为ICA 具有改善牙槽骨代谢状况,促进牙槽骨改建,延缓牙周组织破坏的作用,一定程度上辅助治疗牙周炎,为其应用于临床获得更好的牙周组织再生提供一定的实验依据。
