B 细胞激活因子在牙周炎发生发展中的作用
2020-12-12张正王左敏
张正, 王左敏
1.天津市口腔医院,天津市口腔功能重建重点实验室,南开大学口腔医院牙周科,天津(300041); 2.首都医科大学附属北京朝阳医院口腔科,北京(100020)
牙周炎为人类最为常见的免疫炎症性疾病之一,同时也是引起牙齿缺失和危害全身健康主要的口腔疾病[1]。牙周致病菌感染诱发的宿主过度免疫反应被认为是牙周炎发病的重要机制,涉及的主要免疫细胞包括:中性粒细胞、单核细胞/巨噬细胞、T 细胞和B 细胞等[2]。笔者所在课题组前期通过调控B 细胞免疫反应明显改善了牙周炎的组织破坏程度,这说明针对B 细胞的调控有潜力成为牙周炎的治疗策略[3]。B 细胞激活因子(B cell acti⁃vating factor,BAFF)是B 细胞发育必不可少的细胞因子,其在增强B 细胞免疫炎症反应方面具有重要作用[4]。BAFF 已被证实能够调控牙周炎B 细胞免疫反应和组织破坏过程,但BAFF 的牙周致病机制尚未完全明了[5]。本文将就BAFF 在牙周炎发生和进展中的表达及作用进行综述,旨在为开展BAFF牙周致病机制研究提供依据。
1 BAFF 的生物学特性
BAFF 是B 细胞分化和保持稳态的关键调节因子,又称为B 淋巴细胞激活因子(B lymphocyte stim⁃ulator,BLyS),属于肿瘤坏死因子(tumor necrosis factor,TNF)超家族的一员[6]。BAFF 能够在细胞表面以膜结合形式表达,是一种由285 个氨基酸组成的Ⅱ型跨膜蛋白。在经过蛋白酶切割后,BAFF 还能够以可溶性蛋白(由152 个氨基酸组成)的形式释放至胞外[7]。在免疫炎症反应中,机体多种免疫细胞均能表达和分泌BAFF,包括:T 细胞、单核细胞、巨噬细胞、中性粒细胞、树突状细胞以及自然杀伤细胞等[8](图1)。
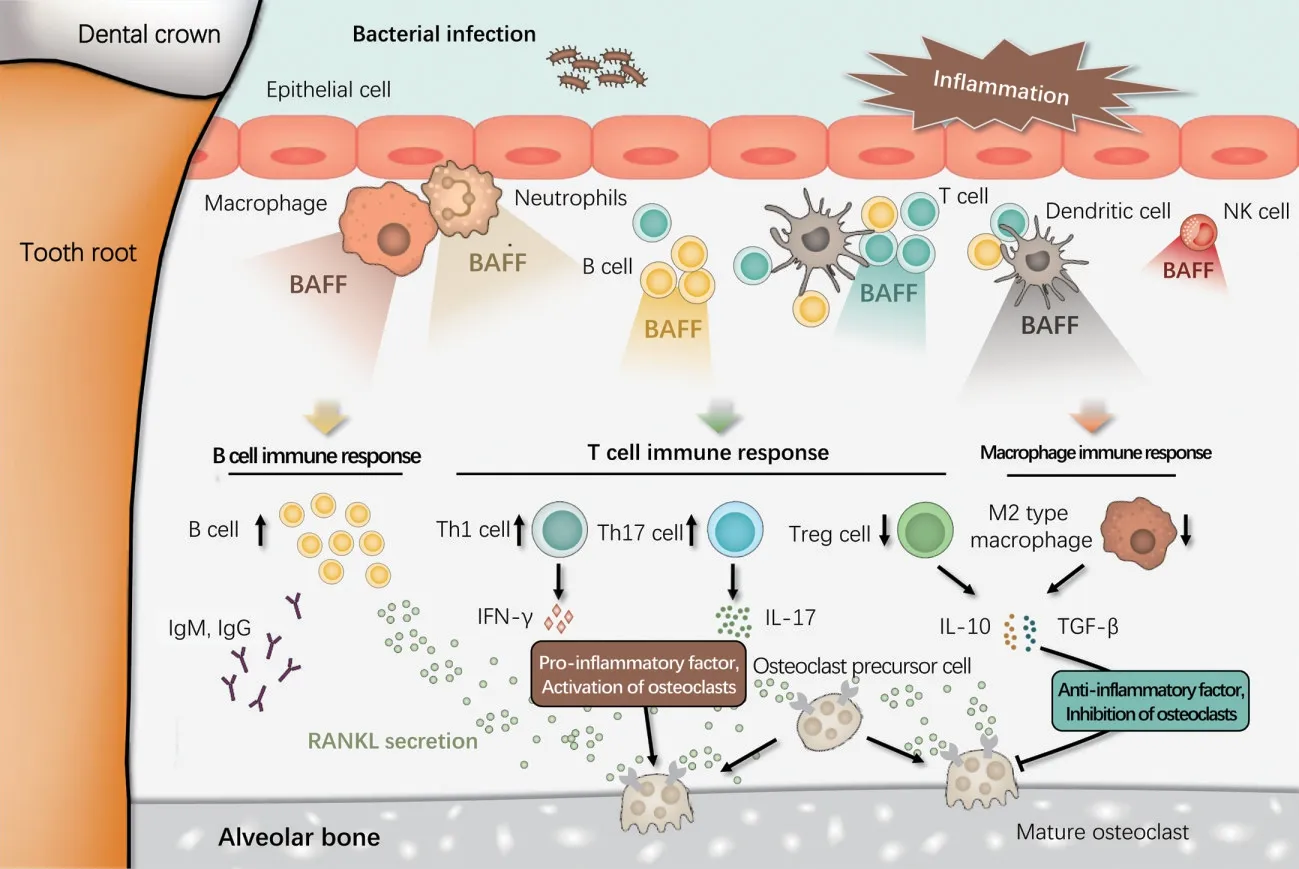
Figure 1 The expression and role of BAFF in periodontitis图1 BAFF 在牙周炎发生和进展中的表达及作用
BAFF 可通过结合于三种受体发挥生物学功能,分别是BAFF 受体(BAFF receptor,BAFF⁃R),B细胞成熟抗原(B cell maturation antigen,BCMA)和跨膜激活剂及钙调亲环素配体相互作用分子(transmembrane activator and calcium modulating cy⁃clophilin ligand interactor,TACI)[9]。这三种受体可在不同发育阶段的B 细胞中表达,其中BAFF⁃R 是B 细胞发育过程中第一个表达的受体,也是过渡性和幼稚B 细胞存活所需的唯一受体,它对于维持幼稚B 细胞的存活至关重要[8]。BCMA 可在生发中心B 细胞和终末分化B 细胞中表达[8],其功能则仅限于维持浆细胞的稳定和B 细胞的抗原提呈[10]。TACI 主要在活化的B 细胞中表达[8],TACI 主要负责调节BAFF 诱导的浆细胞生成和T 细胞非依赖性的免疫球蛋白的类型转换和分泌[10]。
2 BAFF 在牙周炎发生和进展过程中的表达
近年来,BAFF 已被证实能够在系统性红斑狼疮[11],类风湿性关节炎[12]和慢性阻塞性肺病[13]等多种免疫炎症性疾病中发挥关键致病作用。牙周炎作为一种常见的免疫炎症性疾病,同样存在BAFF 的高表达。
2.1 BAFF 在牙周炎患者唾液、龈沟液和牙龈组织中的表达
牙周炎发生和进展过程中,BAFF 被发现能够高表达于唾液、龈沟液和牙龈组织。早在2005 年Pers 等[14]就发现,舍格伦综合征患者唾液中升高的BAFF 表达与牙周临床指标,特别是牙周探诊深度(probing depth,PD)显 著 正 相 关(R2=0.70,P<0.01)。Gümüş 等[15]对101 例有妊娠期糖尿病的妊娠期女性进行龈沟液BAFF 检测后,发现有牙龈炎症的妊娠期糖尿病女性龈沟液内BAFF 表达水平显著高于无牙龈炎的妊娠期糖尿病女性。Akcalı等[16]对全身健康人群进行牙周检查和BAFF 检测后,发现牙龈炎患者唾液和龈沟液内BAFF 表达水平均高于牙周健康者,同时唾液和龈沟液内BAFF表达水平均与菌斑指数(plaque index,PI)(唾液:r=0.39,P<0.01;龈沟液:r=0.61,P<0.01)和牙周探诊出血(bleeding on probing,BOP)(唾液:r=0.29,P<0.05;龈沟液:r=0.52,P<0.01)显著正相关。Abe 等[5]在对临床牙周炎样本和实验动物模型进行分析后,发现牙周炎患者和实验动物局部牙龈组织BAFF 基因和蛋白表达水平均显著增加。可以看出,牙周炎症状态下,口腔内存在明显增高的BAFF 表达,高表达的BAFF 甚至在牙龈炎症时即可出现。
2.2 BAFF 在牙周炎患者外周血中的表达
牙周炎发生和进展过程中,患者外周血BAFF水平同样发生显著改变。研究显示,牙龈炎患者血清BAFF 水平明显高于牙周健康者,外周血BAFF 水 平 与PI 显 著 正 相 关(r=0.34,P<0.05)[16]。在妊娠期糖尿病人群中,伴牙龈炎的患者血清BAFF 水平显著高于不伴牙龈炎者,同时血清BAFF 与PI(r=0.26,P<0.01)、PD(r=0.28,P<0.01)和BOP(r=0.28,P<0.01)均正相关[15]。Nile等[17]对200 例全身健康受试者进行BAFF 检测后,发现牙周炎患者外周血BAFF 表达水平高于健康对照组(P<0.05),同时BAFF 的表达与PD(r=0.28,P<0.01)和附着丧失程度(attachment loss,AL)(r=0.28,P<0.01)显著正相关。Gümüş 等[18]开展的病例对照研究得到了相似的结论,显示牙周炎患者升高的血清BAFF 水平除了与PD(r=0.74,P<0.01)和AL(r=0.74,P<0.01)相关之外,还 与PI(r=0.61,P<0.01)和BOP(r=0.61,P<0.01)显著正相关[18]。同时,Gümüş 等[19]研究显示,在伴和不伴系统性疾病(类风湿关节炎、骨质疏松症)的牙周炎患者血清中均可检测到BAFF 的存在,并且血清BAFF 与BOP 显著正相关(P<0.01)。BAFF 在自身免疫性病变、感染、癌症和过敏等多种全身性疾病中发挥重要作用,牙周炎对全身BAFF 表达的影响很可能会间接改变上述疾病的病变过程。
3 BAFF 在牙周炎发生发展过程中的作用
尽管BAFF 是B 细胞分化和保持稳态的关键调节因子,它同样能够直接或间接对T 细胞和巨噬细胞等多种免疫细胞发挥调节作用,进而改变多种免疫炎症性疾病的发病过程。
3.1 BAFF 可增加炎症部位B 细胞数量
本课题组前期进行的免疫细胞浸润谱数据分析显示,B 细胞为炎症牙龈组织浸润水平增加最为显著的免疫细胞之一[20]。数量增加的B 细胞是诱导牙槽骨破坏的重要因素,B 细胞缺陷型牙周炎小鼠骨质破坏明显减少[2]。同时,B 细胞还是牙周组织核因子κB 受体活化剂配体(receptor activator of nuclear factor κB ligand,RANKL)的重要来源,它能够诱导RANKL 依赖性的牙槽骨破坏[21]。研究显示,免疫炎症反应中表达增加的BAFF 可抑制B 细胞凋亡,增加B 细胞数量[22]。相反,使用单克隆抗体抑制牙龈局部BAFF,可显著降低B 细胞的数量和牙周组织破坏的程度[5]。
3.2 BAFF 可介导B 细胞亚型转变
牙周炎发病过程中,B 细胞亚型改变同样能够影响牙周炎的组织破坏过程[23]。据报道,健康牙龈组织以免疫球蛋白非分泌型B 细胞为主,随着牙周炎的进展细胞浸润逐渐转变为以IgG 和IgM 分泌型B 细胞和浆细胞为主[2]。研究显示,BAFF 转基 因 小 鼠IgG 和IgM 产 生 量 显 著 增 加[24]。抑 制BAFF 可显著降低免疫炎症反应局部以及血清IgG、IgM 的水平[13,25]。体外实验中,重组BAFF 可以剂量依赖方式促进B 细胞产生IgM[25]。上述研究均说明,BAFF 可在介导B 细胞亚型转变中发挥作用。
3.3 BAFF 可 促 进CD4+T 细 胞 聚 集
炎症牙龈组织中至少有两种CD4+T 细胞聚集,即辅助性T 细胞1(T helper cell 1,Th1)和Th17 细胞[23]。BAFF 可诱导Th1 反应,增加干扰素γ 产生,促进炎症细胞向病变部位聚集[26]。BAFF 可激发Th17 细胞,通过白细胞介素⁃17 调节组织炎症[27]。动物实验显示,白细胞介素⁃17 是一种与牙槽骨破坏密切相关的细胞因子[28]。因此,BAFF 调控的CD4+T 细胞在牙周炎进展中发挥何种作用,将是学者开展BAFF 牙周致病机制研究的重要方向。
3.4 BAFF 可抑制调节性T 细胞(regulatory T cells,Tregs)产生
Tregs 是免疫系统的一个关键调节因子,它能够抑制其他免疫细胞的活性,进而缓解牙周炎症反应和组织破坏程度[29]。BAFF 能够通过调节白细胞介素⁃2 和转化生长因子⁃β(transforming growth factor⁃β,TGF⁃β)的方式,抑制Tregs 的产生[30]。动物实验显示,沉默BAFF 能够明显增加Tregs 的数量,并缓解多种免疫炎症性疾病的发病过程,包括:自身免疫性关节炎[31]和过敏反应性气管炎[30]等。因此,BAFF 对牙周组织破坏的调控是否与浸润水平改变的Tregs 有关,仍是将来开展BAFF 牙周致病机制研究的重要内容。
3.5 BAFF 可减少M2 型巨噬细胞数量
炎症牙龈组织中的巨噬细胞主要分为2 种亚型,即:M1 型巨噬细胞和M2 型巨噬细胞。M1 型巨噬细胞可诱导破骨细胞性骨吸收,而M2 型巨噬细胞能够缓解牙槽骨破坏,在牙周炎发病过程发挥保护作用[32]。研究显示,BAFF 能够抑制M2 型巨噬细胞的产生,而应用BAFF 拮抗剂可以明显增加M2 型巨噬细胞的数量,进而减轻免疫炎症反应中组织破坏程度[33]。考虑到M2 型巨噬细胞在缓解牙槽骨破坏的重要作用,在将来开展BAFF 牙周致病机制研究过程中,还应对M2 型巨噬细胞浸润状况进行深入探讨。
4 结束语
综上所述,现有证据表明牙周炎发生和进展过程中存在BAFF 因子的高表达。同时,局部高表达的BAFF 因子在炎症性组织破坏中发挥重要作用。针对BAFF 的调控已被认为是治疗多种免疫炎症性疾病的潜在靶标,包括:类风湿性关节炎、牛皮癣和动脉粥样硬化等[4]。BAFF 能否成为牙周炎潜在的治疗策略,目前还缺乏深入的机制研究予以证实。此外,BAFF 还在多种全身性疾病中高表达,并发挥重要致病作用。然而,BAFF 能否成为牙周炎和全身性疾病双向联系的重要原因,同样需要开展相关研究予以探讨。
