晚期糖基化终末产物(AGEs)通过 PI3K/AKT GSK-3β信号通路促进糖尿病大鼠主动脉血管平滑肌细胞钙化
2020-12-10许凯强尚忠明王寓平刘勇
许凯强,尚忠明,王寓平,刘勇
(1.西南医科大学附属医院普通外科(血管外科),四川 泸州;2.西南医科大学附属中医医院血管甲状腺乳腺外科,四川 泸州)
0 引言
糖尿病在全世界范围已经变得越来越流行,中国也逐渐成为了糖尿病大国。当糖尿病合并动脉钙化时心血管疾病发生的危险性也增加了2-4 倍。其成为了糖尿病患者死亡的首要原因[1]。血管钙化是普遍存在于动脉粥样硬化、糖尿病周围血管病变、血管损伤、收缩性高血压等疾病中的共同的病理表现[2]。其形成的早期过程是一个与骨发育相似的主动的、可调控的生物学过程。血管壁细胞尤其是平滑肌细胞在某些诱导条件下从原来的收缩样表型向成骨细胞样表型转化,从而导致血管钙化。
而Wnt/β-catenin 信号通路是骨形成过程中最关键的信号通路。表型转化后的平滑肌细胞具有成骨样细胞特点:即质膜上都表达Runx2、OPG、ALP、分泌Ⅰ型胶原、OPN、骨钙蛋白和骨连蛋白等,而这些蛋白均受Wnt/β-catenin 信号的调控。在经典的Wnt/β-catenin 途径中,Wnt 蛋白通过结合低密度脂蛋白受体相关pro-TIN5/6(LRP5/6)共受体和膜卷曲G 蛋白偶联受体的受体复合物(FGRs)来发挥作用。一旦与其受体/ 共受体偶联,Wnt 便引起下游信号事件,导致β-catenin 的脱磷酸化和稳定化,导致β-catenin 易位进入细胞核,与DNA 结合配偶体即T 细胞相互作用因子(TCF)/淋巴增强结合因子(LEF)相互作用,以启动 Wnt 靶向基因的转录[3]。在Wnt/β-catenin 信号通路中,抑制糖原合成酶激酶3(GSK3),使Ser33/Ser37/Thr41 位 点 的β-catenin 磷 酸化降低,降解降低,稳定性增加。同时, 蛋白激酶 A(PKA)或 p21 活化激酶 1(PAK1)对Ser675 位点的β-catenin 磷酸化也导致β-catenin 活化[4]。此外,据K.I.Bostrom 等[5]人研究表明,Wnt/β-catenin 信号是多能间充质细胞向成骨细胞分化所必需的。有望通过原始成骨因子激活Wnt/β-catenin信号通路导致 Runx2 表达的上调,从而来调节成骨相关蛋白的表达和调节成骨细胞分化。本实验研究高脂饲料(HFD)+VicD3 肌肉注射+腹腔注射链脲佐菌素(STZ)构建的2 型糖尿病合并血管钙化模型中,运用PI3K/AKT GSK-3β 信号通路抑制剂(LY294002 和 TWS119)验证晚期糖基化终末产物(AGEs)以及 PI3K/AKT GSK-3β 信号通路与糖尿病动脉血管钙化的关系。
1 材料与方法
1.1 实验动物
西南医科大学医学实验动物中心提供的平均月龄2月的,体重在100±20g 的SD(Sprague-Dawley)大鼠60 只。饲养于西南医科大学忠山校区动物房。
1.2 主要试剂
一抗Runx2、OPG、BMP2 及兔抗人 AKT、 GSK 单克隆抗体一抗及β-catenin 单克隆抗体一抗购自美国CST 公司;二抗购自武汉碧云天公司;石蜡切片Von kossa 钙染色试剂盒、组织钙离子测定试剂盒购自上海杰美基因公司;弹性纤维染色试剂盒、二甲基亚砜(DMSO)购自Sigma 公司;大鼠AGEs酶联免疫(ELISA)试剂盒购自武汉华美公司。
1.3 动物分组及模型建立
分组:将全部大鼠随机分为空白对照组、DM 组、DM+DMSO 组、LY294002 组、TWS119 组,每组各12 只 SD 大鼠。N 组用普通饲料喂养4 周,DM 组、 DMSO 组、LY294002组、TWS119 组用高脂高糖高胆固醇模型饲料(HFD)饲养4周+维生素 D3 肌肉注射+尼古丁灌胃。4 周后测空腹血糖(记录为0 天)。 DM 组、DMSO 组、LY294002 组、TWS119 组腹腔注射链脲佐菌素(streptozotocin,STZ)构建糖尿病合并血管钙化大鼠模型。腹腔注射STZ 后的第3、5、7、14、28 天,连续监测随机空腹血糖,糖尿病模型未成功的大鼠再予以少剂量 STZ 腹腔追加注射。
1.4 PI3K/AKT GSK-3β 信号通路的抑制剂注射
N 组大鼠予以10mL/kg 生理盐水腹腔注射;DM 组大鼠同样予以10mL/kg 生理盐水腹腔注射;DMSO 组大鼠予以10mL/kg 二甲基亚砜(DMSO)腹腔注射; LY294002 组大鼠予以AKT 抑制剂LY294002 按照60mg/kg 剂量腹腔注射,每天下午注射,持续3 周;TWS119 组大鼠予以GSK-3β 抑制剂TWS119 按照30mg/kg 的剂量腹腔注射,同样每天下午注射,持续3 周。
1.5 大鼠血清晚期糖基化终末产物(AGEs)酶联免疫分析(ELISA)
将事先备用的已离心血清,室温下复温后,用台式高速离心机以3000×g,4℃的条件离心10min,再取上清液进行标准品的稀释与加样后,置37℃温育 30 分钟,再配液及洗涤5 次后加入酶标试剂50μl,再次温育及洗涤后,加入显色剂A、B各50μl,置37℃避光显色15 分钟后,以450 nm 波长依序测量各孔的吸光度(OD 值)。
1.6 大鼠动脉血管组织钙含量的测定
取出大鼠动脉标本,用GENMED 清理液中清洗后置于液氮中过夜。第二天用钵杵碾碎组织至粉末状态。磨好后置于EP 管中,加入200μlGENMED 裂解液,混匀,充分裂解。裂解好后进行离心处理(12000rpm,10min),取上清液后分装与EP 管中。分别将去离子水10μl 加入1mmol/L 的钙标准液10μl 加入标准孔,样本上清液10μl 加入测定孔。最后再分别向空白孔、标准孔和测定孔加入工作液Ⅰ250μl。混匀,静置5 分钟后,波长610nm,酶标仪比色,测各孔OD 值。
1.7 大鼠动脉血管石蜡切片的弹性纤维染色
将载玻片脱蜡后;放置弹性染色溶液中染色10 分钟;离子水冲洗后,用工作氯化铁溶液分化;再用自来水冲洗后行显微镜检查;然后酒精去碘、离子水冲洗后在 Van Gieson Solution 工作液中染色1-3 分钟,并用水化二甲苯或二甲苯替代品脱水固定后行一般光学显微镜下观察照相。
1.8 大鼠动脉血管石蜡切片的Von kossa(冯库萨)染色
常规石蜡处理后,加上100μl GENMED 染色液(Reagent G)置于太阳光直射或60 瓦灯直射孵育60 分。移去GENMED 染色液后,置入50mL GENMED 清理液(Reagent F)中孵育2 分钟移去GENMED 清理液后,再行复染处理,最后用一般光学显微镜下观察并照相:钙沉积阳性细胞呈现黑色。
1.9 Western Blot 分析
将血管组织块清洗研磨后,迅速转移至2mL EP 管中。加入10 倍于组织体积的组织蛋白提取试剂,冰浴彻底匀浆,再用超声仪破碎。采用离心法(4℃12000rpm)离心5 分钟,收集上清,即为总蛋白溶液。然后使用BCA 蛋白质浓度测定试剂盒测定样品蛋白浓度后。采用十二烷基硫酸钠-聚丙烯凝胶(SDS-PAGE)电泳分离蛋白质,采用半干式电转移将蛋白分子转移到PVDF 膜,转膜完成后将PVDF 膜放入封闭液中封闭2 小时后,用TBST 溶液清洗PVD,膜15 分钟,随后将其放入一抗的孵育盒中在冰箱4℃摇床过夜。第二天回收稀释一抗,再取出PVDF 膜,用TBST 多次清洗(5-10min/次),然后放入二抗的孵育盒中,孵育2 小时后用TBST 再次多次清洗(5-10min/次)。然后放入凝胶成像系统中,暗室中曝光成像。根据不同的光强度调整曝光条件,多次显影、定影。
1.10 统计分析
采用SPSS 23.0 进行统计学分析。采用方差分析,所有结果用 mean±SD 表示,两组独立样本的比较采用t检验法,P<0.05 和P<0.01 表示差异有统计学意义。
2 结果
2.1 大鼠空腹血糖测定
实验组(包括DM 组、DMSO 组、LY294002 组、TWS119组48 只)大鼠按照50mg/kg STZ 腹腔注射1% STZ 溶液,对照组(12 只)大鼠按照等剂量柠檬酸盐缓冲溶液腹腔注射。在STZ 溶液注射后的第3、5、7、14、28 天随机检测大鼠空腹血糖。在高脂饲料饲养4 周过程中,组2(DM 组)中有1 只大鼠因与组内其他大鼠相互撕咬而死亡。在STZ 溶液注射以后第3 天和第5 天,总计共6 只大鼠空腹血糖水平<16.6mmL/L。追加腹腔小剂量注射STZ 后,这6 只大鼠空腹血糖水平稳定,且均>16.6mmL/L,造模成功。在STZ 溶液注射以后28 天内,总计共4 只大鼠因血糖波动过大、糖尿病并发感染或者不进饮食而死亡。另外有1 只大鼠因多次检测空腹血糖均<16.6mmL/L,且追加腹腔小剂量注射STZ 后仍未造模成功,故予以排除。糖尿病大鼠模型成模率87.5%,失败率为12.5%。大鼠空腹血糖统计结果见图1。
2.2 大鼠血清AGEs 酶联免疫分析(ELISA)
图2 为通过ELISA 试剂盒检测大鼠血清中的AGEs 含量。与对照组相比较,DM 和DM+DMSO 组大鼠血清中的AGEs 含量明显增高;DM 组与DM+DMSO 组两者之间,大鼠血清中的AGEs 含量没有明显差异;在运用AKT 通路抑制剂LY294002 后,LY294002 组大鼠血清中的AGEs 含量明显下降;在运用GSK 通路抑制剂TWS119 后,TWS119 组大鼠血清中的AGEs 含量明显增高。由此可见,大鼠血清中的AGEs含量与大鼠血管钙化程度存在某种一致性。
2.3 大鼠动脉血管组织钙含量的测定
图3 为大鼠动脉血管组织钙含量的测定。该实验检测结果可以直接反应出大鼠动脉血管组织中的钙含量,可以比较直观地反应各组之间血管的钙含量与血管钙化之间的关系。
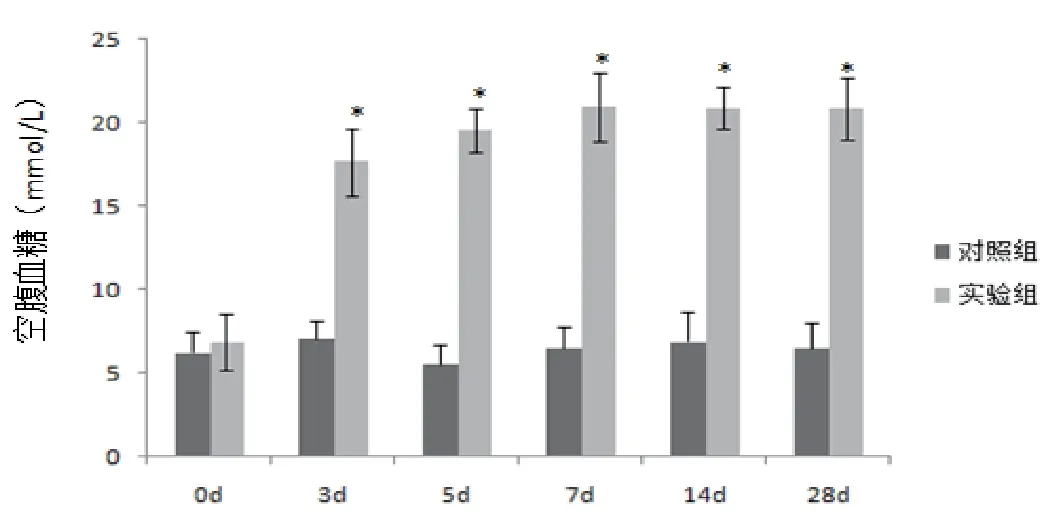
图1 大鼠空腹血糖测定

图2 大鼠血清AGEs 含量测定
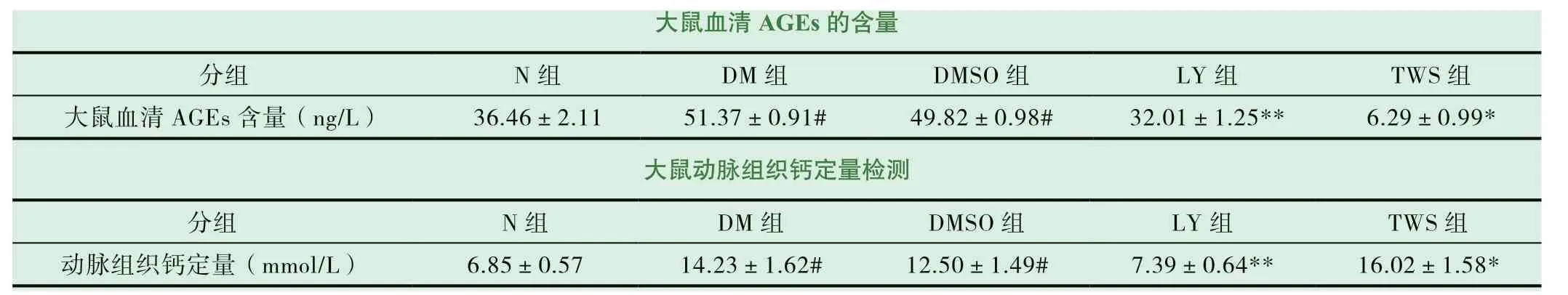
大鼠血清AGEs 的含量分组 N 组 DM 组 DMSO 组 LY 组 TWS 组大鼠血清AGEs 含量(ng/L) 36.46±2.11 51.37±0.91# 49.82±0.98# 32.01±1.25** 6.29±0.99*大鼠动脉组织钙定量检测分组 N 组 DM 组 DMSO 组 LY 组 TWS 组动脉组织钙定量(mmol/L) 6.85±0.57 14.23±1.62# 12.50±1.49# 7.39±0.64** 16.02±1.58*

图3 为大鼠主动脉组织钙含量测定
2.4 大鼠动脉血管石蜡切片的免疫组化检测β-catenin的表达
N 组大鼠血管未见明显β-catenin 表达;DM 组大鼠血管可见明显β-catenin 表达,说明糖尿病钙化模型大鼠体内的某种物质可以促进β-catenin 表达的上调;DMSO 组大鼠血管同样可见明显β-catenin 表达,说明DMSO(二甲基亚砜)溶液对β-catenin 的表达没有明显影响;与DM 组大鼠相比较,LY294002 组大鼠血管可见少许β-catenin 表达,说明AKT 通路抑制剂LY294002 能够降低β-catenin 的表达,并且通过降低β-catenin 的表达来抑制血管钙化;与DM 组大鼠相比较,TWS119 组大鼠血管可见明显β-catenin 表达,说明GSK 通路抑制剂TWS119 能够上调β-catenin 的表达,并且通过上调β-catenin 的表达来促进血管钙化,如图4。

图4 大鼠动脉血管石蜡切片的免疫组化检测β-catenin 的表达
2.5 大鼠动脉血管石蜡切片的弹性纤维染色
图5 为大鼠主动脉石蜡切片的弹性纤维染色结果。图中红色为胶原纤维,黑色波浪状条纹为弹性纤维。N 组大鼠可见许多连续的弹性纤维表达,红色胶原纤维表达较少;与N组大鼠相比较,DM 组大鼠弹性纤维断裂,受到破坏,而红色胶原纤维的表达有所增加;DOSO 组大鼠弹性纤维与DM 组比较,两者未见明显差异,均可见弹性纤维的断裂或表达减弱,而红色胶原纤维的表达有所增加;与DM 组大鼠相比较,LY294002 组大鼠弹性纤维断裂减少,完整性增加,而红色胶原纤维表达较少;与DM 组大鼠相比较,TWS119 组大鼠弹性纤维断裂增加,完整性减少,弹性纤维的表达减弱,而红色胶原纤维的表达相应地有所增加。

图5 大鼠主动脉石蜡切片的弹性纤维染色结果
2.6 大鼠动脉血管石蜡切片的Von kossa(冯库萨)染色
图6 为大鼠动脉血管石蜡切片的Von kossa(冯库萨)染色。图中血管内膜及中膜钙化明显处(黑色区域)均表现为黑色钙盐沉积,如图中尖头所指。N 组大鼠血管动脉未见明显钙盐沉积,血管内膜较为完整;与N 组大鼠相比,DM 组和DMSO 组大鼠动脉血管钙化明显,说明高脂饲料饲养+维生素D3 肌注+尼古丁灌胃造模的糖尿病血管钙化大鼠血管钙化明显,且DMSO(二甲基亚砜)溶液对大鼠动脉血管的钙化没有明显影响;与DM 组大鼠相比,LY294002 组大鼠动脉血管钙化表达受到抑制,说明AKT 通路抑制剂LY294002 能够减轻血管的钙化;与DM 组大鼠相比,TWS119 组大鼠动脉血管钙化表达增强,可见明显黑色钙盐沉积,说明GSK 通路抑制剂TWS119 能够加重血管的钙化。

图6 大鼠动脉血管石蜡切片的Von kossa(冯库萨)染色
2.7 Western Blot 蛋白印迹检测
图7A 蛋白印迹示AKT 的表达:如图所示,总AKT 的表达在N 组、DM 组、DMSO 组、LY294002 组四组之间没有明显差异;作为AKT 蛋白活性形式的P-AKT,在N 组中没有明显表达;与N 组相比,P-AKT 在DM 组和DMSO 组中的表达升高;与DM 组相比,在加入了AKT 通路抑制剂LY294002 后,P-AKT 的表达受到了抑制。

图7 A 为Western Blot 蛋白印迹检测通路蛋白AKT 的表达
图7B 蛋白印迹示GSK3β 的表达:如图所示,总GSK3β的 表 达 在N 组、DM 组、DMSO 组、LY294002 组、TWS119 组五组之间差异较小;作为GSK3β 蛋白活性形式的P-GSK3β,在N 组中没有明显表达;与N 组相比,DM 组和DMSO 组中P-GSK3β 的表达升高;与DM 组相比,在加入了AKT 通路抑制剂LY294002 后,P-GSK3β 的表达下降。而与DM 组相比,在加入了GSK3β 通路抑制剂TWS119 后,P-GSK3β 的表达增加。

图7 B 为Western Blot 蛋白印迹检测通路蛋白GSK3β 的表达。
图7C 在免疫组化检测β-catenin 的表达后,图7C 为Western Blot 蛋白印迹进一步检测β-catenin 蛋白的表达:如图所示,在N 组中,β-catenin 几乎没有表达;与N 组相比,DM 组和DMSO 组中,β-catenin 的表达有所升高;与DM 组相比,在加入了AKT 通路抑制剂LY294002 后,β-catenin 的表达受到了抑制;与DM 组相比,在加入了GSK3β 通路抑制剂TWS119 后,β-catenin 的表达上调。

图7 C 为Western Blot 蛋白印迹检测通路蛋白β-catenin 的表达
图7D 蛋白印迹示成骨相关蛋白的表达:如图所示,在N组中,成骨相关蛋白Runx2、OPG 及BMP2 几乎没有表达;与N 组比较,DM 组和DMSO 组中,成骨相关蛋白Runx2、OPG及BMP2 的表达有所升高;与DM 组相比,在加入了AKT 通路抑制剂LY294002 后,成骨相关蛋白Runx2、OPG 及BMP2 的表达受到了抑制;与DM 组相比,在加入了GSK3β 通路抑制剂TWS119 后,成骨相关蛋白Runx2、OPG 及BMP2 的表达上调。

图7 D 为Western Blot 蛋白印迹检测成骨相关蛋白Runx2、OPG 及BMP2 的表达
3 讨论
血管钙化大多是血管壁中以羟磷灰石的形式存在的矿物硫酸钙的沉积。血管钙化是许多疾病的一个共同的显著特点,这些疾病包括动脉粥样硬化,糖尿病,慢性肾脏疾病等。在越来越多的国家,血管钙化逐渐成为心脑血管疾病发病率和致死率的一个强有力的预测指标[2]。而血管平滑肌细胞目前被认为是主要负责血管钙化的细胞,来自平滑肌细胞的凋亡小体能作为钙晶体形成的成核结构来启动血管钙化[6]。血管平滑肌细胞(Vascular smooth muscle cells,VSMCs)可以进行成骨分化和表达成骨关键转录因子Runx2 和其他骨形成相关蛋白,比如I 型胶原蛋白(Col I),碱性磷酸酶(ALP)、骨钙素等,这些蛋白导致了磷酸钙在细胞外基质的沉积。而这些成骨相关蛋白均受而AKT/GSK-3β-Wnt/β-catenin 信号通路的调控。只有少数学者阐述了Wnt/β-catenin 信号通路的一些目标点之间的关系,例如LRP5 和血管平滑肌钙化之间的关系[7]。在Rajamannan NM 等人的研究中,也证明了血管平滑肌的钙化发生常伴随GSK-3β 和β-catenin 蛋白表达的上调,而两者均是Wnt /β-catenin 信号通路的关键目标点[8]。
(1)AGEs 与动脉血管钙化
糖尿病是导致动脉粥样硬化的重要危险因素之一。在糖尿病患者中,血糖的升高和血浆中的蛋白质、氨基和酸肽的游离氨基末端的增多,通过非酶糖基化,最终形成AGEs(Advanced glycation endproducts,晚期糖基化终末产物)[9]。
在本实验中,我们通过高脂饲料喂养+腹腔注射STZ 造大鼠Ⅱ型糖尿病模型,模拟临床中常见的糖尿病患者的体内情况。通过ELISA 试剂盒检测血清中的AGEs 浓度中,我们发现,和N 组比较,DM 组大鼠血清中的AGEs 浓度明显增高,证实了AGEs 的产生和血糖的升高和血浆中的蛋白质、氨基和酸肽的游离氨基末端的增多可能存在着密切联系。而且在DM 组,DMSO 组以及TWS119 组中,血清中AGEs 的高表达和成骨相关蛋白Runx2,OPG,BMP 等的高表达以及β-catenin蛋白的高表达呈现高度一致性也许能印证AGEs 通过激活Wnt/β-catenin 信号通路促进成骨相关蛋白的形成观点。
(2)PI3K/AKT 与动脉血管钙化
PI3K/AKT 信号通路广泛存在于各种细胞中,是参与细胞增殖、分化和生长的重要信号传导通路。AKT 是PI3K 的下游效应子,PI3K 激活AKT 后使AKT 的Ser473 和Thr308 位点磷酸化,从而激活AKT。AKT 是一种S/T 激酶,在参与细胞生长调节的许多关键蛋白激活生长因子时,PI3K/PTEN/AKT/mTORC1,Ras/Raf/MEK/ERK 和其他途径同时也被激活[10]。在本实验中,我们运用AKT 的抑制剂LY294002 处理糖尿病大鼠,我们发现:P-AKT 在N 组中没有明显表达;与N 组相比,P-AKT 在DM 组和DMSO 组中的表达升高,我们猜测P-AKT表达的增加与大鼠糖尿病有着某种联系;DM 组和DMSO 组差异没有统计学意义,说明作为LY294002 的溶剂的DMSO对P-AKT 的表达没有影响;与DM 组相比,在加入了AKT 通路抑制剂LY294002 后,P-AKT 的表达受到了抑制。
(3)GSK-3β 与动脉血管钙化
GSK-3β 是 腺 瘤 性 大 肠 杆 菌/axin/GSK-3β 复 合 物 的组分部分,参与β-catenin 的泛素化和蛋白酶体的降解,而β-catenin 是Wnt /β-catenin 信 号 通 路 的 关 键 分 子[11]。TWS119 是GSK-3β 的抑制剂,在无细胞试验中IC50(半抑制浓度)为30nM,能够诱导神经细胞的分化并且有助于干细胞生物学的研究。
在本实验中,我们运用GSK 的抑制剂TWS119 处理糖尿病大鼠,我们发现:在弹性纤维染色中,与DM 组大鼠相比较,TWS119 组大鼠弹性纤维断裂增加,完整性减少,弹性纤维的表达减弱,而红色胶原纤维的表达相应地有所增加。在免疫组化测定β-catenin 的表达中,TWS119 组大鼠血管可见明显β-catenin 表达。在成骨相关蛋白的表达中,TWS119组Runx2、OPG 及BMP2 的表达均上调。因此,我们验证了TWS119 可能是通过抑制GSK-3β 来抑制β-catenin 的降解,理论上激活Wnt /β-catenin 信号通路,从而引起糖尿病血管中膜的钙化。
(4)Wnt/β-catenin 与动脉血管钙化
Wnt/β-catenin 信号通过在骨祖细胞中促进Runx2 的表达从而在骨形成中发挥着重要作用。然而,Wnt/β-catenin 信号对Runx2 的调控和在血管平滑肌细胞向成骨细胞转化中的作用尚未被完全阐明。Ting Cai 等[12]人的研究对该机制作用做了以下研究。首先,Wnt/β-catenin 信号诱导Runx2表达,并通过高磷酸激活β-catenin,并且通过过表达稳定的β-catenin 或 通 过 抑 制GSK-3β 的 信 号 传 导 在VSMCs 中诱导Runx2 表达。第二,Runx2 基因启动子区域包含两个TBE(功能性T 细胞因子/ 淋巴增强子结合位点),其功能性介导与功能性T 细胞因子相互作用以响应β-catenin 活化。第三,通过Wnt-3a 激活β-catenin 诱导Runx2 表达,而PORCN 抑制剂或DKK1 通过抑制Wnt/β-catenin 信号传导来减弱VSMCs 中高磷酸激酶刺激的Runx2 诱导。第四,Wnt-3a 上调骨钙素OPG 表达,促进血管平滑肌细胞钙沉积,而DKK1 可抑制高磷酸盐诱导的VSMCs 钙化。最后,β-catenin被激活,Runx2 在主动脉中膜被诱导,其次是内膜,Runx2 mRNA 水平与主动脉壁中活性β-catenin 的表达呈正相关。鉴于高磷酸盐激活VSMCs 中的β-catenin,该信号通路可能在介导高磷酸盐触发的Runx2 诱导中起关键作用。因此,这些结果表明,Runx2 诱导可以在介导Wnt/β-catenin 信号传导促进血管钙化的作用中发挥重要作用。
Runx2 被诱导,β-catenin 被血管平滑肌细胞(VSMCs)中的高磷酸激活。两种活性形式的β-catenin 在Ser37/Thr41 上去磷酸化并在Ser675 位点磷酸化,通过高磷酸盐,两者活性都被上调。β-catenin 的活化,通过异常表达稳定的β-catenin,抑制GSK3β 或Wnt3a 蛋白,诱导Runx2 表达,而用Dickkopf-1 通过阻断Wnt/β-catenin 信号来抑制Runx2 诱导高磷酸盐。Wnt3a 可促进血管平滑肌细胞的骨钙素表达和钙沉积,而DKK1 可以改善由高磷酸盐诱导的VSMCs 的钙化。在VSMCs 中Runx2 基因的启动子区域中鉴定出两个功能性T 细胞因子/淋巴增强子结合位点,它们与β-catenin 相互结合相互作用。它们各自的定点突变减弱了Runx2 对β-catenin的反应。高磷酸盐可以通过不同的途径激活Wnt/β-catenin信号传导,通过直接下游靶标Runx2 激活的Wnt/β-catenin信号可以促进血管平滑肌细胞向成骨细胞转化。已经证明VSMCs 暴露于高磷酸盐环境,类似于糖尿病患者的病理生理状态,以启动血管平滑肌细胞向成骨细胞样细胞的分化,并执行调节骨基质沉积过程的细胞程序[13]。
Runx2 和Wnt/β-catenin 对于骨形成和骨重塑是至关重要的,是不可缺少的关键因素,因为它们是祖细胞开始向成骨细胞分化所必需的功能连接元件。在Runt 同源结构域的转录因子家族中,Runx2 是其中一员,它是成骨细胞前体细胞中公认的主要转录因子,已被认为是成骨细胞的最早标志物[14]。骨形态发生蛋白2(BMP2)可以促进间充质干细胞(MSC)向成骨分化,而血小板衍生生长因子(PDGF)和成纤维细胞生长因子(FGF)通过受体酪氨酸激酶(RTK)可以激活其增殖。在人主动脉平滑肌细胞(HASMCs)中研究了PDGF 或FGF 受体信号通路对BMP2 诱导的成骨细胞分化的影响。抑制PDGF 和FGF 受体可以增强BMP2 诱导的碱性磷酸酶(ALP)活性,以及Osterix,ALP 和骨唾液酸蛋白的表达和基质的钙化。这些影响与Smad-1 活性升高相关,表明有丝分裂因子干扰HMSC 分化中的Smad 信号。RTK 激活MAPK并通过PI3K / AKT 途径抑制GSK3。生化分析表明MAPK JNK 和GSK3 是调节BMP2 诱导的HASMCs 向成骨细胞分化的潜在信号分子。这些观察结果强调BMP2 的成骨化作用受到RTK 作用的促有丝分裂因子的调节。因此,AGEs 可以通过对PI3K/AKT GSK-3β/β-catenin 信号通路的调控来促进糖尿病体内的血管钙化,但其具体的作用机制尚待进一步研究。
综上所述,在糖尿病大鼠体内运用PI3K/AKT 抑制剂LY294002 后,可通过调控β-catenin 转录活性,下调相关成骨因子Runx2、OPG 及BMP2 的表达,而减弱主动脉血管壁的钙化;在运用GSK 抑制剂TWS119 后,可通过调控β-catenin 转录活性,上调相关成骨因子Runx2、OPG 及BMP2 的表达,而增强主动脉血管壁的钙化。而且通过糖尿病大鼠体内实验验证了PI3K/AKT GSK-3β/β-catenin 信号通路或许可以作为治疗糖尿病动脉钙化的新靶点。
