急性心肌炎与急性心肌梗死磁共振成像鉴别1 例
2020-12-09王建陈若诗王博肖栋
王建 陈若诗 王博 肖栋
作者单位:361006 福建厦门,厦门大学附属心血管病医院心内科(王建、肖栋),影像科(王博);厦门市长庚医院内科(陈若诗)
1 临床资料
患者 男,61岁。主因“上呼吸道感染5 d后出现胸闷,位于心前区,呈压迫感,伴大汗,持续1 h左右自行缓解”2019年12月2日就诊于厦门大学附属心血管病医院心内科。既往长期吸烟史30年,每日20支;高血压病10余年,服用缬沙坦,未规律监测。入院查体未见异常,生命体征正常。心电图示:V2~V6导联ST段轻度弓背抬高,高敏肌钙蛋白T升高 3015 ng/L。急诊床旁超声心动图示:各房室正常,左心室射血分数(left ventricular ejection fraction,LVEF)69%。结合既往病史及辅助检查拟入院诊断:胸闷(待查)、急性心肌炎(acute myocarditis,AM)、急性心肌梗死(acute myocardium infarction,AMI)、高血压病。予以营养心肌、激素、抗病毒、抗栓、调脂、降压、护胃及对症支持治疗。12月3日增强心脏磁共振成像(cardiovascular magnetic resonance,CMR)示:T2WI示左心室心尖段侧壁见心外膜下条片状高信号影,心肌静息灌注成像示左心室壁下未见灌注低信号影;心肌延迟强化成像示:左心室基底段间隔壁、中央段间隔壁、前壁心肌中层见弧形延迟强化影(图1)。为进一步明确诊断,入院第3天(12月4日)行冠状动脉造影示:左前降支近段50%狭窄,D1近段50%~60%狭窄,右冠状动脉中段50%狭窄,未见严重狭窄病变。血清病毒抗体检测提示抗EB病毒抗体阳性,住院期间复查心电图提示ST段逐步恢复至正常,高敏肌钙蛋白T降幅较大且于第5天降至正常。第8天(12月10日)复查CMR示:T2WI示左心室未见异常信号灶,心肌静息灌注成像无异常;心肌延迟强化示左心室基底段间隔壁、中央段间隔壁及前壁心肌中层的弧形延迟强化较前(12月3日)明显减轻(图2)。综上考虑急性病毒性心肌炎诊断基本明确。随访4个月患者无不适,门诊复查心电图、超声心动图均未见异常。
2 讨论
AM是一种由病原微生物感染或其他原因如药物、毒物、自身免疫疾病等引起的心肌炎症性疾病,其共同病理改变为心肌细胞水肿、充血、坏死及纤维化[1]。临床上AM与AMI的临床表现及辅助检查结果极其相似,导致二者鉴别困难。已知心肌活检是诊断AM的金标准,但由于其有创性而很少被临床采用,而CMR能够准确地显示AM的病理特征,对于AM的诊断具有较大的价值,已被广泛应用于临床[1-3]。
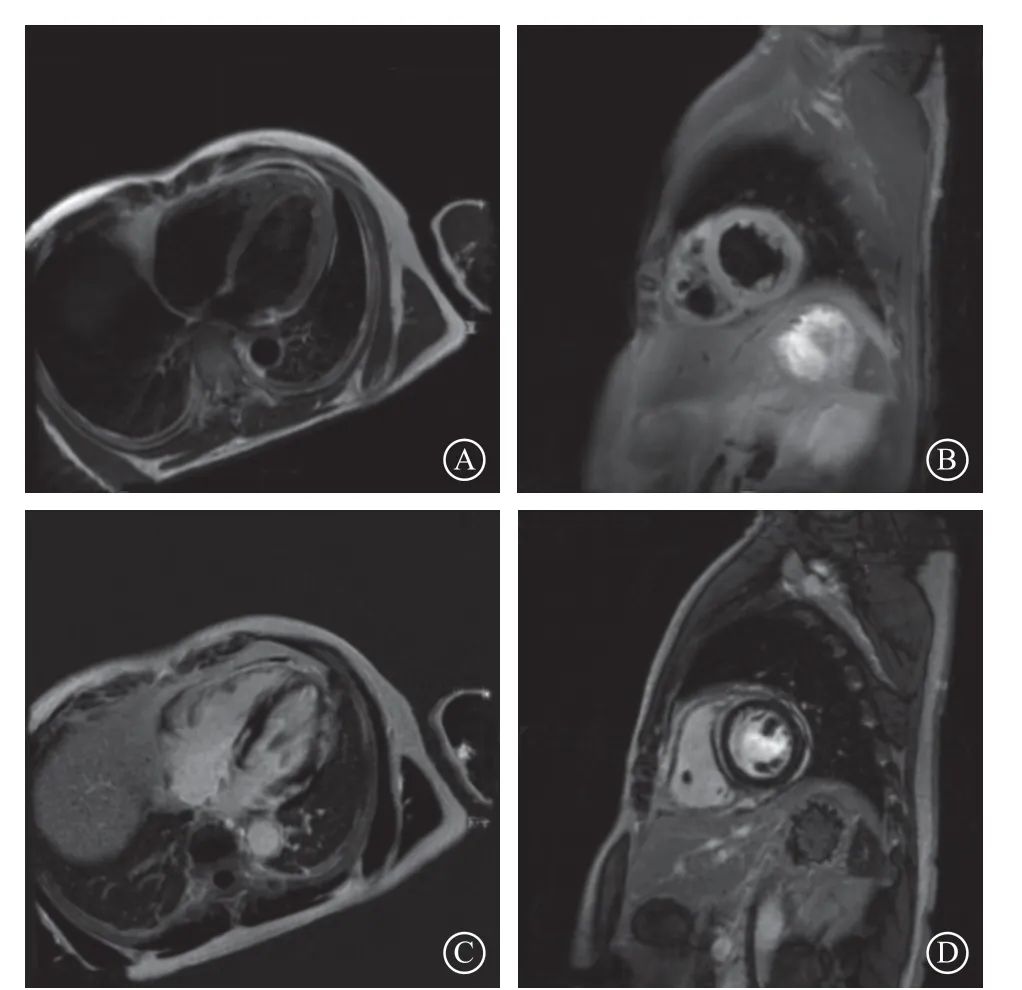
图1 入院次日影像图 A~B. T2WI示左心室心尖段侧壁心外膜下条片状高信号影;C~D. 心肌延迟强化成像示左心室基底段间隔壁、中央段间隔壁心肌中层弧形延迟强化影
2009年发布了AM的CMR诊断标准,即路易斯湖标准(Lake Louise Consensus Criteria,LLC),其主要针对AM的三个核心病理特征:水肿、充血以及坏死或纤维化,该标准包括T2加权成像、钆早期增强、心肌延迟强化成像,2项以上呈阳性即可诊断AM。2018年LLC进行了升级。LLC升级版要求AM的诊断必须满足至少1项对水肿敏感的序列(T2加权成像或T2 mapping)以及至少1项T1序列(T1 mapping,ECV,心肌延迟强化成像),同时阳性才能诊断AM[4-6]。该患者CMR的T2加权成像示:左心室心尖段侧壁心外膜下条片状高信号影,心肌延迟强化成像示左心室间隔壁、前壁心肌中层弧形延迟强化影,同时满足AM的LCC标准及LLC升级版标准。通过查阅大量文献[7-11]发现,AM与AMI在CMR上的鉴别点主要在于:(1)AM的T2加权像表现为与冠状动脉分布不匹配的弥漫性心肌组织水肿,且通常出现在心外膜或心肌中层;而AMI表现为与冠状动脉分布对应区域的心肌组织水肿,且通常出现在心内膜下或透壁。(2)AM的心肌静息灌注并无异常,心肌延迟强化成像表现为与冠状动脉分布不一致的心外膜或心肌中层的延迟强化,呈多发、散在分布,可单独存在,也可同时存在于室间隔及左心室前壁,且强化程度随时间逐步减轻;而AMI表现为与冠状动脉分布一致的心内膜下心肌灌注缺损及心肌延迟强化,且延迟强化通常不会消失。目前AM累及心外膜及心肌中层的机制尚不明确。黄海华等[10]指出可能由于心外膜及心肌中层的血供比心内膜更丰富,病毒更容易经血流侵犯到心外膜及心肌中层。
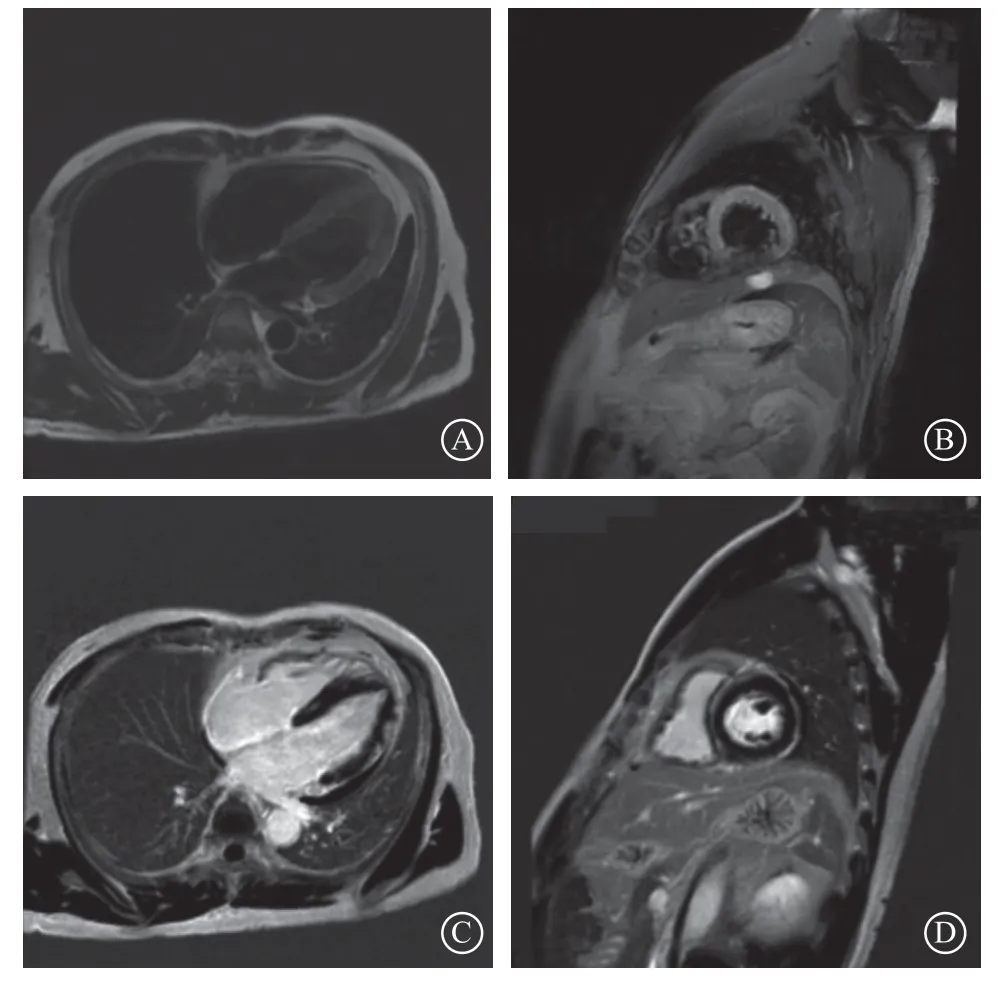
图2 入院第8天影像图 A~B. T2WI示左心室未见异常信号;C~D. 心肌延迟强化成像示左心室基底段间隔壁、中央段间隔壁心肌中层弧形延迟强化较图1明显减轻
已有报道指出,在症状出现后的第1周内应进行CMR来评估心肌水肿、心肌延迟强化成像以及新的T1、T2和细胞外容积映射情况,以确认AM的诊断[5,12]。本例患者入院1周后复查CMR,T2加权像示左心室心外膜水肿信号消失,心肌延迟强化成像示左心室间隔壁及前壁心肌中层延迟强化明显减轻。水肿、充血是AM早期的病理改变,T2加权像可以非常敏感地识别出心肌组织的水肿及充血情况。Aquaro等[12]对190例AM患者在发病1周时进行CMR检查,发现所有患者均出现了心肌水肿,且发病6个月后复查CMR发现其中160例患者的心肌水肿完全消失。本例患者入院后复查CMR发现心肌水肿完全消失。这与上述研究结果基本一致。可见随着AM从急性期到恢复期过程,心肌水肿会逐步消失[13]。对于AM患者心肌延迟强化成像并不一定代表心肌纤维化,而可能与急性炎症反应有关,其机制是心肌延迟强化成像是由所有扩大间质间隙的情况引起的,如置换性纤维化、水肿和蛋白质超载(淀粉样变性),间质间隙不仅可因替代纤维化而增大,还可因水肿和炎性细胞浸润而增大,由于其增加了钆在心肌中的分布体积,导致洗脱更慢,此外炎细胞也可能阻塞淋巴管,减缓钆从间质空间的冲洗,并参与间质水肿的形成[12]。因此,AM不同于AMI,AM患者的心肌延迟强化成像会随着心肌炎症水肿减退逐步减轻甚至完全消失,而AMI患者的心肌延迟强化成像常与不可逆心肌损伤相关,不会完全消失。该患者复查CMR提示心肌延迟强化成像较入院明显减轻,这与上述研究相符,也进一步证实本例患者符合AM的诊断。
AM的诊断仍主要为临床诊断。而CMR对于AM的诊断具有较大诊断价值。在临床上与AMI鉴别困难时应尽早进行CMR检查,必要时可复查CMR来进一步验证AM的诊断。
