橙皮苷对口腔鳞状细胞癌裸鼠移植瘤的抑制作用及其与紫杉醇联合应用的作用
2020-12-04陈德荣张晓云王秀珍任婷远王荣德
陈德荣 张晓云 王秀珍 任婷远 王荣德
口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)常发生于口腔黏膜,是恶性程度较高且容易转移的鳞状细胞癌[1]。由于其发展迅猛且对于常规疗法不敏感,导致患者的生存率较低,严重威胁着人们的生命和健康[2]。紫杉醇(PTX)是作用于细胞微管的抗肿瘤药物,对OSCC有明显疗效,但PTX存在毒副作用较强且容易产生耐药性的问题[3-4]。研究表明,使用PTX单药治疗不如联合用药的疗效显著。目前联合用药方案已经广泛运用于多种恶性肿瘤治疗,中药作为新型化疗佐剂,在提高肿瘤化疗水平和减轻化疗副作用方面受到关注[5-6]。橙皮苷(hesperidin,HES)是天然的黄酮类化合物,具有抗老化、抗炎、提高免疫力及神经保护的作用,能够诱导肝癌,乳腺癌,肺癌及胃癌细胞发生凋亡[7-9],具有良好的抗癌活性,其对口腔鳞状细胞的作用尚不明确,本文从体内外实验检测其对OSCC的作用及其和PTX联合使用后的效果。
1 材料与方法
1.1 细胞株和动物分组
人口腔鳞状细胞癌Tca8113细胞(南方医科大学细胞生物学实验室);SPF级BALB/c雌性裸鼠(18~20 g,5~6 周龄)(许可证号: SCXK 2017-0022,上海斯莱克实验动物有限公司)。裸鼠饲养在SPF级实验动物中心,饲养温度为23~26 ℃,湿度为35%。分为空白组,HES组,PTX组,二倍紫杉醇(2×PTX组)和HES+PTX组,每组5 只。分别用生理盐水,10 mg/kg HES,10 mg/kg PTX,20 mg/kg PTX和10 mg/kg HES+10 mg/kg PTX处理,经实验动物伦理委员会批准。
1.2 试剂与仪器
橙皮苷(CAS: 520-26-3,纯度≥98%)(成都瑞芬思生物科技有限公司);DMEM培养基(Gibco公司,美国);胰蛋白酶-EDTA细胞消化液(TE)、FBS 胎牛血清(杭州四季青生物科技有限公司);一抗和二抗均(Santa公司,美国);原位末端标记法(TUNEL)凋亡检测试剂盒(上海七海复泰生物科技有限公司);CCK-8试剂盒、BCA蛋白浓度测定试剂盒及ECL发光试剂盒(北京碧云天生物科技有限公司)。
ML-dr3518酶标分析仪(上海酶联生物科技有限公司);CytoFLEX流式细胞仪(贝克曼库尔特有限公司,美国);Western blot电泳仪及转膜仪(Bio-Rad公司,美国);裸鼠饲养笼设备(北京维通利华实验动物技术有限公司)。
1.3 实验方法
1.3.1 CCK-8检测增殖抑制情况 将Tca8113细胞以1×104/孔接种至96 孔板中并放入培养箱中静置培养,当细胞满度约为70%后换液处理,用1% FBS的DMEM孵育2 h,随后分成8 个浓度组:空白组,(5、10、15、20 μmol/L)HES,10 μmol/L PTX,20 μmol/L PTX及10 μmol/L HES+20 μmol/L PTX。处理24 h后,加入15 μl CCK-8溶液,利用酶标仪在490 nm波长下测量吸光度值,实验重复3 次并计算细胞存活率。
1.3.2 流式细胞术法检测细胞凋亡情况 将Tca8113细胞接种至6 孔板,过夜培养。按空白组,10 μmol/L HES,20 μmol/L HES,10 μmol/L PTX,20 μmol/L PTX及10 μmol/L HES+10 μmol/L PTX处理。随后收集细胞于Tube管中,5 000 r/min离心4~5 min,舍去上层清液,每管中加入95 μl 1×结合缓冲液重悬细胞,再加入3 μl Annexin V-FITC和2 μl PI染料,并设置单色对照组空白对照组,利用流式细胞仪对凋亡的细胞数量进行统计分析。
1.3.3 Transwell法检测细胞迁移情况 将Tca8113细胞消化离心重悬,调整浓度为5×106个/ml,取200 μl加到小室的上层。下层加入500 μl含有10%FBS的DMEM培养基,培养24 h后吸弃培养液,擦去小室上层没有侵袭或迁移的细胞。PBS冲洗2 次,4%多聚甲醛固定15 min。然后用0.1%结晶紫进行染色0.5 h。放大400 倍随机观察5 个视野,计数迁移至小室微孔膜下层的细胞数,并定量分析。
1.3.4 构建裸鼠移植瘤模型及分组药物处理 将Tca8113细胞密度调整至2×107/ml,以每只裸鼠5×106个细胞皮下接种,注射器针管要插在裸鼠背部右侧靠近腋窝处,注入细胞后用指肚轻轻按压注射的位置,每天观察裸鼠及肿瘤状况。当接种裸鼠均出现直径大5 mm3的皮下质硬结节时,根据分组的实验方案,隔天灌胃给药1 次,持续4 周,实验中各组裸鼠未出现死亡情况。停药后,牺牲裸鼠,剥离肿瘤。
1.3.5 对裸鼠瘤小鼠肿瘤体积及重量的测定 每3 天用游标卡尺对瘤体的体积进行测量,计算公式为V=1/2×长径×短径2;待实验结束牺牲小鼠后,完整剥离肿瘤,记录瘤体最终的质量;计算肿瘤抑制率=(空白对照组瘤重均值-实验组瘤重均值)/空白组对照瘤重均值×100%。
1.3.6 TUNEL法检测各组肿瘤组织中的细胞凋亡情况 将裸鼠的肿瘤组织固定、石蜡包埋,以4 μm为厚度进行连续切片,随后根据TUNEL检测试剂盒说明书操作,对肿瘤组织中的细胞凋亡情况进行检测。在400倍的光学显微镜下观察计数,计算细胞凋亡率=凋亡细胞数/肿瘤细胞总数。
1.3.7 Western blotting检测肿瘤组织细胞中凋亡相关蛋白变化 取移植瘤组织,用超声波破碎仪破碎,在4 ℃离心机中以14 000×g离心30 min,取上清蛋白,BCA法测蛋白含量,配置10%~15%的SDS-PAGE凝胶进行电泳,随后转移至NC膜上,脱脂乳封闭2 h,一抗4 ℃水平摇床孵育过夜,TBST洗膜,辣根过氧化物酶标记的二抗室温孵育2 h,ECL发光试剂进行显色,再通过化学发光成像系统进行拍照。内参选择GAPDH,并利用Image J软件对所出条带进行灰度分析。
1.4 统计学分析
2 结 果
2.1 CCK-8实验检测Tca8113细胞的增殖情况
HES以浓度依赖性方式抑制Tca8113细胞的增殖,IC50为10.68 μmol/L;在10 μmol/L浓度下,HES的增殖抑制作用等同PTX;在联合处理组中,Tca8113细胞的存活率进一步降低为16.38%±1.24%,在20 μmol/L PTX和20 μmol/L HES处理组中,Tca8113细胞的存活率分别为28.73%±3.64%和30.28%±1.52%,与10 μmol/L HES+10 μmol/L PTX相比具有显著性差异(表 1)。
2.2 HES联合PTX对OSCC的诱导凋亡作用
HES和PTX均具有较好的诱导凋亡能力且PTX略优于HES;10 μmol/L HES+10 μmol/L PTX联合处理时,凋亡细胞比例达到83.68%,高于2 种药物分别以20 μmol/L处理时对细胞产生的诱导凋亡效果,具有显著性差异(表 1)。
2.3 HES联合PTX抑制OSCC的迁移及侵袭
10 μmol/L HES和PTX对Tca8113细胞没有明显的迁移抑制能力,但是20 μmol/L HES和PTX能够在一定程度上抑制细胞迁移及侵袭,但当以10 μmol/L HES+10 μmol/L PTX联合处理时,迁移及侵袭的细胞数目显著降低,效果优于20 μmol/L PTX,差异具有显著性(P<0.05)(图 1)。

表 1 HES联合PTX对Tca8113细胞的增殖抑制作用和诱导凋亡作用

图 1 HES联合PTX对Tca8113细胞迁移的影响
2.4 HES联合PTX对OSCC裸鼠移植瘤的抑制作用
HES+PTX组的瘤体体积始终低于2×PTX组,处在各组最低(图 2);HES组、PTX组、2×PTX组和HES+PTX组的瘤体质量和肿瘤抑制率均低于对照组,且HES+PTX组肿瘤抑制率高于HES组、PTX组、2×PTX组,差异有统计学意义(P<0.05)(表 2)。

图 2 橙皮苷联合紫杉醇对裸鼠移植瘤体积的影响
2.5 HES联合PTX对裸鼠移植瘤组织的病理形态特征的影响
HE染色结果可以看出对照组肿瘤细胞丰富,排列密集,细胞核和细胞质的比例较大;HES组、PTX组、2×PTX组和HES+PTX组的肿瘤细胞数目减少,排列稀疏,大部分细胞胞浆透明成空泡状,可见凋亡小体及大范围坏死区(图 3)。

表 2 HES联合PTX对裸鼠移植瘤重量的影响及肿瘤抑制率
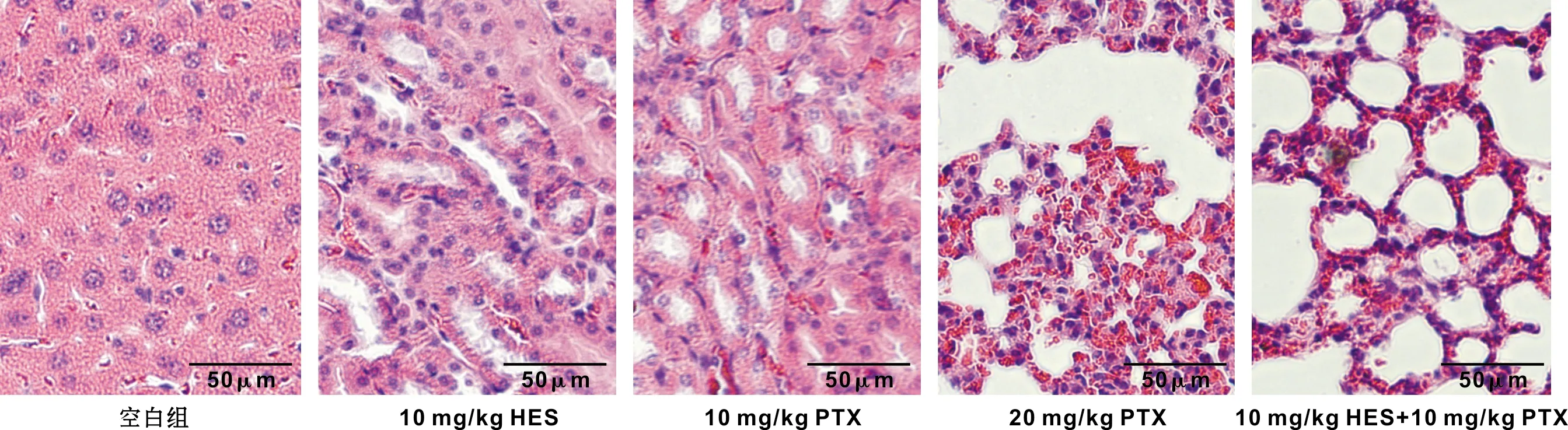
图 3 HES联合PTX对裸鼠移植瘤瘤体组织病理形态影响
2.6 HES联合PTX对OSCC裸鼠移植瘤细胞凋亡的影响
空白对照组肿瘤组织凋亡细胞很少,而在实验组中,HES组、PTX组、2×PTX组和HES+PTX组的黄棕色细胞数量较对照组增加,且HES+PTX组凋亡数量最多,较HES组、PTX组、2×PTX组的凋亡细胞数差异有统计学意义(P<0.05)(图 4)。
2.7 HES联合PTX对OSCC裸鼠移植瘤凋亡及迁移蛋白表达的影响
Western blotting结果如图 5,凋亡蛋白中,HES组、2×PTX组和HES+PTX组的裸鼠移植瘤组织中Bax、Caspase-3蛋白表达水平显著升高,Bcl-2的蛋白表达明显降低,与空白组比较,差异有显著性(P<0.05),同时这几种蛋白在HES+PTX组较HES组和2×PTX的表达差异有统计学意义(P<0.05)。在细胞迁移蛋白中,HES+PTX组的裸鼠移植瘤组织中MMP-9,N-cadherin及snail蛋白表达明显下调,E-cadherin蛋白表达升高,与空白对照,HES组及2×PTX组相比具有显著性差异。
3 讨 论
化学治疗的不断深入及多种化疗药物的开发及应用,使其在OSCC发挥着越来越重要的作用[10-11]。不同的药物联合使用,不仅可以减少部分不良反应较大药物的用量,同时也可以达到更好的效果[12]。中药提取物近年来在多种疾病上的应用和取得的疗效已经得到广泛认可[13]。HES从中药橙皮中提取出,被证实具有抗老化、抗炎、提高免疫力及神经保护的作用并能够对几种消化道癌症起到抑制增殖的作用。本研究证实HES对OSCC具有增殖抑制作用,当联合PTX后,对细胞的增殖抑制率高达16.38%±1.24%。为了验证两者共同使用引起的增殖抑制作用是协同作用还是叠加作用,检测20 μmol/L PTX组细胞存活率,可看出10 μmol/L HES+10 μmol/L PTX对细胞的增殖抑制效果要强于20 μmol/L PTX,证明了HES能够协同PTX增强对OSCC的增殖抑制作用。利用流式细胞术和Transwell实验检测细胞凋亡情况和迁移情况,可以看出当以10 μmol/L HES+10 μmol/L PTX联合处理时,凋亡细胞比例达到83.68%,迁移细胞数量比例降低65%,显著优于2 种药物分别以20 μmol/L 处理时对细胞产生的效果,说明两种药物联用具有较好的协同作用。

图 4 HES联合PTX对裸鼠移植瘤瘤体组织细胞凋亡的影响

图 5 HES联合PTX对OSCC裸鼠移植瘤细胞中凋亡及迁移相关蛋白表达的影响
体内实验是验证药效的关键步骤,有研究表明10 mg/kg的PTX对瘤体的生长抑制率为50%左右,因此本研究同样选取了10 mg/kg的PTX为对照浓度。此前有研究证明HES具有体内抗癌活性的同时认为HES的处理浓度在10~15 mg/kg,为研究HES及PTX联合使用的抗癌效果,将HES的处理浓度定为10 mg/kg。结果显示10 mg/kg HES+10 mg/kg PTX对裸鼠瘤体的体积和质量的抑制程度进一步加大,肿瘤抑制率为66.17%,显著优于20 mg/kg PTX组。HE染色和TUNEL实验检测细胞凋亡率,结果显示,HES+PTX组凋亡数量最多达到78.38%,较HES组、PTX组、2×PTX组的凋亡细胞数差异有统计学意义(P<0.05)。通过对瘤体组织蛋白表达检测结果显示,2×PTX组和HES+PTX组的裸鼠移植瘤组织中Bax、Caspase-3蛋白表达水平显著升高,Bcl-2的蛋白表达明显降低,但是HES+PTX组的变化程度要大于2×PTX组,两组之间的差异有显著性(P<0.05),说明HES联合PTX后能够提高对肿瘤的诱导凋亡能力。
体外实验已从细胞层面上证明HES和PTX联用对Tca8113细胞具有较好的抑制迁移及侵袭的作用,在分子水平上检测迁移相关蛋白的表达中发现HES处理组和2×PTX处理组的迁移相关蛋白的表达和空白组没有差异,但HES+PTX组能下调裸鼠移植瘤组织中MMP-9,N-cadherin及Snail蛋白表达,上调E-cadherin蛋白的表达,早有研究表示这些蛋白与调节细胞迁移相关[14-15],表明PTX和HES联用具有抑制细胞迁移的能力。
综上所述,HES对和PTX联用能够显著促进肿瘤细胞凋亡,抑制癌细胞发生迁移,可能发挥协同抗癌作用,其协同效应值得进一步深入研究。
