髓源性生长因子对糖尿病小鼠BMSCs骨向分化的影响及机制研究
2020-12-04刘翠徐晓丽李金儒朱彪李欢向光大郭红延
刘翠 徐晓丽 李金儒 朱彪 李欢 向光大 郭红延
随着人口老龄化的发展,2型糖尿病患者人数迅猛增加[1]。2型糖尿病是一种以高血糖为基础表征的慢性代谢性疾病,高血糖抑制骨髓间充质干细胞(bone-marrow mesenchymal stem cells,BMSCs)骨向分化。因此,糖尿病患者的种植成功率远低于健康人群[2]。骨骼也是一种内分泌器官,骨源性生长因子参与全身代谢的调节[3]。Korf-Klingebiel等[4]利用生物信息学技术从骨髓细胞中筛选出一种新型骨髓源性分泌蛋白,并将其命名为髓源性生长因子(myeloid-derived growth factor,MYDGF),其可通过激活PI3K/Akt信号通路抑制心肌细胞凋亡,而PI3K/Akt信号通路在糖代谢的过程中发挥重要作用。本课题组的前期研究也发现,MYDGF可通过提高胰高血糖素样肽1的分泌改善2型糖尿病小鼠的血糖水平[5]。但是,MYDGF能否促进糖尿病小鼠BMSCs成骨分化及其机制尚不清楚。因此,本研究拟以体外培养的糖尿病小鼠BMSCs为研究对象,探讨MYDGF对糖尿病小鼠BMSCs骨向分化的影响及其信号机制。
1 材料与方法
1.1 主要材料、试剂与仪器
4 周龄雄性SPF级C57小鼠10 只及高脂饲料(60.0%的能量由脂肪供应)(北京华阜康生物科技有限公司)。重组MYDGF、茜素红S染色试剂盒(北京百奥莱博);α-MEM培养基、DMEM培养基(Gibco,美国);胎牛血清(Gemini,美国);胰酶、β-甘油磷酸钠、左旋维生素C、地塞米松、L-谷氨酰胺、DMSO、青霉素、链霉素(Sigma,美国);Trizol(Invitrogen,美国);CCK-8试剂盒(武汉博士德);碱性磷酸酶(ALP)试剂盒(上海碧云天生物);兔抗人磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)单克隆一抗, 磷酸化PI3K(p-PI3K)单克隆一抗、兔抗鼠蛋白激酶B(protein kinase B, Akt)单克隆一抗,磷酸化Akt(p-Akt)单克隆一抗、山羊抗兔单克隆二抗(Cell Signaling Technology,美国);CD44、CD45、CD31、CD34、CD73、CD90、CD105、CD29抗体(BD Biosciences,美国);BCA测定试剂盒(南京建成);PVDF膜(Millipore,美国)。
MCO-15AC型二氧化碳恒温培养箱(Sanyo,日本);SW-CJ-1FD型生物净化工作台(苏州安泰);稳豪倍优型血糖仪(强生公司,美国);5702R型低速离心机、Biophotometer核酸蛋白测定仪(Eppendorf,德国);340型酶联仪(BDSL,英国);CytoFLEX 型流式细胞仪(Beckman Coulter,美国);DYY-7C型电泳仪、DYCZ-40型转膜仪(北京六一仪器);BX-53型正置荧光显微镜(Olympus,日本)。
1.2 糖尿病小鼠造模
10 只C57小鼠给予高脂饲料喂养4 周,小鼠禁食12 h后按照50 mg/kg的剂量腹腔注射链脲佐菌素(STZ),连续注射5 d。注射1 周后检测血糖,以空腹血糖≥7.0 mmol/L和(或)餐后2 h血糖≥11.1 mmol/L作为造模成功的标准,共成功造模7 只。
1.3 全骨髓贴壁法分离、培养BMSCs
无菌条件下分离糖尿病小鼠双侧胫骨,钝性剥离肌肉,将胫骨浸入PBS缓冲液中,剪掉干骺端,暴露髓腔。使用1 ml注射器抽取PBS缓冲液反复冲洗髓腔,将冲出的骨髓液1 000 r/min离心后弃上清;然后,用α-MEM培养液重悬细胞沉淀,接入细胞培养瓶中培养,4 d后全换液。待细胞长满瓶底面积的90%时,开始传代。
1.4 BMSCs表型鉴定
0.5 g/L胰酶消化第3代BMSCs制成2×105/ml单细胞悬液备用。使用200 μl EP管,分别加入荧光标记的抗CD44、CD45、CD31、CD34、CD73、CD90、CD105、CD29抗体,4 ℃避光孵育30 min。然后,使用PBS缓冲液洗去未结合的抗体,上机检测。
1.5 细胞增殖活性检测
取第3代BMSCs单细胞悬液,以2.0×103/孔的密度接种于96 孔板,分别加入0(对照组;Vehicle)、25、50、100、200 ng/ml MYGDF(每组5 个复孔)。接种24 h后检测,连续检测6 d。检测时每孔中加入10 μl CCK8溶液,避光孵育培养2 h,CCK-8实验检测波长450 nm处的吸光度值(A值)。
1.6 ALP活性定量
将BMSCs以5.0×103/孔的密度接种于96 孔板,待细胞长满孔底面积的80%时,换为成骨诱导液培养。同时加入0(对照组;Vehicle)、25、50、100、200 ng/ml MYGDF(每组3 个复孔),分别于成骨诱导后的第1、3、5、7天,按试剂盒说明检测。因MYGDF可呈浓度依赖性地升高ALP活性,且100 ng/ml与200 ng/ml 浓度对升高ALP活性的作用无差异,故以下实验采用100 ng/ml MYGDF作为干预浓度。
1.7 qPCR检测成骨相关基因
加或不加100 ng/ml MYGDF的BMSCs成骨诱导培养3 d后提取总RNA,再将RNA反转录为cDNA并进行扩增,扩增条件参照既往报道[6]。检测Runt相关转录因子(runt-related transcription factor 2,Runx2)、锌指结构转录因子(Osterix,Osx)、ALP和骨钙素(osteocalcin,OCN)等基因,基因引物(表 1)由上海申工生物合成。

表 1 qPCR引物序列
1.8 PI3K/Akt信号通路的检测
取BMSCs单细胞悬液,以6.0×106/孔的密度接种于24 孔板,待细胞长满板底面积约75%时,换为成骨诱导液培养。实验分为3 组(每组5 个复孔)进行药物干预:Vehicle组,MYGDF组和MYGDF+LY294002(PI3K特异性抑制剂)组。加药顺序:先加LY294002(50 μmol/L)预处理30 min,然后加入MYGDF。加药完成后继续成骨诱导培养72 h,提取总蛋白,每个样本取50 μg总蛋白,电泳,转膜,封闭,加抗体,显影,最后使用Image J软件分析胶片灰度;加药后继续成骨诱导培养21 d行茜素红染色。
1.9 统计学分析
使用GraphPad Prism 7.0进行单因素方差统计分析,检验水准α=0.05。实验步骤至少重复3 次。
2 结 果
2.1 BMSCs的形态及表面标志物
分离的BMSCs体外培养3 d后即有细胞贴壁生长,呈集落样,形态不规则。1 周后,贴壁生长的细胞数目增多。约9 d后,细胞铺满瓶底面积的90%,开始传代培养。传代后细胞呈长条状或者纺锤状(图 1),生长迅速,4~5 d便铺满瓶底面积的90%。干性鉴定结果显示(图 2):BMSCs不表达造血干细胞表面标志物,CD31(0.20%),CD34(0.41%),CD45(0.65%);高表达间充质干细胞表面标志物,CD44(99.99%),CD73(99.76%),CD105(93.50%),CD29(99.73%)和CD90(98.40%)。以上实验结果说明成功分离培养小鼠间充质干细胞。

图 1 BMSCs形态
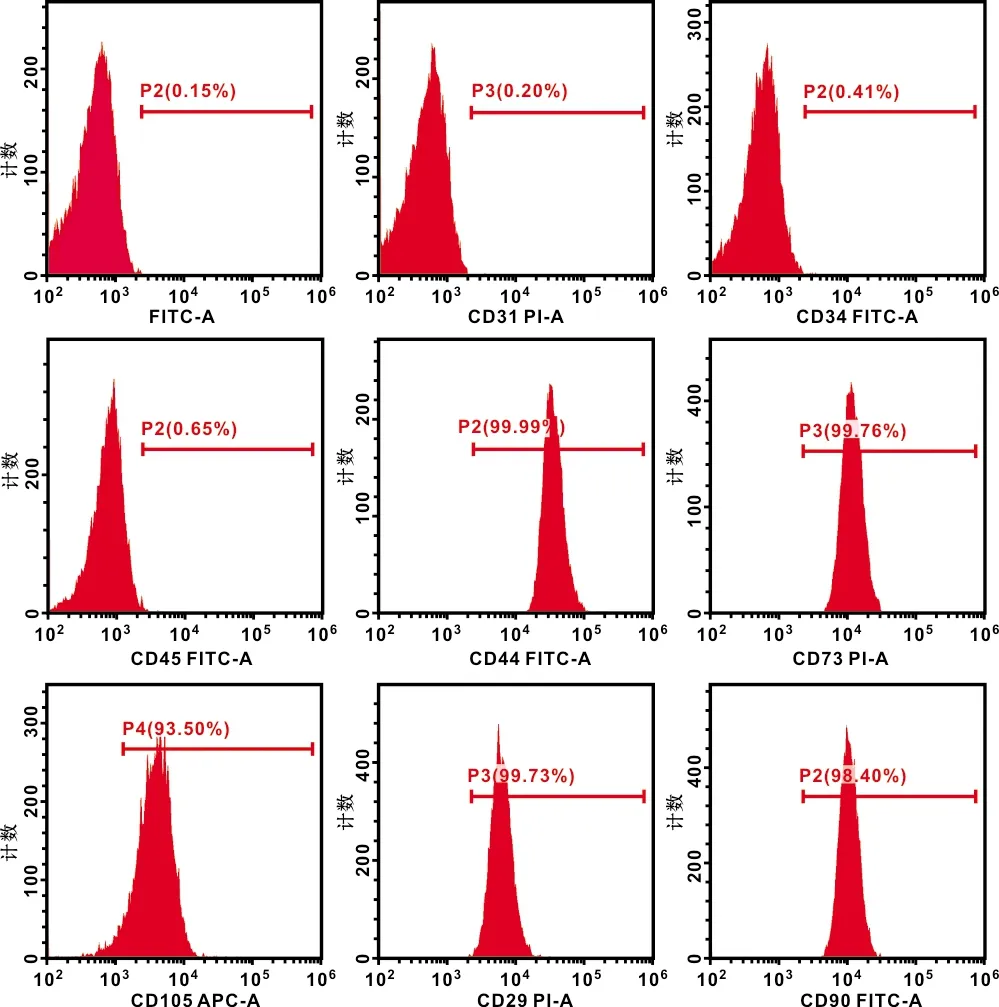
图 2 BMSCs表面标志物
2.2 BMSCs的增殖
BMSCs增殖曲线测定结果显示:与Vehicle组相比,不同浓度的MYGDF均能显著促进糖尿病小鼠BMSCs增殖,差异有统计学意义(P<0.05);但是,25、50、100与200 ng/ml MYGDF促进BMSCs增殖的作用组间差异无统计学意义(表 2)。
2.3 ALP活性定量
诱导培养3 d后,BMSCs的ALP活性开始上升。在第5天时,OD值达到高峰,之后开始下降。在25~200 ng/ml的浓度范围内,MYGDF呈浓度依赖性地升高BMSCs的ALP活性,而100 ng/ml与200 ng/ml MYGDF提高BMSCs ALP活性的作用差异无统计学意义(图 3)。因此,本实验采用100 ng/ml MYGDF作为干预浓度。
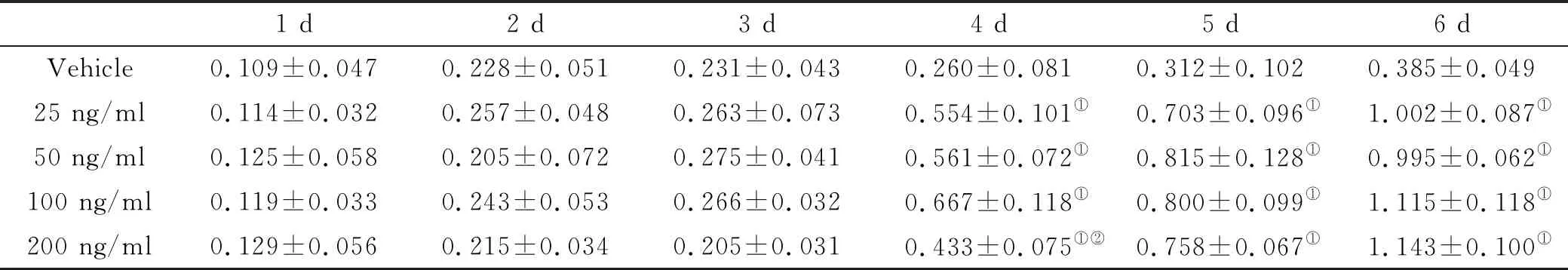
表 2 BMSCs增殖A值
2.4 成骨基因的表达
PCR结果表明:与Vehicle组相比较,MYDGF显著促进成骨相关基因Runx2、Osx和ALP的转录表达,差异有统计学意义(P<0.05)(图 4)。
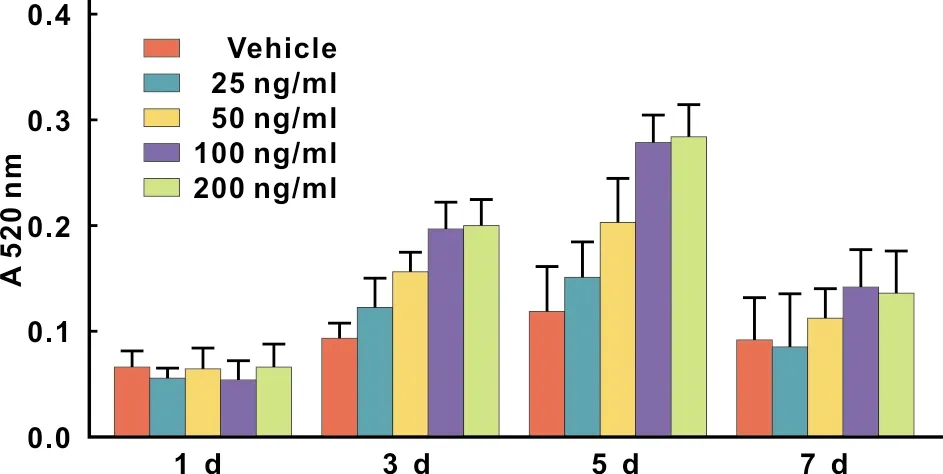
图 3 各组细胞ALP活性
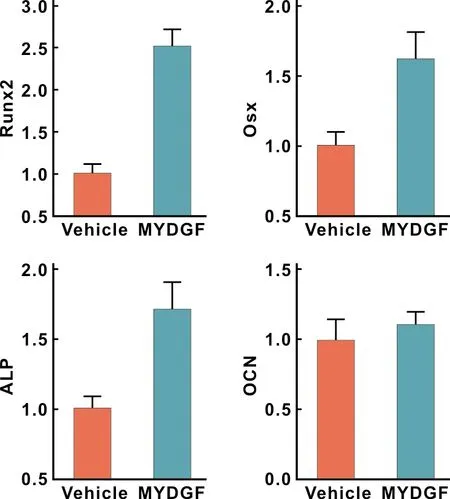
图 4 各组细胞成骨相关基因转录水平
2.5 PI3K/Akt信号通路在MYDGF促进BMSCs骨向分化中的作用
Western blot结果(图 5)显示,与Vehicle组相比,MYDGF显著提高PI3K和Akt的磷酸化水平(P<0.05),而MYDGF升高p-PI3K和p-Akt表达的作用在加入LY294002后部分消失,差异有统计学意义(P<0.05)。以上实验结果表明,在BMSCs成骨分化的过程中,MYDGF能激活PI3K/Akt信号通路。接下来,进一步采用茜素红染色探究PI3K/Akt信号通路在MYDGF促进BMSCs骨向分化中的作用。结果显示(图 5):Vehicle组相比,与MYDGF组可产生较大的矿化结节。而PI3K抑制剂LY294002可减弱MYDGF的作用,形成的矿化结节较小。以上实验结果表明,PI3K/Akt信号通路至少部分介导了MYDGF促进糖尿病小鼠BMSCs成骨分化的作用。
3 讨 论
本实验采用糖尿病小鼠BMSCs为研究对象,发现MYDGF既可促进糖尿病小鼠BMSCs增殖,又能促进其骨向分化,并且MYDGF促进糖尿病小鼠BMSCs成骨分化的作用与激活PI3K/Akt信号通路密切相关。
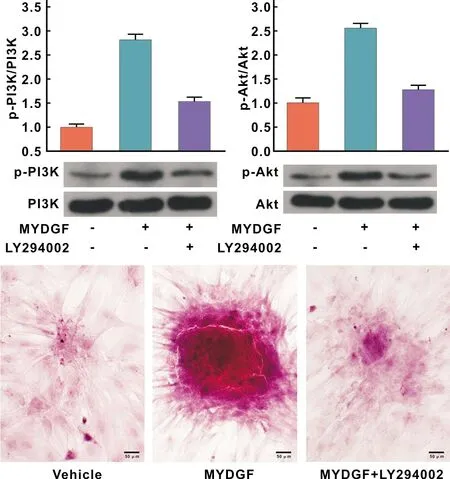
图 5 PI3K/Akt信号通路在MYDGF促进BMSCs骨向分化中的作用
骨骼是运动器官,也是机体矿物质的储存库,还参与造血。近年来,越来越多的研究表明,骨骼也是一种内分泌器官,骨骼来源的细胞因子能调节并维持机体糖代谢的平衡。例如:成骨细胞和骨细胞分泌的成纤维细胞生长因子23是胰岛素抵抗发生的标志物[7];成骨细胞分泌的骨钙素可以促进胰岛β细胞增殖并促进胰岛素分泌[8],而且骨钙素还能促进葡萄糖的利用[9];BMSCs外泌体来源的MiR-29b-3p能改善衰老相关的胰岛素抵抗[10]。MYDGF是近年来新发现的一种骨髓来源的细胞因子,由单核巨噬细胞分泌[11]。本课题组前期的实验结果表明,MYDGF能改善2型糖尿病小鼠的血糖水平[5]。本实验在前期工作的基础上发现,MYDGF可对抗高糖对BMSCs成骨分化的抑制作用,促进糖尿病小鼠BMSCs成骨分化。
最近有研究表明,MYDGF发挥心肌梗死的保护作用与激活PI3K/Akt信号通路有关[4], PI3K/Akt信号通路也是胰岛素发挥作用的主要信号通路。而且,在BMSCs成骨分化的过程中,PI3K/Akt信号通路也发挥重要作用。例如,利拉鲁肽可通过激活PI3K/Akt信号通路促进犬BMSCs成骨分化[6]。因此,本实验探讨PI3K/Akt信号通路在MYDGF促进糖尿病小鼠BMSCs成骨分化中的作用。结果表明,MYDGF可激活PI3K/Akt信号通路;并且在特异性地阻断PI3K/Akt信号通路后,MYDGF促进糖尿病小鼠BMSCs成骨分化的作用部分消失。但是, 阻断PI3K/Akt信号通路后,MYDGF的作用并未完全消失,这提示MYDGF也可能通过其它信号通路进行信号转导。 众所周知,Wnt/β-catenin是BMSCs成骨分化的经典信号通路,而MYDGF促进糖尿病小鼠BMSCs成骨分化的过程中是否也能激活Wnt/β-catenin信号通路值得进一步研究。
Runx2和Osx是成骨细胞特异性表达的转录因子[12]。本实验qPCR结果表明,在成骨分化过程中,MYDGF促进糖尿病小鼠BMSCs细胞Runx2和Osx转录表达。启动Runx2和Osx的转录表达后可促进下游骨蛋白的表达进而调节骨形成[13],ALP和OCN分别是成骨早期和进入矿化期的标志物[14-15]。本实验结果还显示,MYDGF显著升高ALP的转录水平,而升高OCN转录表达的作用并不明显。这可能是由于PCR实验进行的时间是在成骨早期,所以晚期成骨分化标志物的表达并不显著。
本研究还存在一些局限性。例如,本研究只关注了MYDGF对糖尿病小鼠BMSCs成骨分化的影响及其信号机制,而进一步探讨MYDGF对正常小鼠BMSCs成骨分化的影响将会加深对MYDGF作用的了解并扩大MYDGF的应用范畴。
综上所述,本研究发现MYDGF能够促进糖尿病小鼠BMSCs成骨分化,因此MYDGF干预可能是未来改善糖尿病患者种植区骨量不足的一种潜在的治疗方法。
