不同炎性微环境对脂肪来源间充质干细胞增殖及分化的影响
2020-12-04原芳芳王丽刘伟吴松芳郭红延
原芳芳 王丽 刘伟 吴松芳 郭红延
近年来,脂肪来源间充质干细胞(adipose stem cells,ADSCs)因易于获取、增殖能力强且具有多向分化能力等优点[1],而成为骨组织再生的重要细胞来源[2]。但如何在复杂的体内环境中有效控制干细胞递送、生存、增殖及分化仍然面临挑战,干细胞的疗效受到一系列因素的影响,其中局部炎性微环境起到关键性作用[3-4]。
巨噬细胞是炎症免疫的关键调节者。根据功能和表面抗原的不同,巨噬细胞分为促炎M1型和抗炎M2型两种亚群。M1型巨噬细胞分泌大量促炎因子和趋化因子,主要发挥宿主免疫清除功能;M2 型巨噬细胞分泌多种细胞因子,在促进组织修复方面有重要作用[5]。越来越多的研究表明,不同亚型的巨噬细胞分泌的细胞介质对干细胞的募集、增殖和分化具有不同影响[6-8]。但是其对ADSCs细胞行为有何影响的相关文献还未见报道。
本实验利用脂多糖(lipopolysaccharide,LPS)和干扰素γ(interferon-gamma,IFN-γ)刺激巨噬细胞向M1亚型极化;利用白介素4(interleukin,IL-4)刺激巨噬细胞向M2亚型极化[9],得到含不同炎性因子的条件培养基来模拟不同的炎性微环境,分析比较CM1、CM2对ADSCs增殖和分化方面的影响。
1 材料与方法
1.1 实验动物和材料
α-MEM培养基、RPMI-1640培养基、胎牛血清(FBS)(Gibco,美国);磷酸盐缓冲液(PBS)(北京索莱宝);细胞计数试剂盒(CCK-8)(Dojindo,日本);茜素红染色液、油红O染色液(Cyagen,美国);APC标记抗小鼠F4/80流式抗体、PE标记抗小鼠CD206、CD86流式抗体、红细胞裂解液(Biolegend,美国);LPS(Sigma,美国);巨噬细胞集落刺激因子(M-CSF); IFN-γ、重组小鼠IL-4(Peprotech,美国);CD206抗体、CD86抗体(Abcam,英国)。
1.2 小鼠骨髓源性巨噬细胞的分离、培养与鉴定
取C57BL/6小鼠,无菌分离双侧股骨、胫骨,用RPMI-1640培养基冲出骨髓于50 ml离心管中。加入2 ml红细胞裂解液混匀后静置5 min,终止反应后300 g离心5 min。随后用含20 ng/ml M-CSF、2 mmol/L L-谷氨酰胺、10%FBS以及1%青霉素-链霉素的RPMI-1640 培养基重悬,接种于培养皿中。培养8 d后使用CD68(M1型巨噬细胞表面标志物)检测细胞形态,使用流式细胞术检测F4/80(巨噬细胞表面标志物)表达率,分析所得巨噬细胞纯度。
1.3 巨噬细胞的极化刺激与鉴定
所得细胞培养8 d后,更换M1型或M2型极化刺激液,培养24 h即得到M1、M2型巨噬细胞。M1型极化刺激液由LPS(100 ng/ml)、IFN-γ(20 ng/ml)、10%FBS、1%青霉素-链霉素以及RPMI-1640培养基配置;M2型极化刺激液由重组小鼠IL-4(20 ng/ml)、10%FBS、1%青霉素-链霉素以及RPMI-1640培养基配置。使用CD86以及CD206(M2型巨噬细胞表面标志物)检测细胞形态,使用流式细胞术检测F4/80+细胞中CD86+或CD206+的比例,分析不同极化类型巨噬细胞纯度。
1.4 收集条件培养基
极化刺激24 h后,更换不含刺激液的培养基再孵育24 h。因间充质干细胞对巨噬细胞具有免疫调节作用[10-12],应更换前使用PBS清洗两遍,以确保除去刺激因子。收集上清液并以1 950g离心20 min。然后通过0.22 μm针氏滤器过滤以除去细胞和碎片。将所得条件培养基分装后于-80 ℃冰箱储存备用。
1.5 分离培养ADSCs
取SD大鼠,无菌分离腹股沟处脂肪,剪碎并加入4 ml 0.25%EDTA-胰酶、1 ml Ⅳ型胶原酶、1 ml dispase酶以及4 ml H-DMEM,15 min后终止消化并将已过滤的细胞悬液移至离心管中,1 000 r/min离心5 min,弃上清,重悬细胞并接种至培养皿中,置于细胞培养箱中培养,用于后续实验。
1.6 CCK-8法检测ADSCs的增殖
将ADSCs接种于96孔板,待细胞贴壁后,更换为CM1、CM2或新的完全培养基,每组设5复孔。检测时每孔加入10 μl CCK-8溶液,继续孵育3 h。随后使用酶标仪立即测定450 nm处的吸光度值(A)。
1.7 成骨诱导ADSCs分化及检测
将ADSCs接种于6孔板,待细胞贴壁后,更换含有成骨诱导剂(0.1 μmol/L地塞米松、50 μmol/L维生素C、10 mmol/L β-甘油磷酸钠)的CM1、CM2或完全培养基,每组设3复孔。培养14 d后,进行茜素红染色并使用Image J软件对结果进行半定量分析。
1.8 成脂诱导ADSCs分化及检测
将ADSCs接种于6 孔板,待细胞贴壁后,更换含有成脂诱导剂(1 μmol/L氢化可的松、0.5 μmol/L异丁基甲基黄嘌呤、10 ng/ml胰岛素、1 μmol/L地塞米松)的CM1、CM2或完全培养基,每组设3复孔。培养14 d后,进行油红O染色并使用Image J软件对结果进行半定量分析。
1.9 成骨、成脂分化相关基因的RT-PCR检测
3 组ADSCs经成脂或成骨诱导培养后,在14 d时提取各组细胞总RNA,进行RT-PCR检测。成骨相关基因引物为Runt相关转录因子(related transcription factor 2,RUNX2)、骨钙蛋白(osteocalcin,OCN)以及特异性AT富集序列结合蛋白2(specific AT enrichment sequence binding protein 2,SATB2),成脂标志基因引物为成脂过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gama,PPAR-γ)和转录调节因子CCAAT增强子结合蛋白α(CCAAT/enhancer binding protein alpha,C/EBPα)。引物序列见表 1。
1.10 统计学分析
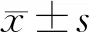
2 结 果
2.1 巨噬细胞形态观察及鉴定
免疫荧光染色结果发现CD68+的细胞形状多样,呈不规则型,有伪足;核为卵圆形、肾形或不规则形,偏于细胞一端,呈现典型的巨噬细胞形态(图 1A);流式细胞术检测结果显示F4/80的阳性表达率为99.2%(图 1B),成功获得小鼠骨髓来源的巨噬细胞。

表 1 RT-PCR 引物序列
图 1 巨噬细胞表型鉴定
2.2 巨噬细胞刺激极化后检测极化效果
免疫荧光染色结果显示巨噬细胞极化后形态发生变化,向M1型极化的巨噬细胞呈“煎蛋样”,伪足较短(图 2A);而向M2型极化巨噬细胞伪足较细长,呈“细长纺锤样”[13](图 2C)。流式细胞术分析显示F4/80+细胞中CD86+的比例约为90.7%(图 2B);F4/80+细胞中CD206+的比例约为90.1%(图 2D)。

图 2 不同类型巨噬细胞表型鉴定
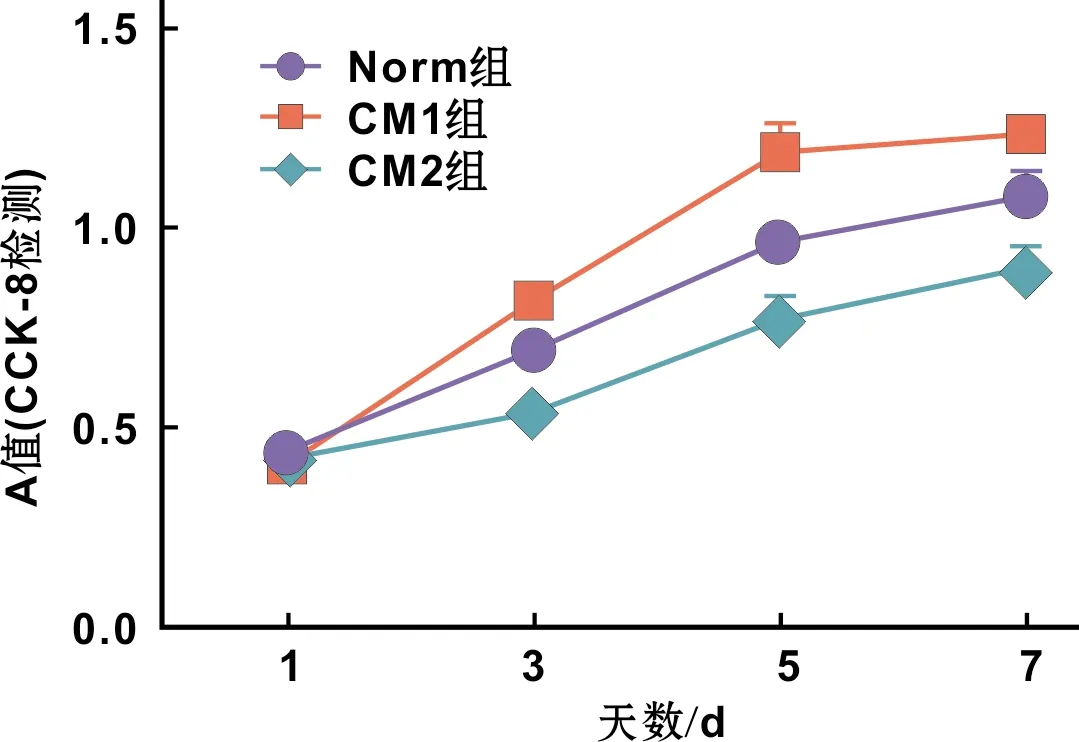
图 3 3 组ADSCs增殖曲线
2.3 ADSCs增殖的检测
CCK-8检测结果显示培养1 d,3 组之间A值差异无统计学意义(P>0.05);培养3 d,CM2组A值显著低于CM1和Norm组(P<0.001),CM1和Norm组间差异无统计学意义(P>0.05);培养5、7 d,CM1组A值均显著高于CM2和Norm组(P<0.001),即CM1组细胞增殖量最高,CM2组最低(图 3)。
2.4 ADSCs成骨分化的检测
茜素红染色结果显示3 组均观察到矿化结节生成,呈分散状;半定量分析显示CM2组中的ADSCs产生矿化结节的数量显着高于其他2 组(P<0.05)(图 4)。RT-PCR检测结果发现CM2组RUNX2、OCN、SATB2的相对表达量均明显高于其他2 组(P<0.001)。CM1组与Norm组相比,RUNX2相对表达量Norm组高于CM1组(P<0.001),而OCN、SATB2表达量2 组之间差异无统计学意义(P>0.05)(图 5)。
2.5 ADSCs成脂分化的检测
油红O染色结果及半定量分析显示成脂诱导14 d后CM1组中的ADSCs相比其他2 组产生了更多的脂滴(P<0.05)(图 6)。RT-PCR分析显示,CM1组PPAR-γ、C/EBPα mRNA相对表达量均明显高于其他2 组(P<0.01)。PPAR-γ相对表达量Norm组低于CM2组(P<0.001),而C/EBPα表达量2 组之间差异无统计学意义(P>0.05)(图 7)。
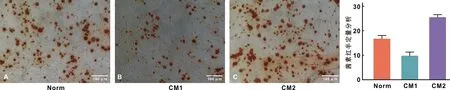
图 4 3 组ADSCs成骨诱导后茜素红染色以及半定量分析结果

图 5 3 组ADSCs成骨诱导后相关基因的表达结果
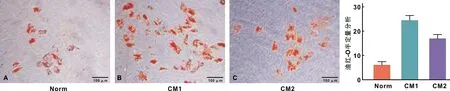
图 6 3 组ADSCs成脂诱导后油红-O染色以及半定量分析结果

图 7 3 组ADSCs成脂诱导后相关基因的表达结果
3 讨 论
He等[14]研究者使用不同亚型RAW264.7细胞的条件培养基培养骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs),结果表明基于M2型巨噬细胞条件培养基促进BMMSCs的成骨分化潜能,还增强了其细胞片层的形成能力。Lu 等[15]将M0、M1和M2 3 种亚型巨噬细胞与BMMSCs直接共培养,发现虽然所有巨噬细胞亚型均增强骨形成,但是M1型的增强作用最大,其主要机制可能是促炎型M1巨噬细胞通过环氧酶-2-前列腺素E2途径促进BMMSCs成骨。本实验中结果与该结论存在一定的差异,可能的原因是共培养过程中单核细胞和其他细胞因子的参与。由于各研究中所用巨噬细胞的来源、刺激方案及共培养方式的不同,可能导致它们对促进MSCs成骨作用的相关性在不同生理条件下有所改变[16-18]。
本实验发现CM1组中的ADSCs诱导成脂效果最好,而CM2组中的ADSCs诱导成脂效果在一定程度上受到抑制。Cao等[19]将巨噬细胞与MSCs共培养后观察到MSCs的成脂分化能力被明显抑制,局部微环境主要诱导RAW246.7巨噬细胞向M2表型发生极化,其主要机制是CXCR2通过改变p38/ERK-Elk1信号传导途径的活化来调节MSC的脂肪形成分化。与本实验结论一致,巨噬细胞与MSCs之间的相互作用在巨噬细胞极化和MSCs脂肪分化调控中有着重要影响。但是目前对于极化巨噬细胞条件培养基对ADSCs脂肪形成分化的影响研究报道较少,具体机制尚还需进一步研究。
总之,本实验证实CM1可以增强ADSCs的增殖潜力和成脂分化能力;CM2显著增强了ADSCs成骨能力。研究结果可为基因治疗及干细胞移植治疗后,干细胞在不同微环境下的行为学判断以及治疗预后评估提供参考。
