透明质酸微球的制备及细胞毒性的研究
2020-12-04张璇李祥伟宋文龙倪世磊邱滢刘慧敏李娜
张璇 李祥伟 宋文龙 倪世磊 邱滢 刘慧敏 李娜
通过牙髓组织工程再生牙髓牙本质复合体恢复患牙生理功能的研究具有潜在的临床应用前景。组织工程包括种子细胞、生长因子和支架三要素。其中,干细胞具有自我更新和多潜能分化的能力,是组织工程的重要种子细胞资源[1]。人牙髓干细胞(human dental pulp stem cell,hDPSCs)是牙髓组织工程选用的主要种子细胞。考虑髓腔和根管的解剖特点,选择方便操作的适宜的支架是牙髓组织工程的关键环节之一。微球是组织工程较常用的载体结构,更好地模拟了体内环境。目前,多种天然及合成材料已被用于牙髓组织再生的研究,如自组装系统,水凝胶或生物陶瓷等[2],乳化交联法是较常用的微球制备方法。
透明质酸(hyaluronic acid,HA)是一种非硫酸化的糖胺聚糖,是细胞外基质(extracellular matrix,ECM)的主要成分,由N-乙酰氨基葡萄糖和葡萄糖醛酸的重复双糖组成,由于其独特的理化性质,HA被作为一种保湿因子、润滑剂和支架材料,具有缓冲压力、填充剂和扩散屏障、清除自由基和调节免疫等多种生理功能[3-4]。细胞增殖过程中HA的产生增加,该聚合物可能在有丝分裂中发挥作用[5]。新证据表明,HA可诱导脂肪源性干细胞和人羊膜间充质干细胞的增殖[6-7]。壳聚糖/透明质酸纳米粒可以安全有效地将miR-148b转染入大鼠骨髓间充质干细胞中[8]。HA在口腔疾病的治疗中也得到了广泛的应用[9]。研究表明透明质酸联合明胶海绵在拔牙中的应用在减少术后出血、感染和肿胀方面有明显的作用[10]。据此推测,HA微球有望成为种子细胞载体应用于牙髓组织工程,该研究未见报道。本研究通过乳化交联法制备HA微球并进行表征,通过微球与牙髓干细胞共培养和细胞学检测以评价该微球作为细胞载体的可行性。
1 材料与方法
1.1 主要试剂和仪器
透明质酸钠(上海源叶生物科技有限公司,分子量100~150 万);己二酸二酰肼(ADH,上海源叶生物科技有限公司);1-乙基-(3-二甲基氨基丙基)碳二亚酰胺盐酸盐(EDC·HCL,上海阿拉丁生物试剂有限公司);异丙醇、二氯甲烷、司盘80(Span-80)、石蜡(天津市华东试剂厂);6 mg/ml I型胶原酶、8 mg/ml中性蛋白酶(Sigma Aldrish,美国);噻唑蓝(MTT,Amresco,美国);双抗(PAA,美国);胰蛋白酶(Hyclone,美国)HDMEM培养液(Gibco,美国);胎牛血清(Biological Industries,以色列)、恒温细胞培养箱(Sanyo,日本);场发射扫描电子显微镜(Jeol,日本)。
1.2 HA微球的制备
1.2.1 HA溶液的配置 将0.25 g的HA溶于49.75 ml的去离子水中,充分搅拌至完全溶解,配置0.5%的HA溶液50 ml,封口膜密封,置于4 ℃冰箱备用。
1.2.2 HA交联微球的制备 将20 ml的石蜡与0.25 ml的Span-80均匀混合作为油相。取5 ml的HA溶液,加入25 mg的ADH搅拌溶解混匀,加入适量稀释好的0.1 mol/L的HCL水溶液调节pH为4~5,油相在中等强度的超声下,将其逐滴缓慢加入HA溶液中,600 r/min磁力搅拌器下反应30 min;将30 mg的EDC·HCL溶于0.5 ml去离子水中,缓慢加入混合液中,室温下反应24 h。反应结束后,在剧烈的搅拌条件下加入37.5 ml的异丙醇,3 000 r/min的条件下离心5 min,弃上清得到微球沉淀,再用一定量的二氯甲烷洗涤,超声,弃上清得到微球。将得到的固体在通风橱中静置干燥。
1.3 HA微球SEM观察
SEM观察样品制样,将干燥的HA微球粉末均匀分散于粘有导电胶的电镜样品台上,喷金3次,通过SEM观察微球形貌。
1.4 HA微球的粒径及粒径分布
称取20 mg的HA微球,将其悬浮在2 ml的磷酸盐缓冲液中,待其在磷酸盐缓冲液中达到平衡的状态时,使用纳米粒度仪测其粒径分布。
1.5 hDPSCs的分离和培养
1.5.1 hDPSCs的分离与原代培养 实验选取18~32 岁因阻生拔除的智齿,立刻转移至超净台。用含10%双抗(青霉素-链霉素)的HDMEM培养基反复冲洗牙齿表面,酒精棉球擦拭,去除表面可能附着的组织,将牙髓取出后置于1%双抗的HDMEM培养基反复冲洗2~3 次,剪碎组织块,1 500 r/min转速离心3 min,弃上清,将6 mg/ml的Ι型胶原酶和8 mg/ml的中性蛋白酶1∶1混合后加入装有组织块的聚乙烯管中,37 ℃、5%CO2孵箱内消化40 min,每隔10 min弹起混匀,待混悬液呈云絮状时,即刻加入含20%血清和1%双抗的培养液终止消化,1 500 r/min离心3 min,将消化好的组织转移至培养瓶,每3 天换液1 次,至显微镜下观察细胞铺满培养瓶的底部。
1.5.2 hDPSCs形态观察 倒置显微镜观察并记录hDPSCs 在不同时间点的生长状况及形态。
1.6 HA微球的消毒及预处理
用75%乙醇对HA微球消毒30 min,PBS清洗3次,超净台内紫外照射灭菌3 h,再以含10%胎牛血清及1%双抗的HDMEM孵育过夜。
1.7 MTT法检测细胞毒性
HA微球消毒预处理,配置含材料的不同浓度梯度的培养基。取第3代hDPSCs,选择合适的细胞数(1 d:4×103个/孔,3 d:1.5×103个/孔)接板于96 孔板中,待细胞贴壁后加入含有材料的培养基,实验组和对照组分别设置6 个复孔,于37 ℃,5%CO2孵箱中分别培养1、3 d时,弃去原有培养基,PBS冲洗3 遍,每孔加入含20 μl MTT溶液的培养基200 μl ,按照说明书进行操作,测定其在490 nm处的吸光度(A)值。
2 结 果
2.1 反应体系大体观
石蜡和司盘-80混合均匀,HA溶液缓慢逐滴加入后,整个反应体系开始变为乳浊液(图 1),随着反应的进行,最终可见乳白色均一的混悬液。
2.2 SEM观察结果
乳化交联的方法制备HA微球,可见微球的形态规则,大小均匀一致(图 2)。粒径分析仪测定HA微球的平均粒径为5~10 μm,粒径分布见图 3。
2.3 hDPSCs光镜观察
从健康人体的第三磨牙中分离出DPSCs群体,原代细胞(P0)培养15 d,细胞融合80%左右,细胞排列紧密,界限不清。待细胞铺满瓶底以1∶3比例进行传代,第一代细胞(P1)基本为梭形,排列较规则。总之,hDPSCs显示出良好的增殖能力,具有间充质干细胞典型的成纤维形态(图 4)。

图 1 反应体系大体观

图 2 HA微球的扫描电镜观察
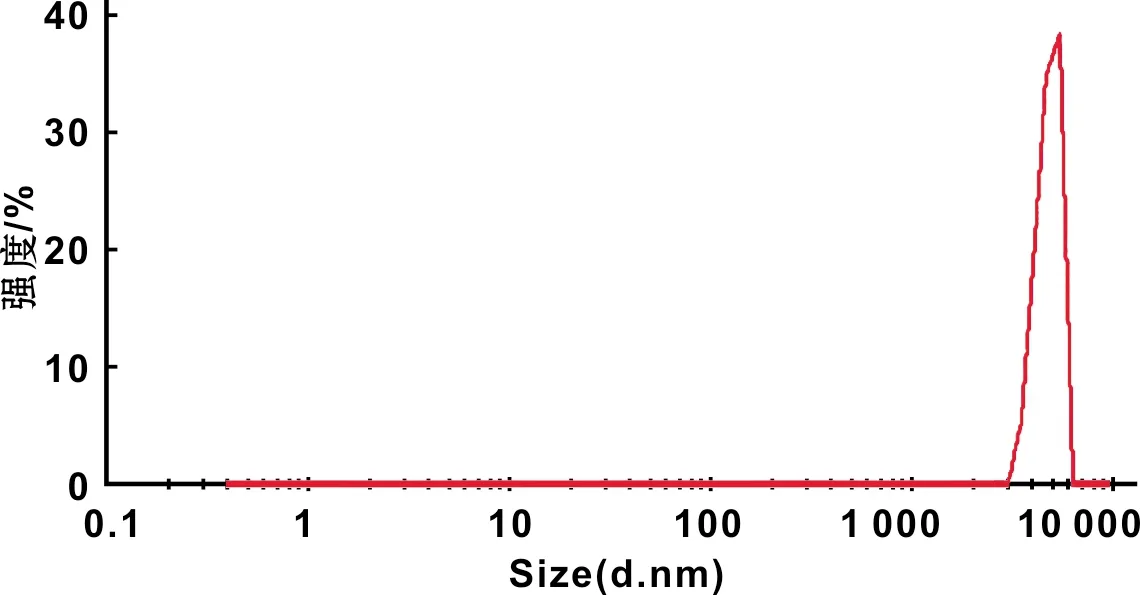
图 3 乳化交联化学法制备HA微球的粒径分布结果
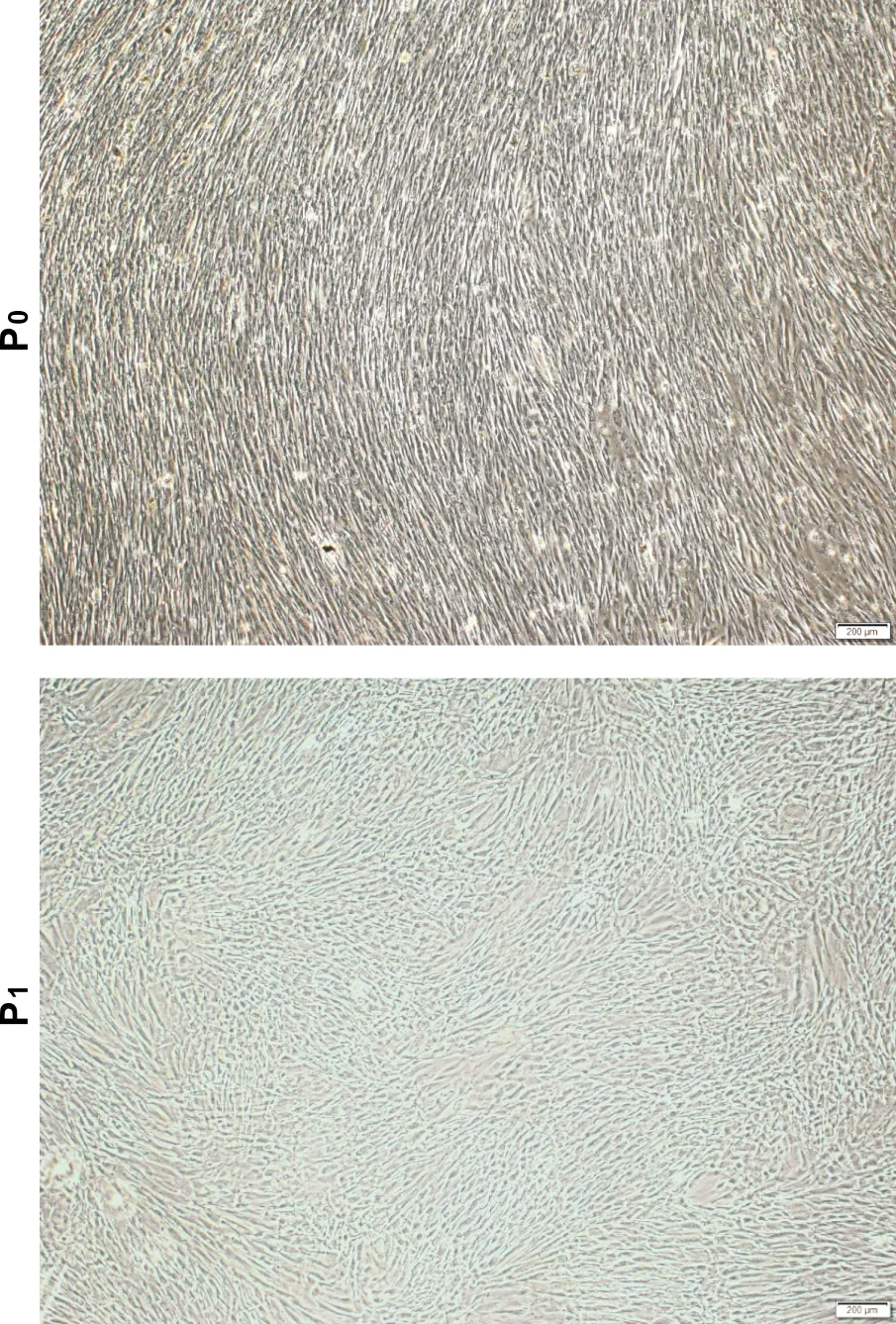
图 4 hDPSCs的形态(×40)
2.4 细胞毒性检测结果
如图 5,分别为不同浓度梯度的HA微球材料与hDPSCs共培养24、72 h后细胞的相对增殖率,24、72 h HA微球组的细胞增殖率均高于空白对照组,并随着浓度的升高其值也逐渐增加,其中,24 h浓度大于0.4 mg/ml时比较差异有统计学意义(P<0.05),72 h浓度大于0.2 mg/ml时比较差异有统计学意义(P<0.05),表明透明质酸微球材料可促进hDPSCs的增殖。根据RGR值, 参照《美国药典》毒性分级法[11],各实验组的细胞毒性均为0 级,即无细胞毒性。
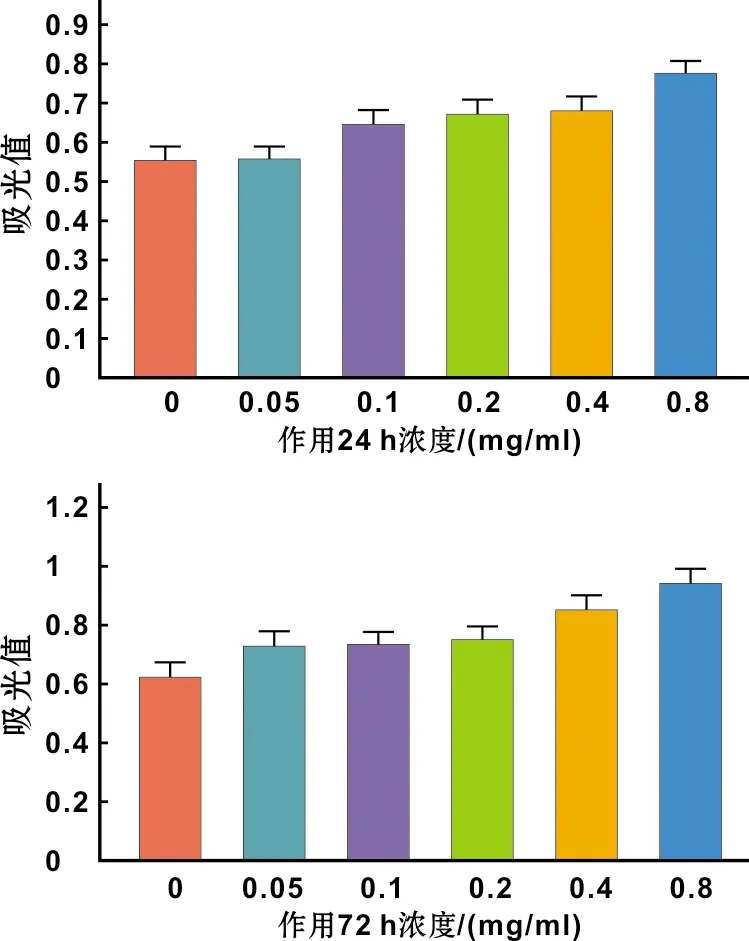
图 5 HA微球细胞毒性检测结果
3 讨 论
作为牙髓细胞外基质的主要成分,HA在维持组织形态中发挥着重要作用,透明质酸具有良好的生物活性、生物相容性、生物降解性并可通过化学改性结合生长因子[12]。牙发育过程中,牙髓组织以不同的方式表达HA,HA有助于牙本质基质发育和牙髓生长,随着年龄的增长,其表达逐渐减少[13],可见HA在保持牙髓活力和诱导牙本质修复中起着重要作用,体内实验研究表明 ,未经修饰的HA机械强度较低[14],HA联合其他材料的微球作为支架结合间充质干细胞可再生牙髓样组织[15]。HA和己二酸二酰肼反应并制备水凝胶应用于组织再生,基于髓腔和根管的解剖特点,微球载体更为适宜作为牙髓再生的种子细胞载体,但HA微球作为牙髓再生支架的研究未见报道。目前制备透明质酸微球的方法如喷雾干燥法[16],需要复杂的装置,成本较高,本研究采用的方法简单,成本低,利用机械搅拌装置即可达到制备的要求,条件温和且容易控制,制备过程中使用ADH和EDC作为反应的交联剂,避免因使用戊二醛作为交联剂带来的毒性影响,微球最终为粉末状外观,较HA凝胶方便储存,作为支架材料可采用注射的方法到达相应的部位,相比于凝胶易流动,其固位稳定性能更佳。本研究利用乳化-溶剂挥发法和化学交联方法制备具有良好机械性能和细胞相容性的HA微球。本研究制备的HA微球,SEM观察微球表面光滑,粒径大小均匀一致,粒径分布图进一步验证其为窄分布,解决了交联反应不均匀的问题,能够为组织工程提供优良的支架,但此方法制备的微球易粘连聚集的问题有待进一步的解决。HA凝胶颗粒具有大小可调,胶体稳定性好,细胞毒性低,表面积大,抗酶降解等优点,亦可作为理想的药物载体。
近年来,HA生物材料的开发和应用在生物医学领域中迅速发展,相关研究取得了长足的进展。HA是CD44的主要配体,在细胞外基质/液体中含量丰富,有助于组织的水动力学和稳态,且HA可通过与细胞表面受体(包括CD44、LYVE-1和RHAMM)结合,介导细胞增殖、迁移和分化[17],本研究发现,DPSC可在HA微球表面粘附和增殖,可见HA微球具有良好的细胞相容性,关于其中的粘附机制有待进一步研究。组织化学研究表明,牙齿发育过程中透明质酸合成酶(HAS)的表达与CD44的表达相对应[18]。HA作为细胞外基质的主要成分之一,具有很好的生物相容性,生物可降解性,非免疫原性,在组织工程和再生医学中发挥着重要的作用[19-20]。但天然HA生物机械性能较低,限制了其在组织工程方面的应用,利用乳化-交联的方法制备HA微球,可提高材料的机械性能,本研究制备的HA微球不仅为细胞的生长提供更大的粘附面积,还为细胞迁移和组织延伸提供支撑。
本研究的关于DPSC在HA微球表面增殖结果表明,在相同的时间,DPSCs数目随着HA微球浓度的增加而增多,说明HA微球具有良好的细胞相容性及促进DPSC细胞增殖的作用,因此,HA微球可作为DPSC载体应用于牙髓组织再生。另外,HA是牙髓组织中细胞外基质的主要成分之一,以HA微球最为载体进行牙髓再生,可解决部分降解残余支架材料降解周期过长而占据一定的根管空间并阻碍再生牙髓组织进一步生长的问题[21]。HA微球可进一步修饰或结合生长因子应用于其他组织工程,HA微球具有很广阔的应用前景。
组织工程已成为修复多种组织损伤或缺损的具有应用前景的治疗方法[22-23], hDPSCs具有良好的成牙分化潜能,可作为牙组织工程和再生的种子细胞,其在骨组织工程再生应用中也发挥着重要促成骨作用[24-25]。干细胞组织工程研究的重点是种子细胞的增殖、迁移和分化等。充足的种子细胞和良好生物相容性的支架材料是组织再生的关键要素。本研究制备的HA微球具有良好的细胞相容性,其可作为高质量的种子细胞支架促进hDPSCs的增殖和分化,该HA微球有望在包括牙髓组织再生在内的组织工程应用和研究方面发挥重要作用。
