黄芩内生真菌发酵黄芩苷生成千层纸素A的代谢途径及转化条件研究
2020-12-03马宗敏苗文丽孙国强
马宗敏,苗文丽,刘 佳,何 培,孙国强,裴 林
河北省中医药科学院 浊毒证重点实验室,石家庄 050031
千层纸素A(oroxylin A,OA,5,7-dihydroxy-6-methoxy flavone,C16H12O5,结构式见图4)是中药黄芩的活性组分之一,为黄酮类化合物,在黄芩中的含量约为0.05%~0.2%[1]。近年来的研究发现千层纸素A具有多种药理活性,包括抗炎[2]、抗过敏[3]、抑制病毒[4]、改善心力衰竭[5]、保护肝脏[6]、血管[7]、保护神经细胞并改善记忆[8]、抗肿瘤[9]等。尤其是千层纸素A的抗肿瘤作用受到了广泛关注,不断有国内外研究证实其对多种肿瘤细胞具有抑制作用[10,11]。千层纸素A通过诱导肿瘤细胞凋亡、抑制肿瘤细胞迁移、抑制糖酵解、自噬等途径发挥其抗肿瘤作用[12]。同时,千层纸素A选择性杀伤肿瘤细胞而对正常造血系统影响较小,这是目前肿瘤化疗药物不具备的[13]。
天然化合物活性高且毒副作用较低,但因资源有限及其特殊的立体结构,使得天然化合物的应用受到一定限制。同样的,虽然千层纸素A的药效研究乐观可期,但是千层纸素A的生产和单方制剂研究却寥寥无几[12]。千层纸素A当前的来源主要是化学提取和合成,南京某公司报道了从木蝴蝶中分离纯化千层纸素A的方法[14],通过有机溶剂提取、大孔树脂富集和聚酰胺柱层析分离纯化、重结晶后得到产物。该法提取得到的千层纸素A不足药用植物本身质量的0.1%。Majeed等[15]也报道了从一种印度药用植物Oroxylumindicum中利用有机溶剂提取千层纸素A的方法,提取物中千层纸素A含量为10%~15%,但报道中并未提及产物得率。鉴于植物中千层纸素A含量低,提取成本过高且污染严重,而且容易破坏产物的天然立体结构,对药效造成影响[12,14,15],因此国内外学者也对千层纸素A的化学合成进行了研究,合成起始物包括黄芩素和黄芩苷。Li等[16]以黄芩素为起始物通过4步化学反应得到千层纸素A,Li等[17]以黄芩苷为起始物,通过甲基化和去保护基步骤得到千层纸素A,化学合成所需步骤较多,用到多种有机试剂,污染严重,尚无适用于大规模生产的方法见诸报道。微生物发酵转化法生产千层纸素A具有高效、清洁、环保的优势,且能最大限度保留其天然活性[18],更容易实现大规模生产。但对于以黄芩苷为底物通过微生物发酵转化合成千层纸素A的研究未见报道,仅Zhang等[19]报道了利用基因工程氧甲基化转移酶转化黄芩素生成千层纸素A,文献主要针对酶的反应位点特异性进行研究。课题组前期从中药黄芩植株根部筛选得到一株能够转化黄芩苷生成千层纸素A的内生青霉菌Penicilliumsp.R3[20],开发了一条千层纸素A微生物合成的新途径。在前期工作基础上,本研究明确了Penicilliumsp.R3生长的规律,对其转化黄芩苷生成千层纸素A的途径进行了初步探索和论证,同时采用单因素结合正交试验法优化了发酵转化的条件并提高了产量,为千层纸素A的微生物合成及开发利用奠定了基础。
1 材料和方法
1.1 材料
1.1.1 菌株来源
菌株Penicilliumsp.R3为野生黄芩新鲜植株根部内生青霉菌,由河北省中医药科学院浊毒证实验室分离、鉴定并保藏[20]。
1.1.2 培养基
菌种活化及发酵培养基均为马铃薯葡萄糖培养液(PDB),孢子制备培养基为马铃薯葡萄糖琼脂(PDA)斜面。发酵转化培养基为PDB培养液灭菌后加入一定比例底物。各培养基详细制备方法参考文献[21]。
1.1.3 仪器
LS-35HD型高压蒸汽灭菌器(江阴滨江医疗设备有限公司);XB.K.25型血球计数板(上海求精生化试剂仪器有限公司);DMBA300型生物数码显微镜(Motic实业集团中国有限公司);SPX-150型生化培养箱(北京市永光明医疗仪器有限公司);THZ-98AB型恒温振荡培养箱(上海一恒科学仪器有限公司);DHG-9053A型电热鼓风干燥箱(中仪国科北京科技有限公司);HP-01型无油真空泵(天津市恒奥科技发展有限公司);KH-300E型超声仪(昆山禾创超声仪器有限公司);1260型高效液相色谱仪(安捷伦公司,美国);ELGA超纯水仪(威立雅公司,英国);CP-214型电子分析天平(上海奥豪斯仪器有限公司)。
1.1.4 试剂
黄芩苷对照品(北京盛世康普化工技术研究院,批号151121,纯度≥99%);黄芩素、千层纸素A对照品(上海源叶生物科技有限公司,批号分别为C02A6Y1、Y29D6Y17716,纯度均≥98%);黄芩苷、黄芩素(上海源叶生物科技有限公司,批号分别为C22J7Y9309、C04D8Y49741,纯度均≥90%);色谱甲醇(Tedia公司,美国);超纯水(自制);其他试剂均为分析纯。
1.2 方法
1.2.1 孢子悬浮液的制备
菌种活化后划线至PDA斜面,28 ℃恒温培养,待斜面长满孢子后,取出1支,加入10 mL已灭菌的生理盐水,轻轻摇晃,充分冲洗孢子,然后在超净工作台中将冲洗液用无菌脱脂棉进行过滤,孢子滤液中加入无菌玻璃球,然后摇床震荡30 min使成团的孢子打散,制备好孢子悬浮液摇匀后用血球计数板置于显微镜下观察计数,计算孢子浓度[22],并按实验需要稀释成所需浓度进行接种。
1.2.2 菌体培养及生长曲线测定
取孢子悬浮液按5%比例接种至配制好的PDB培养液中,28 ℃,150 rpm培养,于培养0~10天每日取出,摇匀后取10 mL,过滤得到菌体,于80 ℃烘干至恒重,称重后计算菌体干重[22],绘制菌体生长曲线,每日3组平行。
1.2.3 高效液相色谱法(HPLC)分析转化产物
供试品溶液的制备[21]:发酵液超声10 min后摇匀,取0.5 mL,加甲醇8~9 mL,超声10 min后放至室温,继续精密加入甲醇至10 mL,0.22 μm微孔滤膜过滤得供试品溶液。以未接种孢子的培养液同法处理作为空白对照。
对照品溶液的制备:精密称取黄芩苷、黄芩素和千层纸素A对照品适量,加甲醇配成质量浓度分别为106.4、57.80、52.10 μg/mL的混合对照品溶液。
色谱条件[21]:色谱柱 Agilent ZORBAX Eclipse plus C18(4.6×250 mm,5 μm);紫外检测器(VWD);流动相为0.2 %冰醋酸甲醇溶液(A)-0.2 %冰醋酸水溶液(B)梯度洗脱(0~15 min:49%A;15~18 min:49%→61%A;18~36 min:61%A),柱温30 ℃,流速1.0 mL/min,检测波长275 nm,进样量10 μL。
1.2.4 标准曲线的绘制
精密称取“1.2.3”项下混合对照品溶液,加甲醇梯度稀释成6个不同浓度的对照品溶液,按“1.2.3”项下色谱条件进行测定,每浓度进样3次,以浓度及对应峰面积绘制标准曲线并得到线性回归方程。
1.2.5 各成分含量及转化率计算
各成分含量利用标准曲线所得线性回归方程进行计算,转化率采用产物与发生转化的底物的摩尔比进行计算,计算方法参考文献[21]。
1.2.6 转化途径分析
取Penicilliumsp.R3孢子悬浮液按5%比例接种至PDB培养液中,培养3天后各瓶分别加入0.1%黄芩苷、黄芩素和千层纸素A进行转化实验,每组2个平行,同时设置未接种瓶作为空白对照,转化6天后取出,按“1.2.3”项下方法制备供试品及空白溶液,取“1.2.3”项下对照品溶液稀释5倍作为对照品,按“1.2.3”项下条件进行HPLC检测,分析产物。
1.2.7 发酵条件单因素优化实验
底物黄芩苷加入时间:取相同浓度的Penicilliumsp.R3孢子悬浮液,按5%比例接种至PDB培养液中,28 ℃,150 rpm培养,分别在培养第0、1、2、3、4天时加入0.1%的黄芩苷继续培养至第7天,取出,按“1.2.3”项下方法制备供试品及空白溶液并测定黄芩苷及千层纸素A含量。
底物黄芩苷转化时长:取相同浓度的Penicilliumsp.R3孢子悬浮液,按5%比例接种至PDB培养液中,28 ℃,150 rpm培养3天后,加入0.1%的黄芩苷分别继续培养1~7天,每天取出,按“1.2.3”项下方法制备供试品及空白溶液并测定黄芩苷及千层纸素A含量。
底物黄芩苷添加比例:取相同浓度的Penicilliumsp.R3孢子悬浮液,按5%比例接种至PDB培养液中,28 ℃,150 rpm培养3天后分别按0.02%、0.04%、0.06%、0.08%、0.10%、0.12%、0.14%的比例加入黄芩苷继续培养6天,取出,按“1.2.3”项下方法制备供试品及空白溶液并测定黄芩苷及千层纸素A含量。
1.2.8 发酵条件正交优化实验
以单因素试验优化条件为基础,选取装液量(A)、转速(B)、温度(C)、接种量(D)为考察因素,分别以转化后培养液中千层纸素A的转化率及产量为考察指标,按表1进行四因素三水平正交试验L9(34),具体发酵转化条件为取250 mL锥形瓶为发酵容器,在相应条件下接种培养3天,然后按0.08%比例加入黄芩苷并进行6天的转化实验,发酵完成后取样,按“1.2.3”项下方法制备供试品及空白溶液并测定黄芩苷及千层纸素A含量。
1.2.9 优化条件验证
按照单因素及正交实验优化的发酵条件进行3次重复验证试验,计算转化率、产量及相应的RSD值,分析稳定性及可行性。
2 实验结果
2.1 菌株生长曲线
培养液接种孢子后于28 ℃,150 rpm培养,发酵菌液生长良好,由乳白色逐渐变为墨绿色,细屑状。
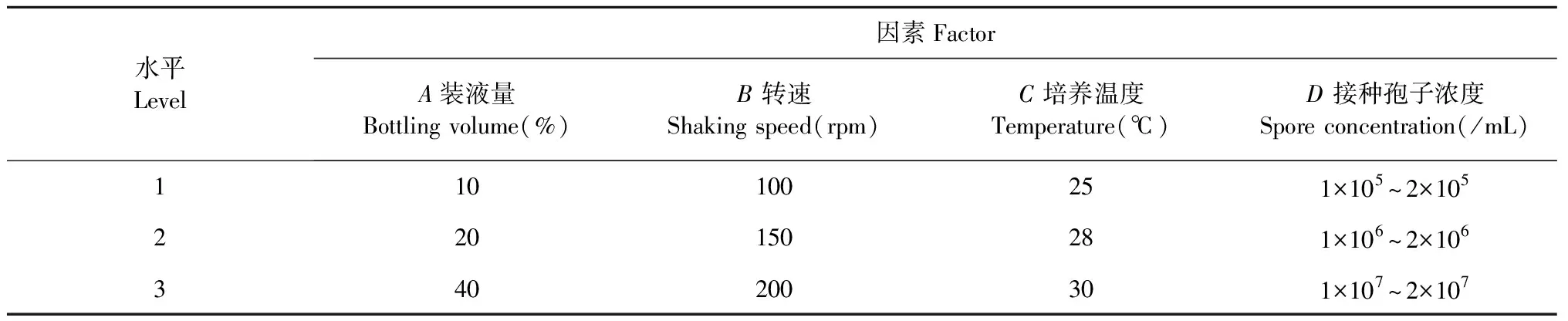
表1 正交因素水平L9(34)表Table 1 L9(34)orthogonal test factors and levels
由菌体生长曲线(图1)可看出,菌体在0~1天处于停滞期,1~4天处于对数生长期,4天之后进入稳定期,之后生物量变化不大。由于以菌体干重为标准绘制生长曲线,因此不能很好反映菌体的衰落期。但是本曲线基本符合一般微生物生长规律,正确的反映出Penicilliumsp.R3的生长情况,明确了其快速生长期,且可看出菌株生长迅速,前期生物量的迅速积累,有利于底物的转化。菌株的生物量在第5天和第7天略有下降,在生长稳定期,菌体处于死亡和新生的一个平衡阶段,大致处于总生物量稳定状态,但出现波动是难免的。
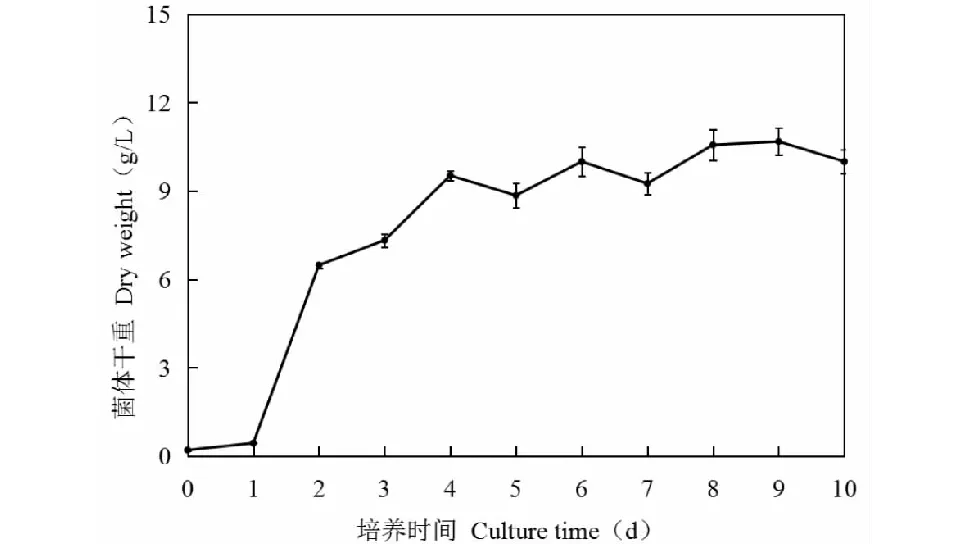
图1 菌株Penicillium sp.R3生长曲线Fig.1 Growth curve of Penicillium sp.R3
2.2 标准曲线
按“1.2.3”测定并绘制黄芩苷、千层纸素A标准曲线(图2),得到两种物质峰面积对应浓度的线性回归方程,黄芩苷(Y=31.666X+5.524;R2=0.995 0),千层纸素A(Y=58.222X+13.485;R2=0.998 2)。黄芩苷、千层纸素A分别在0.020~0.638、0.010~0.313 μg范围内线性关系良好,可用于发酵液中相应物质含量的计算。
2.3 转化途径分析
由HPLC谱图(图3)可看出,经6天转化反应后,菌株转化黄芩苷得到黄芩素和千层纸素A两种产物(图B),转化黄芩素得到产物千层纸素A(图C),但千层纸素A未发生转化(图D),相应空白均未发生转化(图b、c、d),由此可证明黄芩苷在转化过程中得到的两种产物是具有相关性的,并非分别独立转化,这也与我们之前文章中提出的黄芩素可能为中间产物的设想相一致[20]。菌体先转化黄芩苷生成黄芩素,再进一步转化黄芩素为千层纸素A,黄芩素为中间产物,转化途径见图4,但详尽转化途径和机制还需进一步深入研究。由此,明确黄芩苷经内生菌Penicilliumsp.R3转化终产物为千层纸素A,后续将以千层纸素A为指标进行优化条件研究。
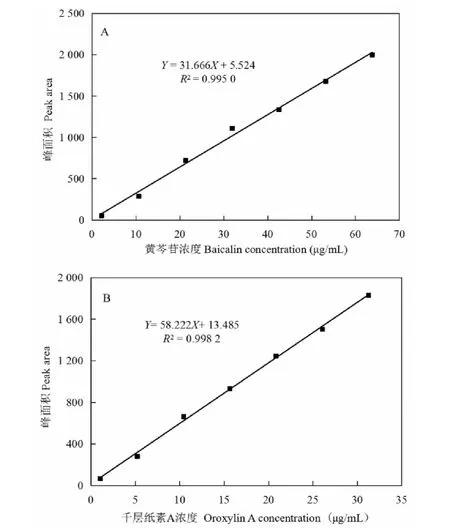
图2 黄芩苷(A)和千层纸素A(B)标准曲线Fig.2 Calibration curve of baicalin(A)and oroxylin A(B)
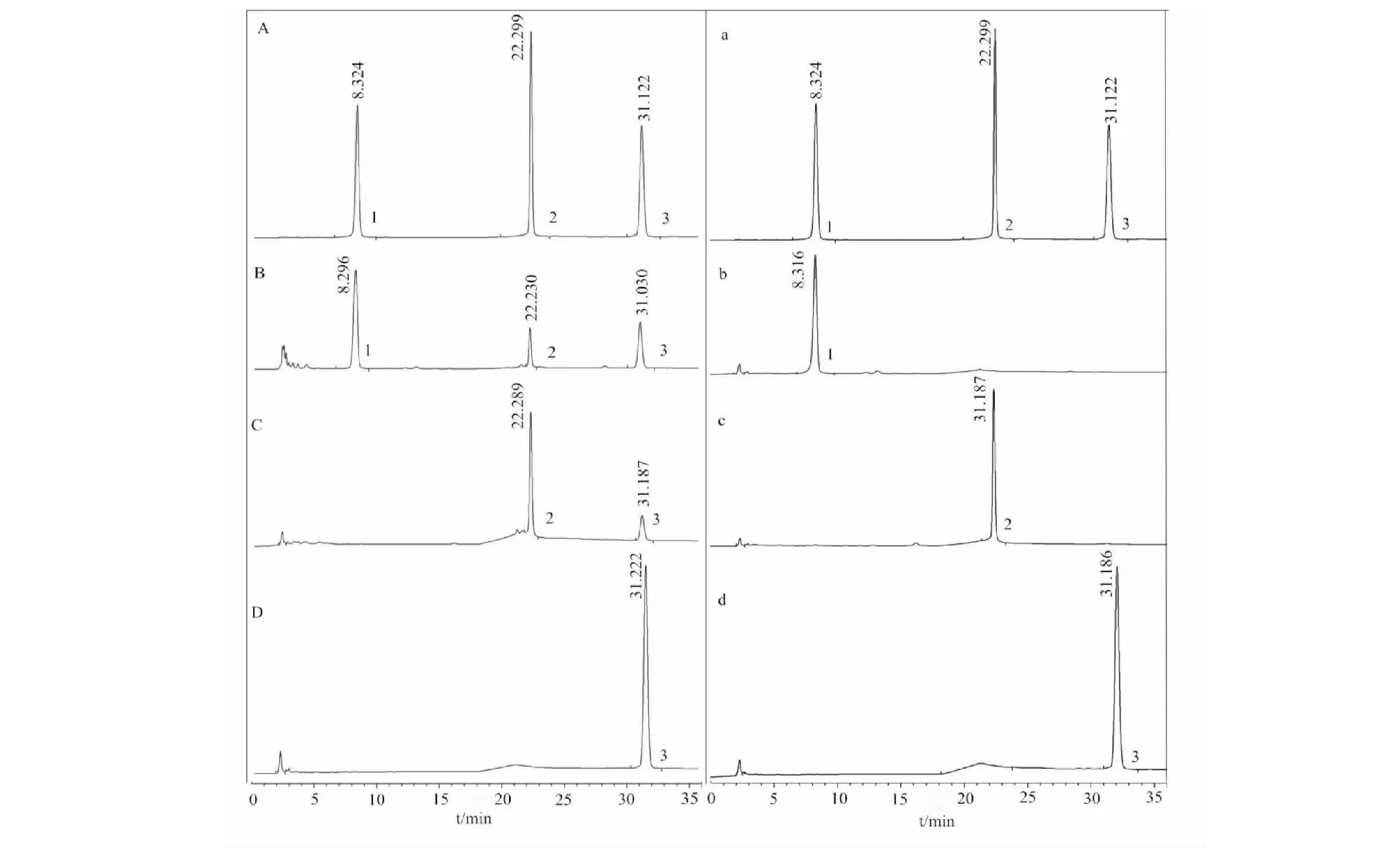
图3 对照品、转化样品及空白的HPLC色谱图Fig.3 HPLC chromatograms of standard substances,biotransformation samples and blanks注:1.黄芩苷;2.黄芩素;3.千层纸素A。A.对照品;B.黄芩苷转化样品;C.黄芩素转化样品;D.千层纸素A转化样品。a.对照品;b.黄芩苷转化空白;c.黄芩素转化空白;d.千层纸素A转化空白。Note:1.Baicalin;2.Baicalein;3.Oroxylin A.A.Standard substances;B.Baicalin biotransformation sample;C.Baicalein biotransformation sample;D.Oroxylin A biotransformation sample.a.Standard substances;b.Baicalin biotransformation blank;c.Baicalein biotransformation blank;d.Oroxylin A biotransformation blank.
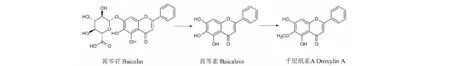
图4 菌株发酵转化黄芩苷的生物转化途径Fig.4 Biotransformation pathway of bacalin by Penicillium sp.R3
2.4 发酵条件单因素优化实验
2.4.1 底物黄芩苷加入时间
由图5可见于培养0~1天加入黄芩苷,底物消耗多,千层纸素A的产量及转化率却不高,第2天之后加入黄芩苷,消耗率较之前降低,转化率及产量却有所提高,第3天加入黄芩苷,千层纸素A的转化率及产量均为最高。结合菌体生长曲线(图1)可知,0~1天菌体正处于吸收累积营养为快速生长做准备阶段,此时加入黄芩苷,菌体可能将部分黄芩苷用于生长,进而导致消耗多产出少。第3天快速生长阶段基本完成,此时加入的黄芩苷极少用于生长,转化率及产量均提高且达到最高值。因此选取培养第3天为底物的最佳添加时间。
2.4.2 底物黄芩苷转化时长
由图6的转化率曲线可看出,从第2天开始,转化率变化幅度很小,随着黄芩苷的消耗产物逐渐积累至底物基本消耗完成,转化6天后,千层纸素A产量达到峰值,黄芩苷消耗殆尽,之后千层纸素A质量浓度略有下降,可能是菌体进入生长衰退期引起的,具体原因还有待于进一步分析,但由此可看出转化时间过长并不利产物累积,因此选取6天为添加底物后最佳转化时长。
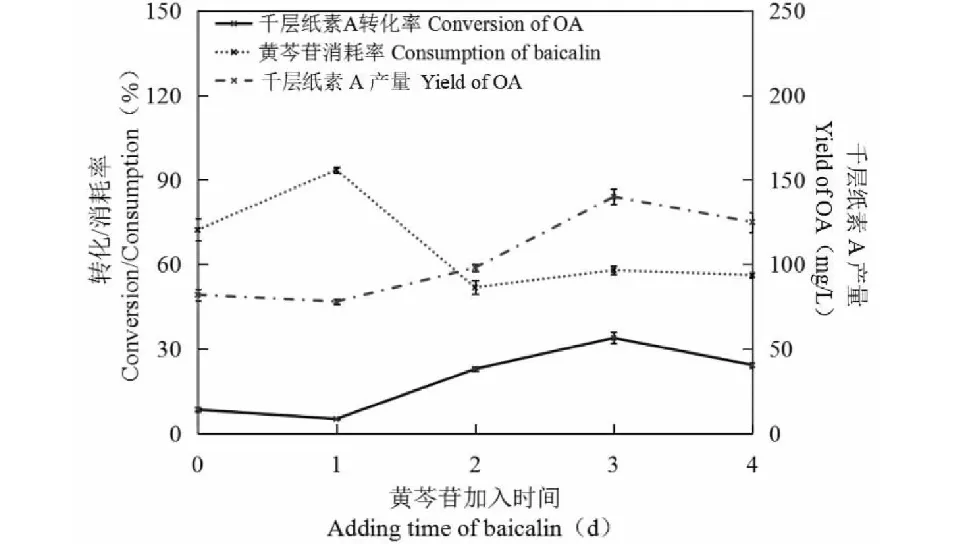
图5 接种后加入黄芩苷的最适时间Fig.5 Optimal adding time of substrate after inoculation
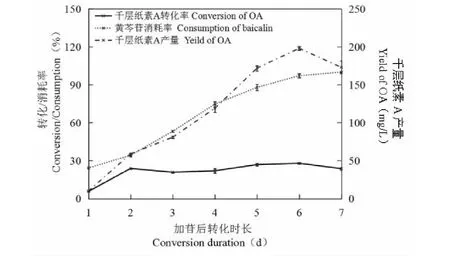
图6 底物发酵转化最适时长Fig.6 Optimal transformation time of the substrate
2.4.3 底物黄芩苷添加比例
由图7可看出,随着黄芩苷添加量的增加,其消耗率逐渐下降,在菌体转化率变化不大的状态下,底物黄芩苷在一定时间内的消耗量也是稳定的,因此添加量越多消耗率越低,比例低于0.06%时黄芩苷可100%消耗,但耗尽后菌体尚有转化能力底物却不足,黄芩苷添加比例高于0.06%时,底物充足,可使菌体转化能力得到最大利用,当黄芩苷添加量为0.08%时,转化率最高同时千层纸素A产量与峰值接近,黄芩苷的利用率达到80%。综合各因素,选取黄芩苷添加比例为培养液的0.08%。
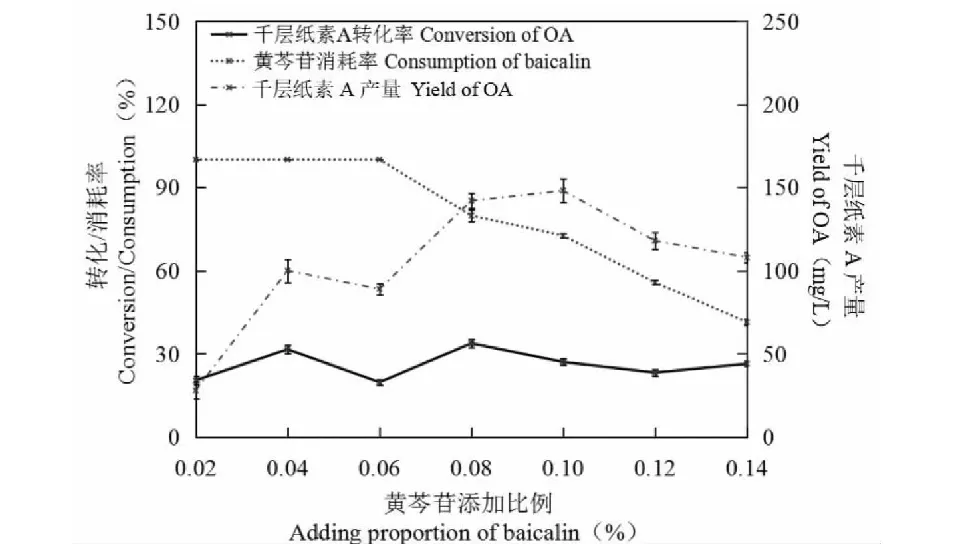
图7 底物的最适添加比例Fig.7 Optimal additive proportion of the substrate
2.5 发酵条件正交优化实验
单因素优化实验结果为接种培养3天后按0.08%比例加入黄芩苷,继续转化6天结束培养。以此为基础按“1.2.8”方法进行正交实验优化,实验结果及方差分析见下表2和3,以千层纸素A转化率和产量为考察指标的正交试验中(表2),各因素对两个指标影响的大小顺序相同,均为A(装液量)>B(转速)>C(培养温度)>D(接种孢子浓度),针对转化率最优转化条件为A1B3C1D2,即装液量10%,转速200 rpm,培养温度25 ℃,接种孢子浓度1×106~2×106个/mL。针对产量最优转化条件为A1B2C3D2,即装液量10%,转速150 rpm,培养温度30 ℃,接种孢子浓度1×106~2×106个/mL。
以极差最小的D因素作为误差项进行方差分析[23],结果(表3)表明,4个因素中,装液量对转化率和产量均有显著影响(P<0.05),而其他因素并未表现出显著影响,在以产量为考察指标的正交实验中,转速的显著性P值介于0.05和0.10之间,比其他指标影响略大一些。两指标综合结果可看出,装液量是主要影响因素,其次是转速,而接种量和温度影响并不大。
两个考察指标的最优条件中装液量均为10%,接种量均为1×106~2×106个/mL,具有一致性,差别在于温度及转速。考虑到在产量为指标的正交试验中,转速的影响也较明显,因此转速采用150 rpm,在温度控制方面,30 ℃比25 ℃在实际培养及后期放大培养中更容易稳定控制,25 ℃需要低于20 ℃的环境温度或有制冷功能的培养设备中才能良好保持,不利于环保节能及后期扩大培养,因此采用30 ℃为培养温度。经过正交试验优化最终确定的培养条件为装液量10%,转速150 rpm,培养温度30 ℃,接种孢子浓度1×106~2×106个/mL。
2.6 优化条件验证试验
按照单因素及正交实验优化的发酵条件进行3次重复验证试验,结果见表4,转化率及产量稳定性较好,3次验证试验转化率的RSD=4.0%(n=3),产量的RSD=4.5%(n=3),该转化条件是可行的。
3 结论
菌株Penicilliumsp.R3生长速度快,4天内即达到最大生物量,有利于缩短培养周期,节约能源,提高产品生产效率,是一株优良的生产菌株。
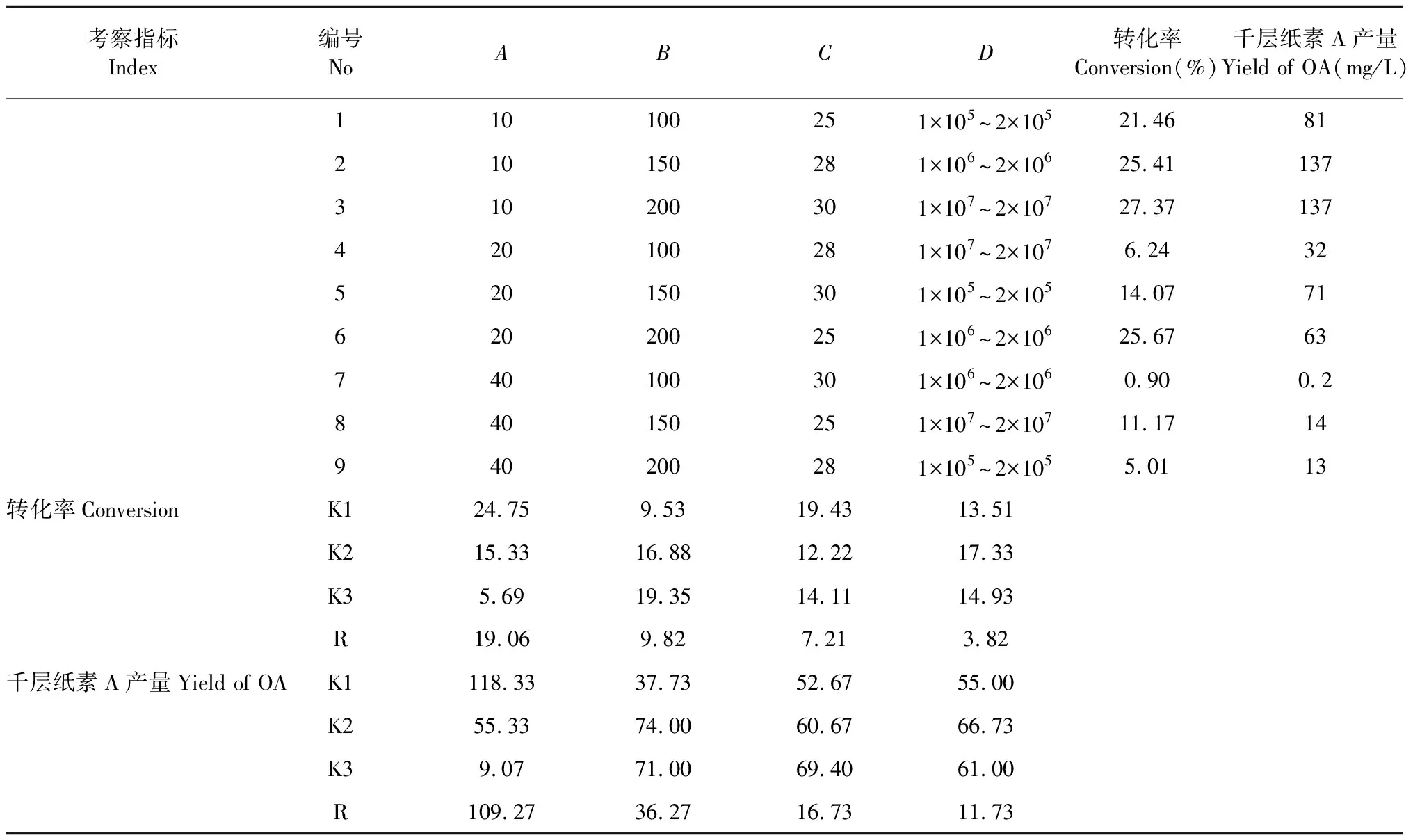
表2 黄芩苷发酵转化条件正交试验结果Table 2 Orthogonal test design and result of fermentation process of baicalin
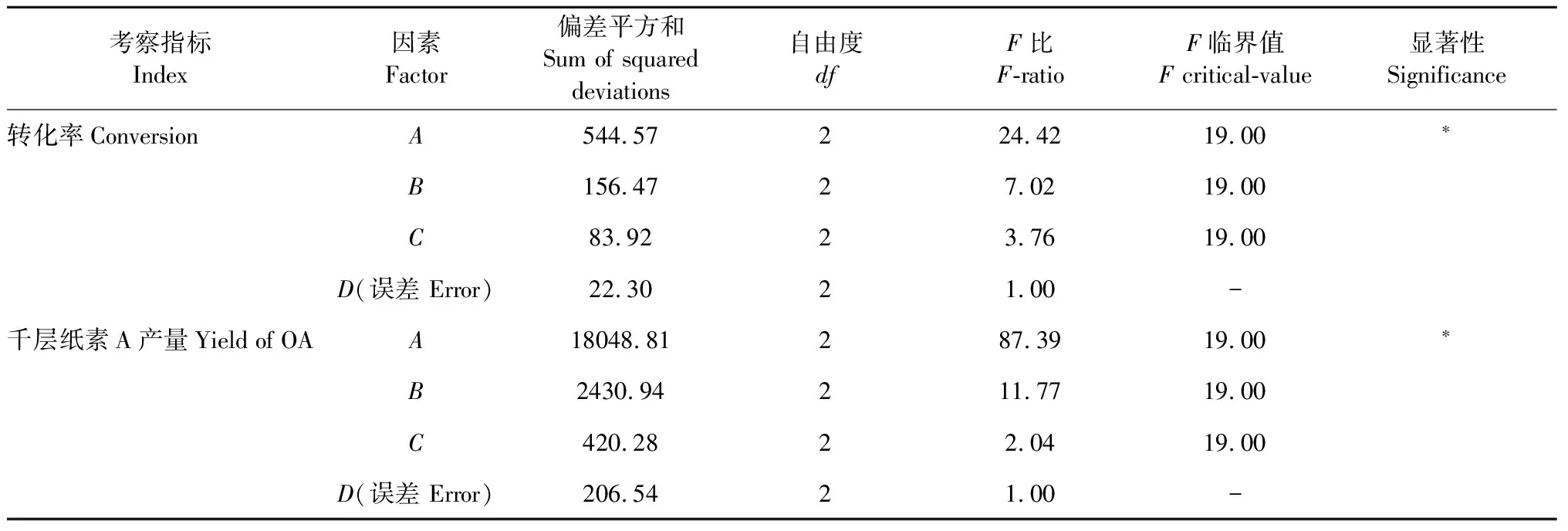
表3 正交试验方差分析Table 3 Variance analysis of orthogonal test
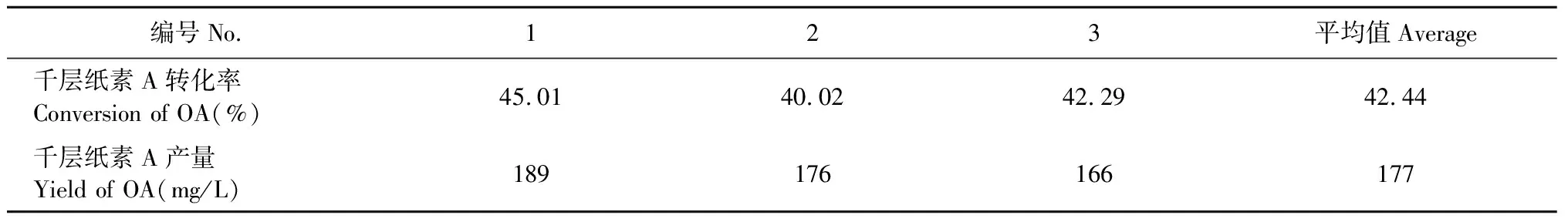
表4 Penicillium sp.R3转化黄芩苷生成千层纸素A最优条件验证Table 4 Verify results of biotrasformation process from bacalin to oroxylin A by Penicillium sp.R3
在大量优化实验过程中我们发现产物黄芩素的产量变化不大,但千层纸素A的产量随实验条件呈现明显波动,于是推测黄芩素可能为中间产物,经过研究初步验证了此设想。黄芩素与千层纸素A仅6号位取代基不同,分别为羟基和甲氧基,推测菌株Penicilliumsp.R3极可能同时产生葡萄糖苷酶和甲基转移酶两种酶,先利用葡萄糖苷酶将黄芩苷糖苷键断开生成黄芩素,进而利用甲基转移酶将黄芩素6号位甲基化生成千层纸素A,且该甲基转移酶很可能是能够特异性催化黄酮6位羟基甲基化的甲基转移酶[19],此推测还需后续研究验证。
考虑到多数菌株的高产酶阶段处于生长平稳期,我们采用了先培养后添加底物的发酵模式,并优化了底物添加的时间节点及添加量,在生物量快速积累基本完成的第3天加入黄芩苷,转化率和产量明显高于0~2天时加入。过早加入黄芩苷会因为黄芩苷部分用于菌体生长且转化酶浓度低降低转化率及产量。
正交试验采用了千层纸素A转化率和产量两个指标相结合进行优化。理论上转化率和产量应为正相关,而在实际的培养转化过程中我们发现这两者呈现出了部分的不一致性,可能原因是在转化反应中消耗的黄芩苷并没有100%转化为产物,有一部分用于菌体生长,有一部分转化为中间产物黄芩素,而转化率是以产物千层纸素A的摩尔量与消耗底物黄芩苷的摩尔量之比进行计算,存在发酵液中千层纸素A产量高,但同时黄芩苷消耗也高,致使转化率并不高的情况,反之亦然。两个指标结合可尽量避免这一影响,得到最优化条件。
利用微生物转化黄芩苷合成千层纸素A尚未见报道,本研究以黄芩苷为底物通过微生物发酵转化得到千层纸素A,最优条件下的转化率达到42.44%。有文献报道以黄芩苷或黄芩素为起始物用化学法合成千层纸素A,总收率分别为56%和30%[16,17],方法中均用到大量有机试剂,不利于清洁环保。Zhang等[19]报道了利用来自苔藓的基因工程氧甲基化转移酶转化黄芩素生成千层纸素A,实验室条件下孵化1 h转化率可达75%,酶催化下的生物转化反应,足够的酶量和转化时间可使底物达到100%转化,这与活体转化是不同的。同时基因工程酶的获取需要经过复杂的基因扩增、转化、产物表达、酶的分离纯化等步骤,成本较高。本实验采用的微生物转化法具有成本低廉、转化效率较高,培养简单的优势,具有进一步的研究应用价值。
在分析了菌体的生长规律,初步明确的产物的转化途径并优化了菌体发酵转化条件之后,我们将对转化机制进行进一步探索,包括菌体产生的与转化相关的酶的种类、功效及活性。还将扩大发酵转化规模,对产物进行提取分离,得到纯度较高的产品进行下一步应用研究。
