miR-200b靶向调控性别决定相关基因簇2对绒毛外滋养层细胞侵袭和迁移能力的影响
2020-11-27余丽金
余丽金,许 艳, 凌 奕
0 引 言
胎盘是维系母体与胎儿之间物质运输与气体交换的重要器官,受到细胞因子、激素和生长因子等多种因素的调控[1]。子痫前期属于胎盘源性疾病,是导致孕产妇和新生儿发病或死亡的重要病因,但子痫前期的发病机制目前尚不清楚。研究发现,滋养层细胞在胎盘和胎儿生长发育中起到重要作用[2]。此外,滋养层细胞增殖和侵袭功能异常能引起子痫前期的发生。因此近年来关于滋养层细胞在妊娠过程中的作用备受关注。微小RNA(micro RNA,miR)是生物内序列高度保守的非编码RNA分子。近年研究表明,miRNA及其相关信号通路在调控滋养层细胞迁移、浸润等过程中发挥重要作用[3]。最新研究表明,miR-200b在子痫前期胚胎绒毛外滋养细胞中表达异常[4]。另有报道称miR-200b能影响胚胎应激状态下的绒毛外血管网的构建[5]。性别决定相关基因簇2(sex determining region Y,SOX2)是SOX家族中的重要成员之一[6]。研究显示,SOX2与多种肿瘤的增殖和迁移密切相关,如在乳腺癌、结肠癌、胃癌等中高表达,发挥促癌作用[7]。近来有研究发现,SOX2在细胞滋养层、绒毛外滋养层细胞中均有表达,随着妊娠的进行,在晚期妊娠胎盘中表达逐渐下降[8]。据报道,在胶质瘤中SOX2表达受miR-200b的调控作用[9],但目前这种调控关系是否通过调节滋养层细胞的侵袭和迁移来影响子痫前期的机制报道较少。因此,本研究拟通过对人滋养层细胞进行研究,探讨miR-200b、SOX2对人滋养层细胞迁移和侵袭作用的影响。
1 资料与方法
1.1 研究对象选取2017年12月至2019年1月海南现代妇女儿童医院妇产科留取的40份胎盘组织标本。其中子痫前期患者18例,正常妊娠者22例。子痫前期患者年龄22~35岁,平均年龄(28.32±4.23)岁;正常妊娠者年龄21~33岁,平均年龄(27.43±4.23)岁。正常妊娠者的纳入标准为:①既往体健;②孕37周后分挽;③孕期顺利,血压正常、尿蛋白为阴性;④无妊娠合并症及并发症的发生。子痫前期患者纳入标准:妊娠周后发生的高血压,并合并蛋白尿者。排除标准:有慢性高血压、糖尿病、慢性肾病以及心脏病等病史。本研究已获得医院伦理委员会批准(批件号:A2017-008-02),研究对象均签署了知情同意书。
1.2材料及主要仪器慢病毒包装的miRNA-200b、SOX2过表达慢病毒质粒pHRi-miRNA-200b、pHRi-SOX2和短发夹RNA (short hairpin RNA,shRNA)、慢病毒表达质粒pHRi-sh-SOX2、miRNA-200b模拟物(miRNA-200b minic)及其阴性对照(minic-NC)均购自上海吉玛有限公司,人绒毛外滋养层细胞系HTR8-SVneo购自美国模式培养物保藏所,DAB试剂盒(美国Amresco公司), Western blot试剂盒(Santa Cruz公司), DMEM培养基、胎牛血清(fetal bovine serum,FBS)、胰蛋白酶、RPMI1640培养基均购自美国Gibco公司,荧光素酶基因报告分析试剂盒(美国Abcam公司)、Lipofectamine-3000转染试剂(美国Invitrogen公司)、全蛋白抽提试剂盒(德国QIAGEN公司),SYBR Green 荧光定量PCR 检测试剂盒(QPK-201,日本TOYOBO公司);Transwell小室(美国BD公司),MTT试剂盒(美国CST公司),microRNA Isolation Kit试剂盒(美国Sigma公司)。
Nikon Ti-U/Ti-s倒置显微镜(Thermofisher公司),E-Gel Imager凝胶成像仪(美国Beckma公司),生物显微镜(德国徕卡公司),Multiskan MK3酶标仪(美国Fermentas公司),Roche R480实时荧光定量PCR仪(Heal Force公司),SANYO MCO-15AC细胞培养箱(美国BD公司),苏净Airtech超净工作台(SANYO公司),5810R 型高速离心机(日本岛津公司)。
1.3免疫组织化学检测胎盘组织标本中SOX2的表达将收集的正常胎盘组织及子痫前期胎盘组织样本固定包埋并切片,用二甲苯和梯度乙醇脱蜡后,柠檬酸盐缓冲液中修复,3%的双氧水室温下浸泡10 min,封闭,加入稀释好的一抗维持4 ℃过夜孵育,次日冲洗干净,分别加入二抗,室温孵育30 min,清洗。加适量二氨基联苯胺(DAB)作用2~5 min后用去离子水终止反应,苏木精复染,乙醇梯度脱水,二甲苯浸泡并干燥后用中性树胶封片,镜检观察并记录实验结果。
结果判定标准:由两位副主任病理医师对病理切片进行盲评,综合评分。每张切片中随机选取5个清晰高倍视野,包含标本中的绝大部分组织,以每个视野随机计数200个细胞为单位,以细胞出现黄色或棕黄色颗粒判为阳性表达,根据染色强度及阳性细胞率综合评分。染色强度计分依据:无着色计0分,淡黄色计分,棕黄色计2分,棕褐色计3分。阳性细胞数计分:无阳性细胞为0分,< 25%为1分,25%~50% 为2 分,51%~75% 为3分,> 75% 为4分。以上2项计分相加结果≥3判为阳性。
1.4高通量测序筛选差异miRNA并绘制聚类图在正常妊娠者与子痫前期患者组织标本中分别随机抽取3例进行高通量测序,使用microRNA Isolation Kit试剂盒提取并纯化标本中小RNA备用,操作严格遵照试剂盒内说明书进行。构建正常胎盘组织和子痫前期胎盘组织的miRN文库,采用llumina HiSeq2000高通量测序平台进行二代测序,FsatQC检测筛选高质量整洁序列。保留2个样本中Reads之和≥10、|log2FC |>1及P<0.05的基因;再采用MEV( V4.6,Tiger) 对筛选出的miRNA 进行聚类分析。根据P值筛选出在不同组织中表达差异最大的40个miRNA。
1.5RT-qPCR检测分析miRNA的表达采用Trizol法提取不同组织标本的总RNA,常规方法检测RNA的浓度和纯度,取出25%的总RNA进行反转录成cDNA,试验操作严格按照PrimeScrip反转录试剂盒要求进行,使用引物如下:microRNA-200b(FP:5′-GGCTGAGGGTTAGTGAGC AG-3′,RP: 5′-AAAGGGAGTTGGTGAAAGACA-3′),U6作为内参(FP: 5′-TCGACGAATTG CAGTACU-3′,RP:5’-GCAACGCAUCTTTCTATUC-3′),反应条件:75°C预变性,2min,进入以下循环90℃变性,5min;60°C退火,60s; 72°C延伸,30s;共40个循环。相对表达量用2-ΔΔCT表示。每个样本独立重复实验3 次。
1.6生物信息学预测使用生物信息学网站starBase预测SOX2可互补结合的miRNA,并在http://genemania.org上查询了SOX2与基质金属蛋白酶2(matrix metalloproteinase 2, MMP2)和基质金属蛋白酶2(matrix metalloproteinase 2, MMP9)的相互作用关系。
1.7荧光素酶基因报告分析采用miRNA靶基因数据库Target Scan预测miR-200b和SOX2的结合片段。采用PCR扩增含有miR-200b结合位点的SOX2片段,并将该扩增片段插入荧光素酶载体psi-CHECK中,构建野生型质粒并记为psi-CHECK-SOX2-wild,同时采用基因突变技术对结合片段中的核苷酸进行突变,并构建突变型质粒psi-CHECK-SOX2-mutant。将miR-200b minic及阴性对照minic-NC分别与空载质粒、野生型质粒psi-CHECK-SOX2-wild和突变型质粒psi-CHECK-SOX2-mutant共转染至HEK293T 细胞。转染后24h,根据双荧光素酶检测试剂盒说明书测定荧光素酶活性,萤火虫荧光素酶/海肾荧光素酶活性值即为报告基因活性。
1.8细胞培养、转染和实验分组将HTR8-SVneo细胞接种于含有灭活的10%FBS、peillin G、STC的DMEM培养基中,生化培养箱中培养(培养条件:37 ℃,5%CO2),当有85%细胞贴壁生长时,胰蛋白酶进行消化传代。取对数生长期细胞进行转染,采用Lipofectamine 3000通过脂质体介导法转染慢病毒,转染按Lipofectamine 3000试剂说明书操作。分组方法:空载组(转染慢病毒质粒空载)、miRNA-200b组(转染pHRi-miRNA-200b)、sh-SOX2组(转染pHRi-sh-SOX2)、miRNA-200b+SOX2组(共转染pHRi-miRNA-200b、pHRi-SOX2质粒)。
1.9Transwell实验检测细胞侵袭实验前12 h更换为无血清培养基,将40 μL matrigel基质胶铺于Transwell小室中,消化细胞并用1 μL PBS清洗2遍,将500 μL 完全培养基加入24 孔板,细胞计数,取5×105细胞重悬,向Transwell小室中加200~250 μL 细胞悬液,保证下层完全培养基与Transwell小室间无气泡。置于培养箱内正常培养 24 h,加用甲醇配制、PBS 稀释的0.1%结晶紫染液500 μL进行染色,室温避光15 min,PBS 漂洗后用棉棒擦Transwell小室内部,倒置晾干,置于倒置荧光显微镜下观察显穿过膜的细胞并拍照计数。
1.10划痕实验检测细胞迁移能力细胞转染12 h后调整细胞密度,以5×105个/孔的密度接种于6孔板中,当细胞汇合率达到 90% 以上时,采用200 μL枪头在板中间划线,PBS清洗3次后加入无血清培养基继续培养,在普通显微镜下观察并拍摄细胞在0和24 h迁移情况的照片,对照片进行分析并计算迁移率。
1.11Western blot检测SOX2、MMP2与MMP9蛋白的表达水平收集各组细胞,采用常规方法提取目标蛋白SOX2、MMP2与MMP9,经BCA试剂盒测定蛋白浓度后,准确量取50 μg,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,结束后,将样品蛋白经湿转法转至PVDF转膜上,加入10%脱脂奶粉封闭3 h,以(1∶1500)比例稀释后,维持4 ℃过夜孵育,洗涤加入辣根过氧化物酶标记的二抗孵育3 h, 增强化学发光ELC显色30 min,经曝光、显影、定影后,以GAPDH为内参来表示蛋白的表达水平。
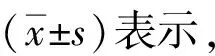
2 结 果
2.1 SOX2在不同组织中的表达SOX2主要在滋养层细胞中表达,细胞质内可见棕黄色、深棕色颗粒。正常胎盘组织中SOX2免疫组化评分明显低于子痫前期胎盘组织[(3.2±0.4)分vs(8.4±1.2)分,P<0.05],见图1。

a:子痫前期;b:正常胎盘组织
2.2生物信息学预测调控SOX2的基因经网站预测分析显示,miRNA-429、miRNA-200b、miRNA-200c与SOX2存在靶向结合位点。
2.3聚类分析不同组织中差异表达的miRNA分别筛选出20个差异最大的上调(hsa-miR-302b、hsa-miR-338-5p、hsa-miR-1909、hsa-miR-19b-1、hsa-miR-33b、hsa-miR-518e、hsa-miR-376a、hsa-miR-574-5p、hsa-miR-22、hsa-miR-29a、hsa-miR-1274b、hsa-miR-625、hsa-miR-658、hsa-miR-1206、hsa-miR-125a-3p、hsa-miR-199b-5p、hsa-miR-138-2、hsa-miR-617、hsa-miR-105、hsa-miR-1234)和下调(hsa-miR-449b、hsa-miR-1248、hsa-miR-1260、hsa-miR-1266b、hsa-miR-720、hsa-miR-221、hsa-miR-136、hsa-miR-200b、hsa-miR-936、hsa-miR-892a、hsa-miR-570、hsa-miR-1251、hsa-miR-101、hsa-miR-589、hsa-miR-143、hsa-miR-603、hsa-miR-1539、hsa-miR-1825、hsa-miR-585、hsa-miR-208b)的 miRNA。
2.4RT-qPCR检测分析miRNA-200b在不同胎盘组织中的表达生物信息学预测miRNA-200b对SOX2具有调控作用,且高通量测序聚类分析结果中miRNA-200b在不同组织中存在差异,所以本研究选取miRNA-200b进行进一步的研究。RT-qPCR检测结果显示,与正常胎盘组织miRNA-200b表达量(1.02±0.08)比较,子痫前期胎盘组织(0.25±0.05)明显降低(P<0.05)。
2.5双荧光素酶基因报告分析实验验证miRNA-200b与SOX2的关系双荧光素酶报告基因结果显示,miRNA-200b明显抑制野生型SOX2的荧光素酶活性(P<0.05),说明miRNA-200b与SOX2具有靶向调控关系。见图2。

与minic-NC比较,*P<0.05
2.6miRNA-200b与SOX2对HTR8-SVneo细胞侵袭能力的影响Transwell实验结果显示,与空载组侵袭细胞数量相比, miRNA-200b组和sh-SOX2组明显下降(P<0.05);与miRNA-200b组侵袭细胞数量相比,miRNA-200b+SOX2组明显增多(P<0.05)。见图3、图4。
2.7miR-200b与SOX2对HTR8-SVneo细胞迁移能力的影响miRNA-200b组、sh-SOX2组细胞迁移率较空载组明显下降(P<0.05);与miRNA-200b组细胞迁移率比较,miRNA-200b+SOX2组明显增多(P<0.05)。见图5、图6。
2.8Western blot检测SOX2、MMP2和MMP9蛋白的表达水平SOX2与MMP2、MMP9蛋白存在相互作用关系。见图7。 miRNA-200b组、sh-SOX2组中SOX2、MMP2和MMP9蛋白表达较空载组明显下降(P<0.05);miRNA-200b+SOX2组SOX2、MMP2和MMP9蛋白表达较miRNA-200b组明显升高(P<0.05)。见图8、表1。
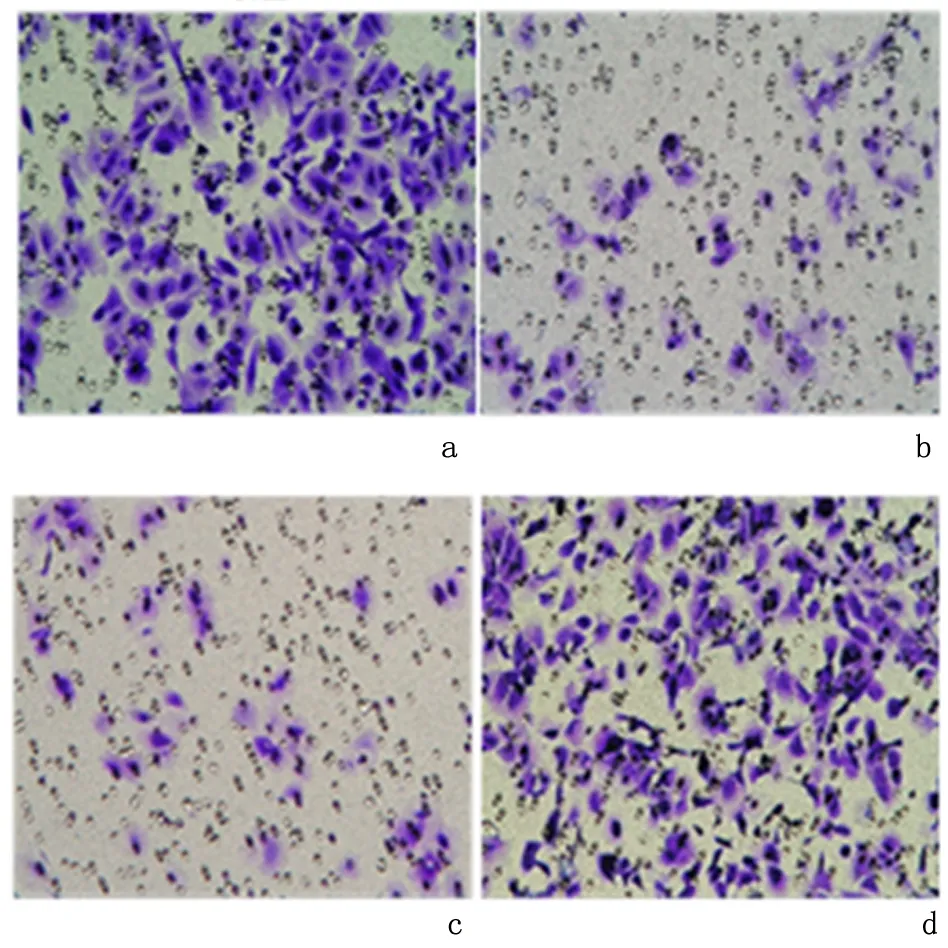
a:空载组; b:miRNA-200b组; c:sh-SOX2组; d:miRNA-200b+SOX2组

与空载组比较,*P<0.05;与miRNA-200b组比较,#P<0.05

图示miRNA-200b+SOX2组细胞迁移率较miRNA-200b组明显增多

与空载组比较,*P<0.05;与miRNA-200b组比较,#P<0.05
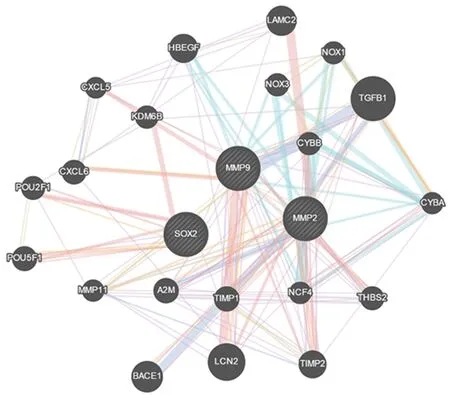
图 7 生物信息预测SOX2与MMP2 、MMP9的关系

1:空载组; 2:miRNA-200b组; 3:sh-SOX2组; 4:miRNA-200b+SOX2组

表 1 不同组别SOX2、MMP2和MMP9蛋白相对表达量的比较
3 讨 论
胎盘发育过程中,滋养层细胞具有气体交换、供应营养、代谢废物、血管重建等多种功能,细胞合体和浸润迁徙是滋养层细胞分化的重要路径[10]。子痫前期的发生不仅直接导致母体多种系统的损伤,增加母体呼吸窘迫、产后初血以及肾功能衰竭和羊水栓塞等并发症的风险,并且增加胎儿生长受限、早产的发生概率[11]。子痫前期的发生与滋养层细胞出现增殖和侵袭功能缺陷密切相关[10]。因此明确滋养层细胞的侵袭功能的具体调节机制在临床上具有重要意义。
SOX2基因定位于3号染色体长臂3.3-27结构域内,含有317个氨基酸,由于糖基化修饰,相对分子量为46×103[12]。SOX2作为一种转录因子,参与细胞的增殖、分化、转移及信号转导等多种生物学行为,在早期胚胎发育、器官生成、维持机体组织稳态和再生以及肿瘤的发生等生理过程中发挥重要的作用[13]。研究发现,SOX2在快速增殖以发生迁移期的细胞中高表达,例如SOX2在上皮闭合过程中高表达,促进外胚层上皮细胞迁移,从而修复早期上皮缺陷[14]。在表皮损伤后向伤口迁移的角质细胞中也发现了SOX2的mRNA水平明显升高[15]。由于SOX2对细胞增具有促进作用并可抑制细胞凋亡,所以在多种肿瘤组织中SOX2均呈高表达[16]。据报道,SOX2表达水平随着胚胎发育逐渐升高,在滋养外胚层中达到峰值,是胚胎发育过程中关键分子[17]。SOX2通过刺激滋养层细胞的增殖促进囊胚腔的形成,进而加速胚胎发育[18]。本研究中免疫组化结果显示,子痫前期胎盘中SOX2表达水平明显高于正常胎盘。说明过表达的SOX2可能促进了滋养层细胞的侵袭和迁移从而导致子痫前期的发生。为了证实SOX2对滋养层细胞的侵袭和迁移能力,本研究以HTR8-SVneo作为研究细胞模型构建了SOX2沉默细胞株,结果显示,与NC相比,沉默SOX2后细胞的侵袭和迁移能力明显减弱,说明SOX2是影响滋养层细胞运动功能关键蛋白之一。
研究表明,miRNA是内源性单链非编码小分子RNA,而多种疾病相关蛋白的表达受到miRNA的调控作用,影响疾病的发生及发展过程[19]。本研究中通过检索targetscan发现miR-429、miR-200b、miR-200c与SOX2存在靶向结合位点,采用高通量测序分析不同胎盘组织中差异表达的miRNA发现miR-200b为明显下调基因。RT-qPCR检测结果显示,与正常胎盘组织相比,miR-200b在子痫前期胎盘组织中的相对表达量明显降低。进一步采用双荧光素酶报告基因验证 miRNA-200b与SOX2具有靶向调控关系。研究表明miR200b影响如乳腺癌、甲状腺癌、胃癌等多种恶性肿瘤的发生发展[20]。CHEN等[21]发现miR-200b在卵巢癌表达明显下调,并能靶向调控PDK1来抑制肿瘤细胞的侵袭和迁移。但miR-200b对滋养层细胞的生物学行为的调控作用尚无报道,本研究中miR-200b过表达后SOX2表达量明显降低,且细胞的侵袭、迁移能力明显降低,而过表达SOX2蛋白后能够逆转HTR8-SVneo细胞的上述运动功能,说明miR-200b对滋养层细胞的迁徙和侵袭能力能力可能是通过对对SOX2蛋白的调控作用实现的。
研究表明滋养细胞的这一生理过程是在众多细胞粘附分子、细胞移动分子以及大量的调控酶的相互协调下共同完成的[22]。其中MMPs因其几乎可降解细胞外基质中的非多糖成分,成为参与细胞侵袭过程中重要的效应分子。大量的研究表明MMPs与滋养细胞的病变密切相关[23]。研究发现MMP2和MMP9的活性直接影响滋养细胞的迁移和侵袭能力[24]。另据报道MMP9的表达量直接影响滋养细胞对胚胎的侵袭细胞数量[25]。研究显示侵袭相关分子MMP2和MMP9的表达在子痫前期的病理发展中发挥重要作用[26]。本研究采用生物信息网站预测SOX2能调控MMP2和MMP9的表达,下调SOX2的表达后,MMP2和MMP9蛋白的表达均明显降低,推断SOX2在子痫前期中通过调控MMP2和MMP9的表达来影响滋养细胞的侵袭能力。
综合上述,SOX2在子痫前期患者的胎盘组织中表达量异常升高,SOX2蛋白可能受miR-200b的调节而靶向调控MMP2和MMP9的表达影响滋养细胞的侵袭、迁移能力。
