PCR-DGGE法分析酸菜中酵母菌微生物的多样性
2020-11-26赵虎威燕平梅
赵虎威,燕平梅
(太原师范学院 生物系,太原 030619)
酸菜作为中国传统的一道发酵蔬菜,一直以来都深受人们喜爱。传统酸菜具有浓郁的酸香,既清爽又可口。更重要的是酸菜汁具有清热解暑、增强食欲、健脾、通肠道防便秘、降低血脂和胆固醇等有益身体的功效[1]。酸菜是由酵母菌、干酪乳杆菌、植物乳杆菌、醋酸杆菌等发酵生成的[2],在不同的发酵时期每种微生物所起的作用不同,因此使酸菜具有独特的风味[3]。有研究表明酸菜发酵过程中真菌种类比细菌种类少[4],德巴利汉逊酵母(Debaryomyceshansenii)是真菌中的优势种[5]。前人对酸菜中细菌的研究较多,但对真菌的研究较少,因此本实验选择对真菌中的酵母菌进行研究。
随着分子生物学快速发展,人们更多地从分子和基因水平研究酵母菌的遗传组成和分类。26S rDNA在细胞内有很大的拷贝数,使扩增更容易,能用于近亲缘关系菌株的分类,目前这一区域的应用较广泛[6,7]。一些研究表明分子生物学PCR-DGGE可用于研究酸菜中的酵母菌[8,9]。付琳琳采用PCR-DGGE方法研究泡菜中微生物时发现泡菜中不仅存在乳酸菌,还有其他微生物。
因此本实验采用非培养方法,利用PCR-DGGE技术对酸菜中酵母菌的多样性进行研究[10]。通过一系列方法对酸菜中酵母菌的丰富度、多样性、均匀性进行分析。
1 材料与方法
1.1 实验材料与器材
广乐牌泡酸菜(青菜、水、食用盐、调味料酒、香辛料、食品添加剂) 500 g(用SA标记);松源牌酸菜(白菜、水、料酒、食盐、葱、姜、八角、桂皮、花椒、辣椒、香叶、小茴香) 500 g(用SB标记);青菜酸菜(青菜、水、食用盐、生姜片)500 g(用SC标记);白菜酸菜(白菜、水、葱、八角、姜片、盐、味精)500 g(用SD标记)。
TC-96/G/H(b)B型PCR仪;DYY-6C型电泳仪;凝胶成像系统(DcodeTM)、The DcodeTMUniversal Mutation Detection System 美国Bio-Rad公司。
1.2 实验方法
1.2.1 酸菜汁中酵母菌DNA的提取
分别取4种泡菜汁18 mL在超净工作台上经无菌滤纸过滤装入9个2 mL离心管中,8000 r/min离心5 min。离心后弃去上清液,将所得沉淀用移液枪收集到一个离心管中,再次离心,弃去上清,小心吸干多余的上清液。用天根生化科技有限公司的离心柱型试剂盒提DNA,在4 ℃保存。配制琼脂糖TAE比值为1%的胶,检测DNA。
1.2.2 26S rDNA的PCR扩增
引物:NL1-GC (cgc ccg ccg cgc ggc ggg cgg ggc ggg ggc gcg ata tca ata agc gga gga aaa g);LS 2 (att ccc aaa caa ctc gac tc)。
反应体系:NL 1-GC 1 μL,LS 2 1 μL,DNA 1.5 μL, PCR Master Mix 12.5 μL,ddH2O 9 μL。
各取PCR产物3.5 μL,按照1.2.1的方法进行琼脂糖凝胶电泳分析。由Marker可知DNA片段长度。
1.2.3 变性梯度凝胶电泳(DGGE)
变性梯度凝胶的配方见表1。
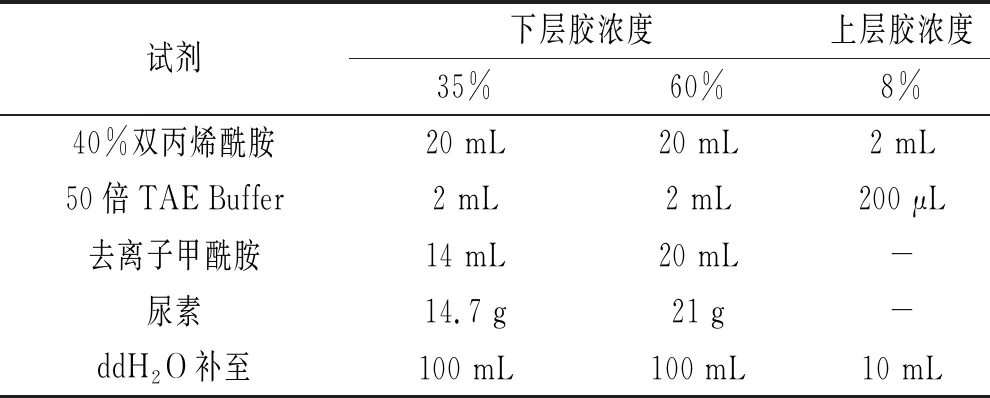
表1 变性梯度凝胶的配方
DGGE电泳后凝胶于Bio-Rad公司的凝胶成像系统分析、拍照。将每条可看到的电泳带切割回收,溶胶后作为模板通过PCR反应扩增26S rDNA片段,纯化后与pGM-T Vector进行连接,转化感受态细胞。将检测阳性克隆的送到华大基因公司进行基因序列测定。
1.2.4 DGGE图谱分析
用Quantity One分析凝胶成像仪拍出的照片。
计算多样性指数(H)、均匀度指数(D)、丰富度指数(R)。
多样性指数(H)[11]的计算公式:
H=-∑(ni/N)In(ni/N);
E=H/InS;
R=S-1/InN。
式中:ni为单一条带的峰面积,N为某一泳道所有峰面积,S为某一泳道的总条带数。
2 结果分析
2.1 酵母菌微生物总DNA提取
分别取3 μL的DNA与0.5 μL的溴酚蓝缓冲溶液混合后点样,在110 V下电泳35 min,用紫外观察仪观察并拍照,结果见图1。

图1 酸菜微生物总DNA的提取
由图1可以看到清晰的1条带,说明成功提取到DNA,可以进行后续实验。
2.2 酵母菌PCR扩增条带
各取4种PCR产物3 μL,按照1.2.1的方法进行琼脂糖凝胶电泳分析,结果见图2。
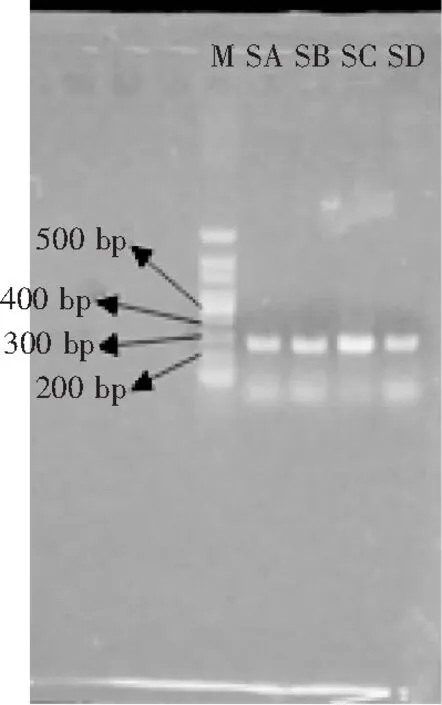
图2 26S rDNA的PCR电泳图
根据与Marker的对比可知DNA片段大小在270 bp左右,而且条带宽度、亮度都不一样,说明DNA浓度不一样。扩增产物在紫外成像仪下可以清晰地看到1条带,说明扩增成功,可以进行DGGE实验。
2.3 DGGE图谱分析
DGGE结果见图3。
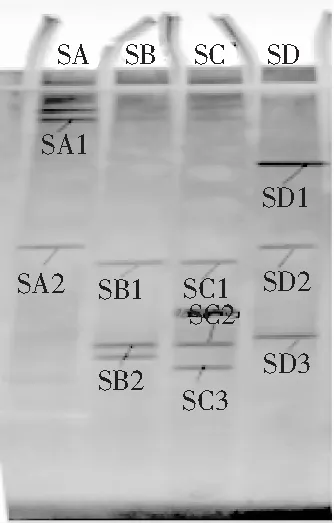
图3 酸菜酵母菌26S rDNA的DGGE图谱
条带的宽度、亮度不同,表示DNA浓度不同。由图3可知,共检测出了13条带。酸菜1检测到3条带,但有效回收2条,如SA1、SA2,即有3种酵母菌;酸菜2检测出3条带SB1、SB2、SB3,即有3种酵母菌;酸菜3中检测出4条带,即有4种酵母菌;酸菜4中有3条带,即有3种酵母菌。说明酸菜3中酵母菌含量较丰富,但整体来说差距不是很大。SA2与SD2、SB2与SC2、SB1与SC1位置相同,为同一种酵母菌。酸菜A中SA2的亮度最亮,说明酵母菌SA2在酸菜A中含量丰富;酸菜B中SB2的亮度最亮,说明酵母菌SB2在酸菜B中含量丰富。可见,同一种酵母菌在不同的酸菜中丰富度不同。
2.3.1 酸菜样品酵母菌微生物群落结构特征
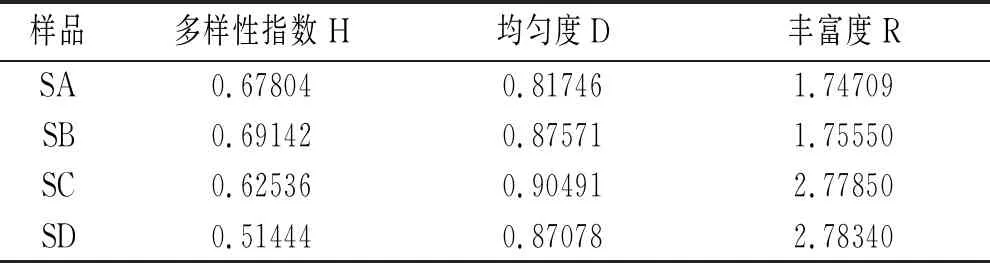
表2 酸菜样品酵母菌微生物群落结构特征
由表2可知,酸菜A,B,C的多样性指数高于酸菜D,说明其他3种酸菜酵母菌种类较D丰富;酸菜A的均匀度比其他3种酸菜较低;酸菜A,B的丰富度比C,D较低,说明酸菜C,D中酵母菌含量较丰富。综合比较酸菜C中的3项指标都较高,说明酸菜C中酵母菌丰富,且酵母菌种类丰富。
2.3.2 酸菜中酵母菌的聚类分析
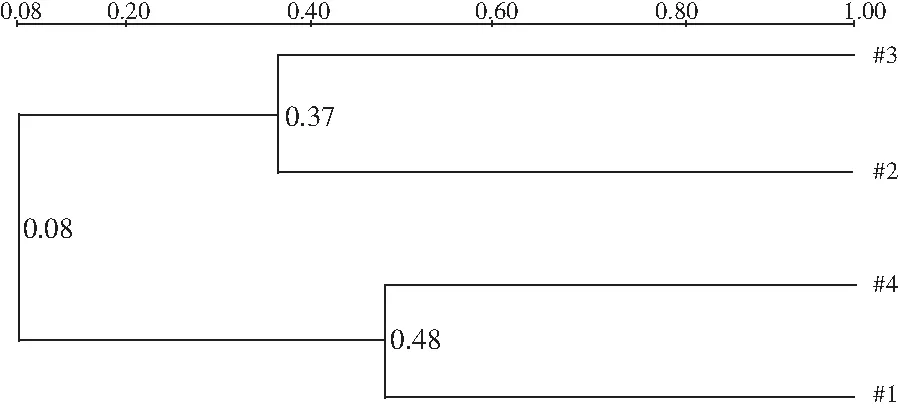
图4 酸菜中26S rDNA片段的DGGE条带相似性聚类图
发酵酸菜DGGE电泳图谱DNA条带的聚类分析结果见图4,发酵全过程聚为两大类:酸菜2与酸菜3聚为一类,即SB、SC聚为一类;酸菜1和酸菜4聚为一类,即SA、SD聚为一类,说明酸菜中酵母菌大致归属于两大类群。
2.4 DGGE电泳分析及回收电泳带的鉴定
为了研究酸菜中的微生物种类,实验中回收亮度强的电泳带,通过对回收序列进行测序,并与GenBank库序列对比鉴定(见表3)。经鉴定,SA1、SA2、SB1、SB2、SC2、SC3、SD3分别与UnculturedKazachstania,Candidahumilis,Issatchenkiaoccidentalis,Pichiaoccidentalis,Issatchenkiaterricola,Saturnisporamendoncae,Saccharomycescerevisiae,相似度为87%、87%、99%、98%、89%、99%、99%。然后通过Mega 6软件构建系统发育树(见图5)。

表3 酸菜酵母菌DGGE条带序列结果
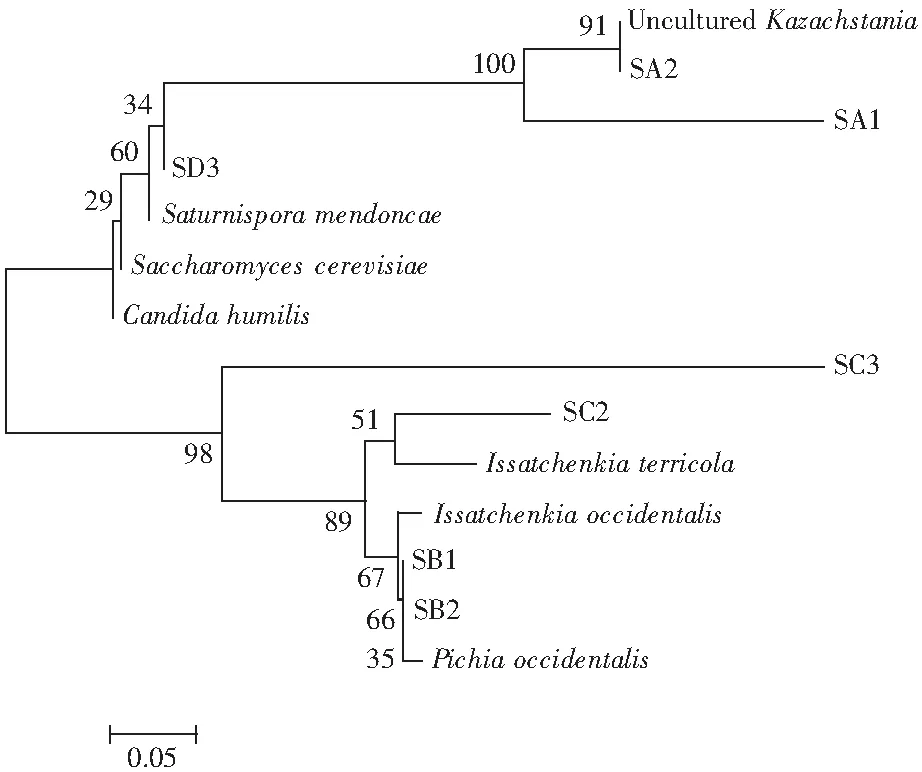
图5 酸菜中酵母菌系统发育树
由图5可知,SA2与UnculturedKazachstania形成一个分支,可信度达到91%,SC2与Issatchenkiaterricola形成一个分支,可信度达51%,SB1、SB2与Pichiaoccidentalis形成一个分支,可信度达66%,SA1与SA2和UnculturedKazachstania形成一个分支,可信度达到100%,SC3与其下方6条序列形成一个分支,可信度达98%。
3 讨论
酵母菌是酸菜中主要的微生物之一,因此也一直是主要的研究对象,酵母菌在酸菜的发酵工程中会影响其风味和质量。本实验采用非培养的方法,通过PCR-DGGE等分子生物学技术对酸菜中酵母菌进行研究。之前也有很多关于发酵蔬菜中微生物的研究。乌日娜等的研究表明酸菜中细菌含量较高,而真菌较少。武俊瑞研究发现德巴利汉逊酵母(Debaryomyceshansenii)是真菌中的优势种。有研究表明,在盐渍青菜中分离出10种酵母菌,有4种优势菌与假丝酵母属(Candida)、德巴氏酵母属(Debaryomyces)、接合酵母属(Zygosaccharomyces)的菌株相似[12,13]。本实验则检测出UnculturedKazachstania,Candidahumilis,Issatchenkiaoccidentalis,Pichiaoccidentalis,Issatchenkiaterricola,Saturnisporamendoncae,Saccharomycescerevisiae等酵母菌。有一些是几种酸菜共有的,而有的是某种酸菜特有的。研究结果表明青菜酸菜中酵母菌多样性高,且酵母菌群落稳定存在。
本次研究的优势在于避免了传统培养方法易污染、菌种不完全等缺陷。在意大利香肠[14]、韩国泡菜[15]等的研究基础上,运用PCR-DGGE等技术研究泡菜中的酵母菌。本次研究也有一定的局限性,一些是实际操作中出现的问题,一些是技术上的问题。例如在操作中提取DNA、PCR、切胶等过程有可能造成DNA污染,或者由于操作的原因,使部分DNA分解,从而对目的菌种的种类和含量造成影响,这或许可以用来解释为何DGGE条带较少。不过这些非系统误差可以通过优化实验操作来完成。另外DGGE存在一定的局限性,它对经PCR扩增的DNA片段的长度、浓度等都有一定的要求,而且共迁移现象对测序来说存在困难。因此,本实验虽然测出了酸菜中一部分酵母菌的种类、分布,但仍不完全,有待于进一步的研究。
