Cladosporium sp.AY-42固态发酵产纤维素酶条件优化
2020-11-26文晓霞李豪魏溱熊蕴琦邹伟
文晓霞,李豪,魏溱,熊蕴琦,邹伟
(四川轻化工大学 生物工程学院,四川 宜宾 644005)
纤维素是地球上最丰富的生物质资源,同时也是天然的可再生资源,而纤维素酶可以水解纤维素为结构简单的葡萄糖进行有效转化并加以利用[1]。纤维素酶是一种高效、安全的生物催化剂,在食品生产加工、包装运输中应用广泛[2]。纤维素酶的最适合酶解pH一般在4.5~6.0之间,温度低于50 ℃,不利于纤维素酶活性的发挥[3]。纤维素酶按照功能分为三类:外切葡聚糖酶、内切葡聚糖酶和β-葡萄糖苷酶[4]。纤维素酶来源十分广泛,细菌、真菌、放线菌等都能产生纤维素酶。植物细胞细胞壁的主要成分为纤维素,纤维素酶可以降解其纤维素,促进细胞活性成分有效溶出,提高提取率[5,6]。目前,纤维素酶已广泛应用于食品工业,如发酵食品工业、果蔬加工产业、榨油产业、茶叶加工产业、单细胞蛋白生产等[7]。通过纤维素复合酶解法,研究复合发酵调味品,增加了调味品风味的丰富度,提高了产率[8]。
秸秆是我国农作物生产中的主要“废弃物”,产量大、分布广、种类多[9]。秸秆主要营养成分为木质素、纤维素和半纤维素以及微量矿物质元素[10]。纤维素酶生产主要有液体发酵和固态发酵两种方式,两种生产方式各有优缺点,目前均有工业应用。固态发酵是菌株在含有少量游离水的培养基上生长并发酵产物的过程,其底物多为农业废弃物等,因此具有高产、低能耗及污染小等优点[11]。Jagannath A等[12]优化了醋酸杆菌产纤维素酶的培养条件,最终酶活力达1.27 IU/mL。龚勇等[13]优化了固态发酵纤维素酶霉菌的培养条件,最终CMC酶活力为89.892 U/mL,FPA酶活力为30.912 U/mL。陈晓萍等[14]使用响应面法优化了康宁木霉(Trichodermakoningii)固态发酵培养条件,优化了麸皮添加量、料水比及初始pH,最终FPA酶活提高了2.9倍。固态发酵适宜霉菌的生长,且固态发酵产酶能力一般高于液体发酵,因此固态发酵法在纤维素酶的工业生产中有重要作用。
本研究以实验室前期得到的突变株Cladosporiumsp. AY-42[15]作为出发菌株,以秸秆粉和麸皮之比作为碳源,对其固态发酵产酶条件进行优化,以期获得产酶能力高的菌株,为该菌株的进一步应用提供了一定理论基础。
1 材料与方法
1.1 材料与试剂
实验菌株:Cladosporiumsp. AY-42,原始菌株Cladosporiumsp. B03现保存于四川省微生物资源平台菌种保藏中心,编号为SICC 3.1199。
试剂与药品:柠檬酸钠缓冲液(0.05 mol/L,pH 4.8)、1%羧甲基纤维素钠(CMC-Na)、DNS溶液、羧甲基纤维素钠、NaCl、FeSO4、蛋白胨、KH2PO4、MgSO4·7H2O、酵母膏、(NH4)2SO4、K2SO4、麸皮、秸秆粉等。
1.2 仪器与设备
MJ-250恒温培养箱;TG-16医用离心机 四川蜀科仪器有限公司;PHS-3C酸度计;YX280A型高压蒸汽灭菌锅;SW-CJ-1F净化工作台;HH-6D数显恒温水浴锅 常州普天仪器制造有限公司;V-1000可见分光光度计 翱艺仪器有限公司;SKY-2102C恒温振荡器 上海苏坤实业有限公司。
1.3 培养基的制备
1.3.1 种子培养基
羧甲基纤维素钠(CMC-Na)10 g,蛋白胨3.0 g,KH2PO44.0 g,MgSO4·7H2O 0.3 g,去离子水1000 mL。
1.3.2 分离培养基
CMC-Na 10 g,(NH4)2SO44.0 g,蛋白胨1.0 g,MgSO4·7H2O 0.5 g,KH2PO41.0 g,琼脂20 g,去离子水1000 mL。
1.3.3 麸皮培养基
麸皮15 g,蒸馏水10 mL,装于150 mL三角瓶中灭菌后备用。
1.3.4 固态发酵培养基
油菜秸秆粉3 g,麸皮2 g,料水比1∶1.5,(NH4)2SO40.2 g,装于150 mL三角瓶中灭菌后备用。
1.4 实验方法
1.4.1Cladosporiumsp. AY-42的麸曲种子培养
将斜面保存的菌株Cladosporiumsp. AY-42接种于分离培养基培养,划线2~3代活化后将菌株孢子用接种环挑取到麸皮培养基中,每次挑取3次。将接种后的麸皮培养基置于28 ℃恒温培养箱中培养3 d,每隔12 h振荡培养基防止板结,至菌丝长满培养基表面并且菌株产生大量孢子为佳。
1.4.2 粗酶液制备
将培养好的麸皮种子培养基按10%的接种量接种到灭菌的固态培养基中,在28 ℃恒温培养箱中培养4 d后,取2 g固态发酵物加入20 mL蒸馏水,在摇床中28 ℃、180 r/min振荡1 h,然后过滤将滤液以5000 r/min离心10 min,上清液即为粗酶液。
1.4.3 酶活测定和葡萄糖标准曲线
1.4.3.1 羟甲基纤维素酶(CMC酶)活测定
4根25 mL比色管,1根作空白对照,4根管中都加入1.5 mL浓度为1%的CMC溶液,3根实验管中加入0.5 mL粗酶液,空白管不加粗酶液,一起在50 ℃下反应30 min,取出后都加入1.5 mL DNS溶液,空白管加入0.5 mL粗酶液后迅速与实验管一起沸水浴10 min,冷却至室温后定容到25 mL,540 nm下测定吸光值,计算酶活。
酶活定义:在一定条件下,1 mL粗酶液每分钟水解底物产生1 μmol葡萄糖所需酶量定义为一个酶活单位IU。
式中:m为葡萄糖的质量,mg;1000为葡萄糖mg换算成μg;n为稀释倍数;180为葡萄糖的摩尔质量,mg;t为酶活反应时间,min;0.5为换算成酶液1 mL。
1.4.3.2 葡萄糖标准曲线
配制1 mg/mL的葡萄糖标准溶液,取8支比色管,依次编号为0,1,2……7,分别取葡萄糖标准液0,0.2,0.4,0.6……1.2,1.4 mL依次加入比色管中,然后依次加入2,1.8,1.6,1.4……0.8,0.6 mL蒸馏水(见表1),使每个比色管体积为2 mL,再向每根比色管中加入1.5 mL DNS溶液,然后将8根比色管一起放入沸水中水浴10 min,立即取出比色管冷却至室温,再定容至25 mL,在540 nm下测定吸光值。以吸光值为纵坐标、葡萄糖浓度为横坐标做实验,采用Excel绘制葡萄糖的标准曲线。

表1 葡萄糖标准曲线测定表
1.4.4 固态培养基组成优化
1.4.4.1 碳源对产酶的影响
对固态培养基中碳源进行优化,将油菜秸秆粉∶麸皮分别设置为1∶0、1∶4、2∶3、3∶2、4∶1、0∶1共6组不同的比值,料水比为1∶1.5,(NH4)2SO4为0.2 g,种子培养基接种量为10%,在28 ℃下恒温培养4 d后测定CMC酶活,探究最适的油菜秸秆粉与麸皮的比例。
1.4.4.2 氮源对产酶的影响
探究不同氮源对产酶的影响,氮源分别为蛋白胨、(NH4)2SO4、NH4NO3、酵母粉、NH4Cl、尿素,油菜秸秆粉∶麸皮为3∶2,料水比为1∶1.5,种子培养基接种量为10%,在28 ℃下恒温培养4 d后测定CMC酶活,确定固态发酵的最佳氮源。
1.4.4.3 氮源浓度对产酶的影响
固态培养基为油菜秸秆粉∶麸皮为3∶2,料水比为1∶1.5,种子培养基接种量为10%,(NH4)2SO4添加量分别为1%、2%、3%、4%、5%,在28 ℃下恒温培养4 d后测定CMC酶活,探究氮源浓度对菌株产酶的影响。
1.4.5 固态培养条件优化
1.4.5.1 料水比对产酶的影响
固态培养基为油菜秸秆粉∶麸皮为3∶2,(NH4)2SO4添加量为2%,种子培养基接种量为10%,料水比分别为1∶1、1∶1.5、1∶2、1∶2.5、1∶3,在28 ℃下恒温培养4 d后测定CMC酶活。
1.4.5.2 发酵温度对产酶的影响
固态培养基为油菜秸秆粉∶麸皮为3∶2,料水比为1∶2,(NH4)2SO4为0.3 g,种子培养基接种量为10%,在25,28,30,33,35 ℃下恒温培养4 d后测定CMC酶活,确定最适的发酵温度。
1.4.5.3 接种量对产酶的影响
固态培养基为油菜秸秆粉∶麸皮为3∶2,料水比为1∶2,(NH4)2SO4为0.3 g,种子培养基接种量分别为5%、7.5%、10%、12.5%、15%,在30 ℃下恒温培养4 d后测定CMC酶活。
1.4.5.4 发酵时间对产酶的影响
固态培养基为油菜秸秆粉∶麸皮为3∶2,料水比为1∶2,(NH4)2SO4为0.3 g,种子培养基接种量为7.5%,在30 ℃下分别恒温培养1,2,3,4,5,6,7 d后测定CMC酶活。
1.4.6 固态发酵条件的响应面优化
根据单因素实验结果,选择料水比、温度、发酵时间进行响应面优化,进一步探究培养条件对固态产酶的影响。采用Box-Behnken设计,对固态发酵培养条件进行三因素三水平响应面优化,实验设计见表2和表3。

表2 Box-Behnken实验设计因素水平表

表3 Box-Behnken实验设计表
用Box-Behnken设计进行响应面分析,根据实验结果使用Design-Expert软件进行数据分析,建立响应面模型,得最佳的培养条件。为了检验响应面优化结果的准确性,使用响应面优化的最佳培养条件培养菌株,将实验值与预测值进行对比分析,验证模型是否准确。
1.4.7 数据处理
每个样品固态发酵均做3次平行实验,采用Excel进行数据处理,采用Origin 9.0和SPSS 23进行数据分析。测定结果以平均值±标准差表示,数据采用ANOVA进行Duncan差异分析,P<0.05为差异显著。
2 结果与分析
2.1 碳源对产酶的影响
以不同的油菜秸秆粉与麸皮之比为碳源,结果见图1。
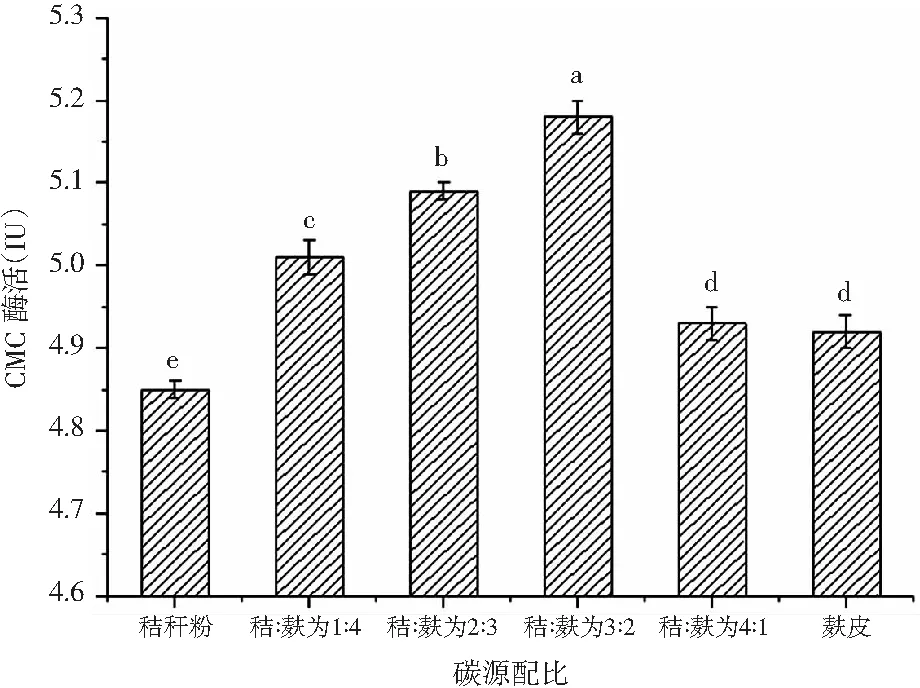
图1 碳源对产酶的影响
由图1可知,单独以油菜秸秆粉和麸皮为碳源时菌株产酶能力不太高。麸皮中含有一定的微生物生长因子,是一种常见的辅助碳源,适当地添加麸皮能够提高产酶能力。当油菜秸秆粉与麸皮比为3∶2时菌株产酶能力最高,此时其CMC酶活达(5.18±0.02) IU,超过这一比例时产酶能力降低,原因可能是过多的麸皮会增加培养基粘性从而影响培养基的透气性,因此选择油菜秸秆粉与麸皮的比为3∶2作为碳源。
2.2 氮源对产酶的影响
不同的氮源种类对菌株固态发酵的影响见图2。
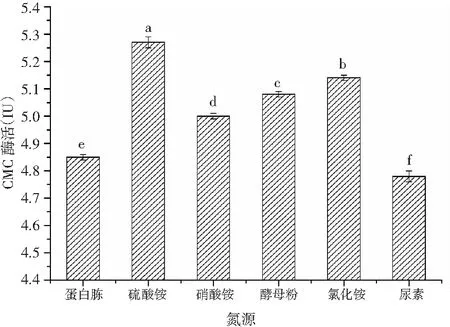
图2 氮源对产酶的影响
由图2可知,菌株利用(NH4)2SO4作为氮源时酶活最高,CMC酶活为(5.27±0.03) IU。总体来讲,菌株产酶对无机氮的利用高于有机氮,实验使用尿素作为氮源时酶活较低,尿素能增加培养基的pH值,影响菌株生长产酶。因此,选择(NH4)2SO4作为固态发酵培养基氮源。
2.3 氮源浓度对产酶的影响
以(NH4)2SO4为氮源,不同氮源浓度对菌株固态发酵的影响见图3。
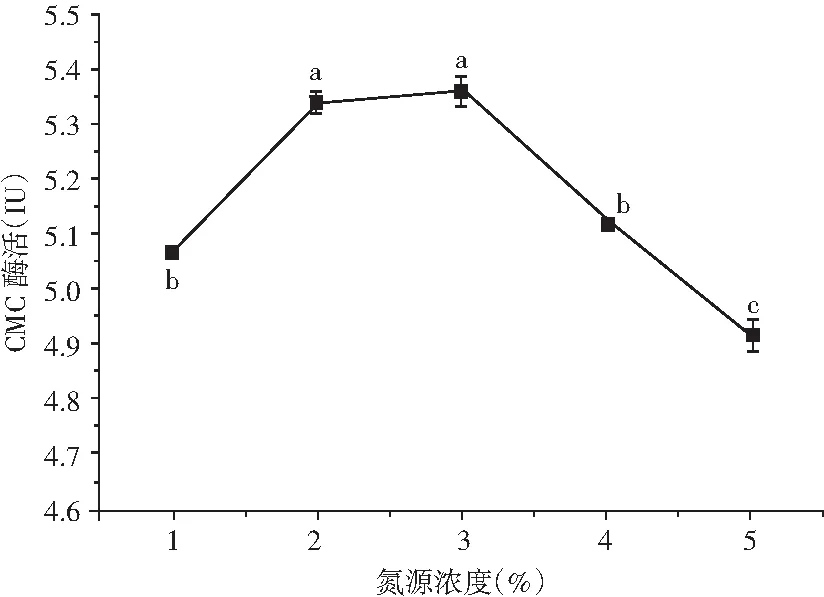
图3 氮源浓度对产酶的影响
由图3可知,随着(NH4)2SO4含量的增加,酶活逐渐增大,2%、3%含量下酶活相差不明显,从成本考虑,以添加量少的为最佳添加量。当超过3%后菌株产酶能力下降,这可能是因为(NH4)2SO4的添加量过大会引起培养基pH的变化,阻碍菌体生长产酶。因此,选择2%的(NH4)2SO4含量为氮源浓度。
2.4 固态发酵培养条件优化
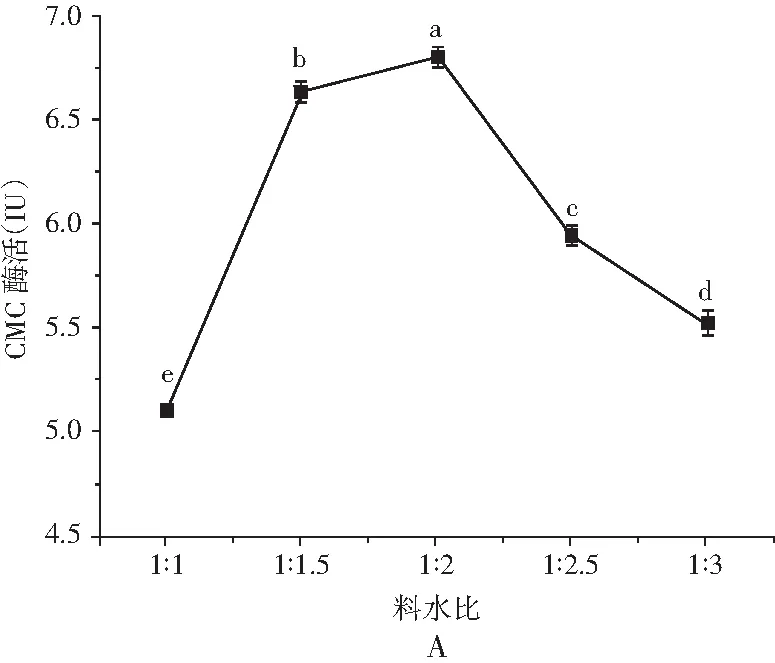
图4 不同培养条件对产酶的影响
2.4.1 料水比对产酶的影响
由图4中A可知,最适的料水比为1∶2,在此条件下菌株固态发酵产CMC酶活为(6.80±0.05) IU。固态发酵的特点是微生物在不含游离水但湿润的培养物中发酵。此时料水比对菌株的生长有较大影响,水分含量过大会导致培养基透气性不足,影响菌株生长,产酶会降低。水含量过低会影响菌株利用培养基中的营养物质,导致菌株生长受阻。因此,选择料水比为1∶2进行发酵培养。
2.4.2 温度对产酶的影响
由图4中B可知,温度会影响细胞膜的流动性和微生物体内生物大分子的活性。温度升高,微生物体内各种生化反应都会加速,微生物的生长和代谢产物也会增加。但是过高的温度会使生物体内活性物质失活,影响微生物的生长和代谢。由4中图B可知,菌株AY-42在30 ℃之前随着温度的增加产酶能力增加,30 ℃后随着温度增加产酶能力降低。在30 ℃时菌株CMC酶活力为(7.51±0.05) IU,因此选择30 ℃作为固态发酵最适温度。
2.4.3 接种量对产酶的影响
由图4中C可知,接种量对菌株AY-42产酶影响较小,在接种量超过7.5%后菌株产酶变化不大。由实验过程分析可知,枝孢菌属为霉菌,在合适的条件下生长能力较强,因此即使接种量较小时菌株也能快速地生长达到与接种量较多的生物量水平。
2.4.4 发酵时间对产酶的影响
由图4中D可知,菌株在1~4 d时随着时间的增加酶活增加,第4天时CMC酶活达(8.12±0.07) IU,4 d后酶活降低,第5天的酶活下降较多。菌株生长过程中产酶量会随着菌株生长而积累,达到最高值后,随着培养基中营养物质的耗尽,产酶减少,最终随着微生物自身的死亡酶活力进一步降低。由实验结果可知,最适发酵时间为4 d。
2.5 培养条件的响应面分析
根据单因素分析结果,因为接种量对产酶影响不大,因此选择对菌株产酶影响较大的因素料水比、温度和培养时间进行进一步优化。利用Box-Behnken设计进行响应面设计,根据实验结果使用Design-Expert软件进行数据分析,建立响应面模型,实验结果见表4;回归方程的方差分析见表5;响应面交互作用图见图5。

表4 Box-Behnken设计表
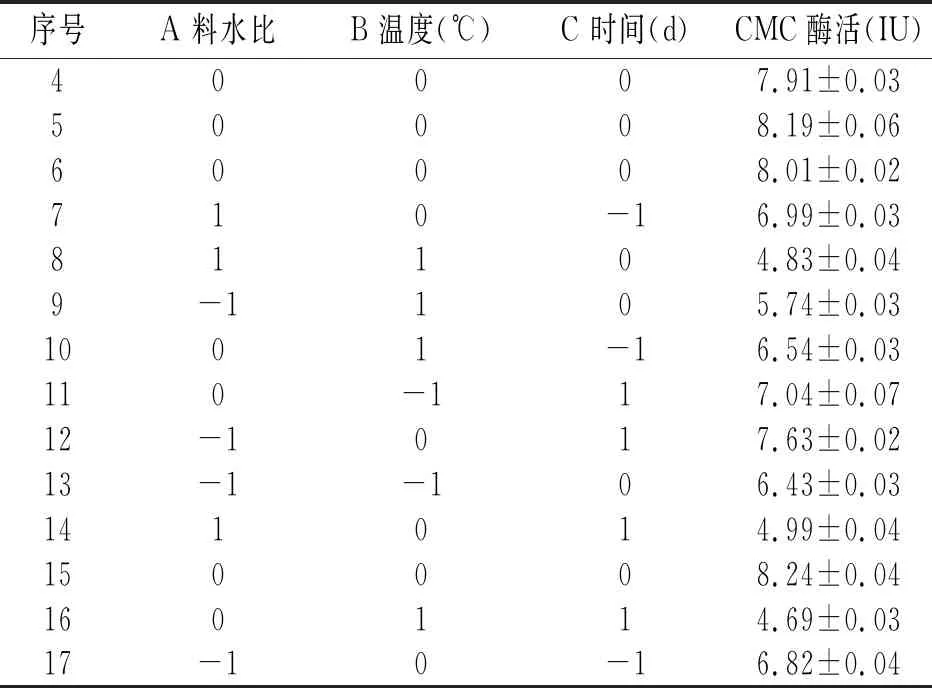
续 表

表5 回归方程方差分析表
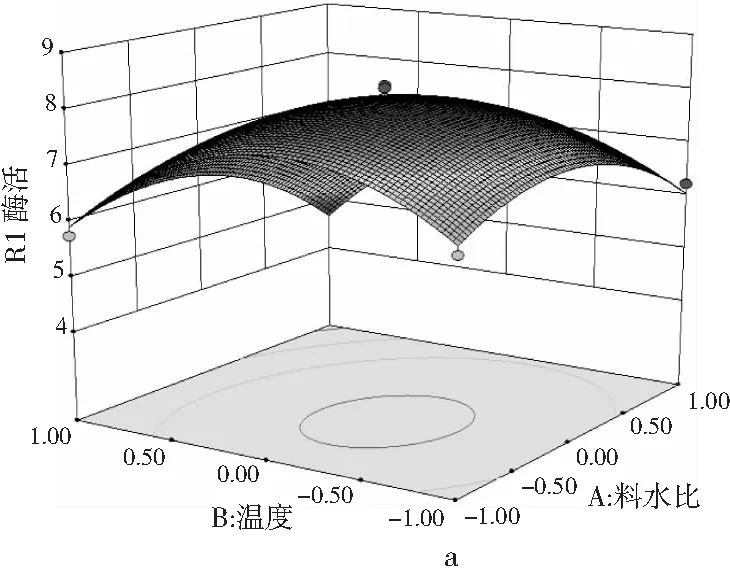
图5 响应面交互作用图
使用Design-Expert软件,对 Box-Behnken设计组合实验结果进行响应面回归分析,得到固态发酵时菌株AY-42产纤维素酶酶活与A料水比、B温度、C时间之间的三元二次回归方程:Y=8.07-0.45A-0.51B-0.28C-0.18AB-0.70AC-0.67BC-0.89A2-1.38B2-0.57C2。
由表5可知,实验所用模型P<0.0001,达到极显著,说明方程拟合良好。失拟项P值为0.1045>0.05,不显著,表明在实验参数范围内,模型合理,可以用来推测和分析预处理实验结果。方程的复相关系数R2=0.9863,说明拟合良好,实验误差较小。方程A2、B2、C2的系数为负数,说明该方程的抛物面开口朝下,在实验值取值内有极大值,可以得到最佳的培养条件组合。
响应面的立体曲面图的倾斜度越高,说明两因素的交互作用越明显。由图5可知,温度与时间和料水比与温度的立体曲面倾斜度较大,说明因素间的交互作用较明显,料水比与时间的立体曲面较缓和,表明因素间的交互作用不明显。由此可知,酶活对时间的响应小于温度和料水比的。
2.6 结果验证
根据实验结果分析所得的三元二次回归方程,使用Design-Expert软件对回归方程求解,得到最佳的固态发酵培养条件为料水比1∶1.88,温度29.66 ℃,发酵时间4 d,实验模型预测酶活最大值为8.11 IU。最终根据实际条件修正最优培养条件为料水比1∶1.8,温度29 ℃,发酵时间4 d。以最终优化的培养条件固态发酵培养菌株,3组平行培养,测定菌株的CMC酶活依次为8.25,8.12,8.16 IU,平均值为(8.17±0.05) IU。实验值与预测值基本吻合,说明模型选用得当。经优化,培养菌株AY-42固态发酵产酶纤维素酶活由(5.18±0.02) IU提高到(8.17±0.05) IU,酶活力提高了57.72%。
3 结果与讨论
随着纤维素酶的深入研究,现已广泛应用于食品、发酵、饲料、生物质能开发、能源及环保等多个领域中,因此,纤维素酶的生产具有广阔的市场[16,17]。本研究对高产纤维素酶菌株Cladosporiumsp. AY-42固态发酵的培养基组成及培养条件进行了优化,结果显示:通过单因素优化确定了培养基的最适碳源为油菜秸秆粉∶麸皮3∶2,最适氮源为(NH4)2SO4以及最适氮源浓度为2%。固态发酵培养条件通过单因素优化确定最佳料水比为1∶2,最适发酵温度为30 ℃,最适培养时间为4 d,接种量对固态发酵产酶影响不大。对料水比、温度、时间进行响应面优化分析,得到最佳的培养条件组合为料水比1∶1.8,温度29 ℃,发酵时间4 d。以最终优化的培养条件固态发酵培养菌株,纤维素酶活由(5.18±0.02) IU提高到(8.17±0.05) IU,酶活力提高了57.72%。
本团队前期对枝孢菌AY-42液态发酵产纤维素酶条件进行了优化研究,优化后CMC酶活为(4.20±0.06) IU[18],固态发酵是液态产酶水平的1.95倍。刘佳[19]对比了毛壳菌M6液态发酵和固态发酵产酶的差异,固态发酵产酶是液态的2.25倍,固态发酵产酶明显优于液态发酵。Herculano等[20]利用棕榈仁饼做底物,使用黑曲霉固态发酵纤维素酶为244.53 U/g。本研究使用油菜秸秆粉进行固态发酵,菌株AY-42的生长旺盛,产酶能力较高,说明枝孢菌属真菌也适用于固态发酵。目前关于枝孢菌固态发酵产纤维素酶还未见研究,本实验是首次报道该菌固态发酵产纤维素酶。
菌株Cladosporiumsp.AY-42应用于纤维素酶的生产还需要进行很多的研究。由于本实验只研究了菌株的粗酶酶活,未对纤维素酶进行分离纯化,后续应该进一步研究菌株产纤维素酶的分离纯化,以期获得纯度更高的酶,为菌株应用于工业化生产提供理论基础。
