基于Cytb和D-Loop基因对中国少鳞鳜种群遗传多样性的分析
2020-11-19潘秋芝聂福顺何孝宽
余 科,安 苗,黄 胜,潘秋芝,聂福顺,何孝宽
( 1.贵州大学 动物科学学院,贵州 贵阳 550025; 2.平塘县农业农村局,贵州 黔南州 558300; 3.荔波县农业农村局,贵州 黔南州 558400 )

贵州境内苗岭山脉系动物地理区划的分界线,其位于长江和珠江的上游,横贯中部的苗岭山脉把全境划分为北面的长江流域和南面的珠江流域,属动物区划中的南亚亚区和南东亚亚区[7],华西小区、华南小区和华东小区的交替地带[8-9],是鱼类遗传结构及其多样性比较研究的理想场所。锦江属于山脉北面长江流域中沅江支流辰水上源,平舟河与樟江分别属于南面珠江流域中西江支流和柳江支流。在各大河流中长江和珠江上游相互交错的区间河流十分复杂,各水系中中国少鳞鳜的比较研究较少,不利于全面认识2大流域种群间的遗传多样性及其系统进化关系,特别是对苗岭山脉两侧群体的研究尚未见报道。对此笔者利用线粒体Cytb基因和D-Loop控制区联合测序分析的方法[10-17],从分子水平揭示了2大流域中3个地理亚群间中国少鳞鳜的遗传变异,并将其与同流域不同水系间种群进行比较,不仅丰富了种群的遗传背景资料,而且为鱼类的保护和优良种质资源挖掘利用提供理论依据[18]。
1 材料与方法
1.1 样品来源
本试验中86尾中国少鳞鳜均为野生活鱼。其中采自沅江上游铜仁锦江31尾(锦江群体),平塘县平舟河43尾(平舟河群体),荔波县樟江12尾(樟江群体)。活鱼解剖取其背部肌肉3~5 g于无水乙醇中浸泡,置于-20 ℃保存备用,标本鱼编号后浸泡于5%甲醛溶液中,保存在贵州大学水产系标本室待测。
1.2 提取DNA
利用DNA提取试剂盒(北京天根)提取样品肌肉基因组DNA,通过1.0%琼脂糖凝胶电泳检验其完整性,再利用紫外分光光度计(Thermo Nano Drop 2000C)测定其吸光值。最后置于-20 ℃保存备用。
1.3 引物的筛选与PCR的扩增
参照扩增线粒体Cytb基因序列[19]和D-Loop区段[20]的引物,对本试验中86个中国少鳞鳜样品进行扩增。Cytb引物序列为:CW03F,5′-CATAGGTCATAATTCCTGC-3′;CW04R,5′-GAATCC-TAGCTTTGGGA-3′。D-Loop区段引物序列为:Telpro,5′-ATTCCACCTCTAACTCCCAAAGCT-AG-3′;Telphe,5′-CGTCGGATCCCATCTTCAG-TGTTATGCTT-3′。送至上海生工生物工程股份有限公司合成。
PCR反应体系均为25 μL,其中Mix 12.5 μL,上下游引物各1.25 μL,DNA 2.5 μL,剩余体积用双蒸水补齐。反应程序:94 ℃预变性3 min;94 ℃变性40 s,51.2 ℃退火(Cytb)或58.6 ℃退火(D-Loop)40 s,72 ℃延伸50 s,重复35个循环;最后再72 ℃终延伸7 min,4 ℃保存备用。通过1.0%琼脂糖凝胶电泳检验,选择特异性强的样品送至上海生工生物工程有限公司进行双向测序。
1.4 序列分析
测定的上下游序列利用DNA Star 5.0软件包中的SeqMan进行拼接并手工校对。并从美国国立生物技术信息中心下载目的序列,利用MEGA 6.06软件进行一致比对,保留相同序列长度。以花鲈(Lateolabraxmaculatus)(NC029318)为外群,结合美国国立生物技术信息中心基因库中各水系不同群体单倍型:辰水河中国少鳞鳜(JN315600)、舞水中国少鳞鳜(JN315582)、漠阳江中国少鳞鳜(JN315563、JN315561)、广西中国少鳞鳜(AB108488)、澄家江中国少鳞鳜(JN315579、JN315577)、北江中国少鳞鳜(JN315571、JN35564)、日本少鳞鳜(C.kawamebari)(NC009868、AP005990)以及朝鲜少鳞鳜(C.herzi)(NC027164、KR075132)等与本试验中序列比对一致,运用MEGA 6.06统计其碱基组成及构建系统进化树其节点的自举置信度水平由自引导值估计,重复次数为1000;基于Kimura-2-parameter模型计算遗传距离。运用Arlequin 3.5进行差异性分子方差显著性检验和计算种群间遗传分化指数 (FST)。最后再通过DNASP 5.0软件获得群体序列遗传多样性参数,包括单倍型数、单倍型多样性、核苷酸多样性和平均核苷酸差异数,基因流(Nm)由Nm≈(1-FST)/4FST计算。
2 结果与分析
2.1 mtDNA Cytb和D-Loop区碱基序列组成
利用上述引物对中国少鳞鳜的86个样品进行扩增。经过与标准序列比对剪切后,保留序列长度为1141 bp(Cytb)和822 bp(D-Loop)的同源序列。基于Cytb基因序列中,共界定出18种单倍型,这3个种群中不存在共享单倍型,均为各自群体所独有。在碱基组成方面,检测出11个变异位点,无插入和缺失,变异率占0.96%。其中存在1个颠换和10个转换,转换主要发生在碱基T与C之间,转换与颠换比为6.195。基于D-Loop基因序列中,共界定出23种单倍型,同样不存在共享单倍型。在碱基组成方面,检测出17个变异位点,其中存在2个缺失和3个插入,变异率占2.07%。其中存在5个颠换和12个转换,A与G转换的位点数占总变异的41.1%,略高于T与C转换比29.4%,转换与颠换比为5.21,这符合脊椎动物 DNA 碱基变异位点中转换大于颠换的观点。
2.2 基于mtDNA Cytb和D-Loop基因的遗传多样性结果
通过对中国少鳞鳜3个种群Cytb基因序列的分析,锦江群体存在10个变异位点,平舟河群体存在6个变异位点,而樟江群体仅存2个变异位点。3个中国少鳞鳜群体的单倍型多样性、平均核苷酸差异数、核苷酸多样性分别为0.918、3.342、0.00293。在D-Loop基因序列中,锦江群体存在9个变异位点,平舟河群体存在4个变异位点,而樟江群体仅存5个变异位点。3个中国少鳞鳜群体的单倍型多样性、平均核苷酸差异数、核苷酸多样性分别为0.903、3.343、0.00410。通过比较2段基因序列的群体间多样性指数发现,锦江群体的遗传多样性较为丰富(表2)。而基于mtDNA Cytb和D-Loop基因的3个中国少鳞鳜种群间遗传分化指数均>0.25,达到极显著水平(P<0.001),表明群体间分化极显著(表3)。

表1 基于mtDNA Cytb和D-Loop序列的碱基组成Tab.1 Base composition based on mtDNA Cytb and D-Loop sequences
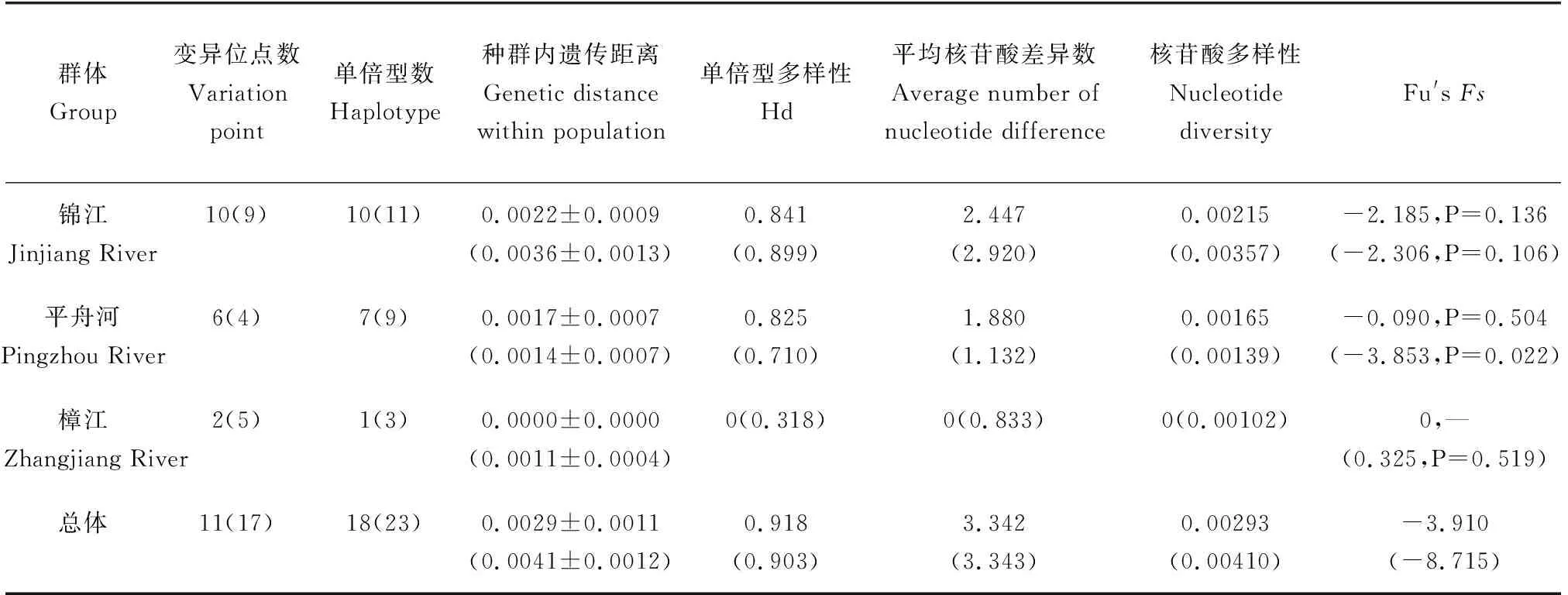
表2 基于mtDNA Cytb和D-Loop(括号内)序列的遗传多样性指数和中性检验Tab.2 Genetic diversity index and neutral test based on mtDNACytb and D-Loop (within parentheses)

表3 基于mtDNA Cytb和D-Loop(括号内)序列3个种群间的遗传分化、基因流和遗传距离指数Tab.3 Genetic differentiation, gene flow and genetic distance index among the three populations based on mtDNA Cytb and D-Loop (within parentheses) sequences
2.3 基于mtDNA Cytb和D-Loop基因分子方差分析
将3个群体按水系分成2组: 第1组为长江流域沅江水系的锦江群体,第2组为珠江流域柳江水系的平舟河群体和樟江群体。在Cytb基因序列分析中,水系间变异占27.77%,水系内群体间变异为32.42%,群体内个体间变异占39.81%(FCT=0.27768,FSC=0.44887,FST=0.60191),说明这3个群体间遗传变异主要来源于群体内个体间,其次才是水系和群体间。而基于对D-Loop区段的分析中,两水系间的变异占15.51%,水系内群体间变异为46.21%,群体内个体间变异占38.28%(FCT=0.15508,FSC=0.54689,FST=0.61716),其遗传变异最主要来源是水系内种群间,即平舟河群体和樟江群体间,其次来源于水系间和群体内个体间(表4)。
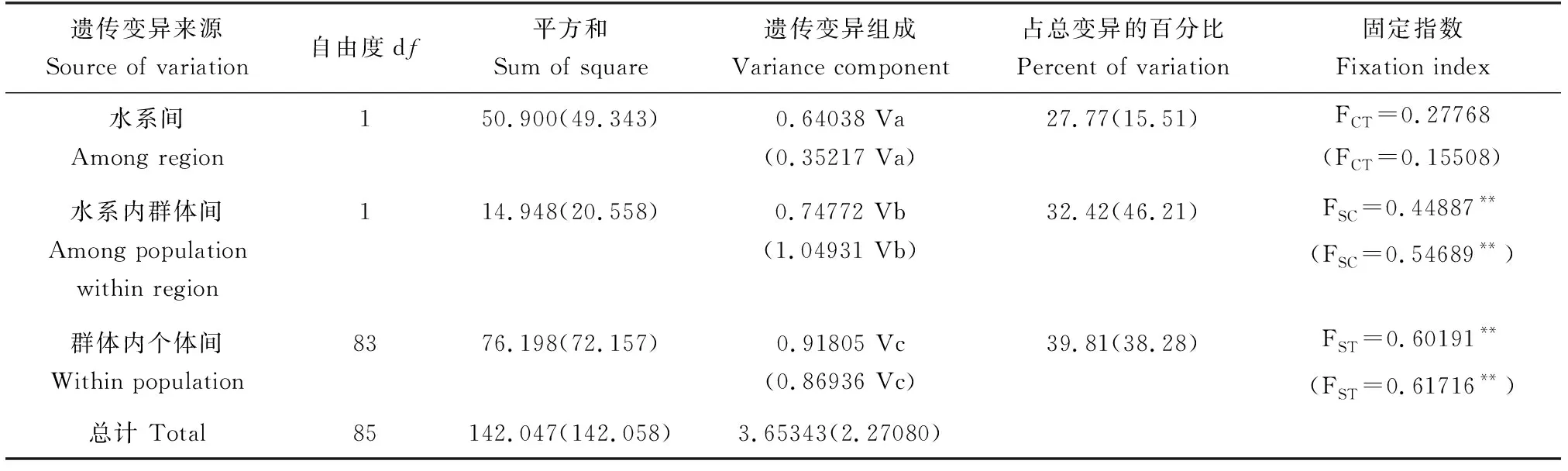
表4 基于mtDNA Cytb和D-Loop(括号内)序列的分子方差分析Tab.4 Analysis of molecular variance (AMOVA) based on mtDNA Cytb and D-Loop in parentheses
2.4 中国少鳞鳜Cytb基因序列遗传结构
对中国少鳞鳜Cytb基因进行扩增,通过比对保留了1141 bp长度,共编码了380个氨基酸。由于碱基的转换或者颠换,有可能造成氨基酸的改变。本试验中,在118nt、716nt、725nt、824nt、887nt和1079nt处均因碱基的改变,其氨基酸也发生了相应的变化。在118nt处,碱基T转换为C,导致氨基酸由酪氨酸(Y)变为组氨酸(H);716nt处,碱基C转换为T,导致氨基酸由脯氨酸(P)变为亮氨酸(L);725nt处,碱基G转换为A,导致氨基酸由精氨酸(R)变为赖氨酸(K);824nt处,碱基C转换为T,导致氨基酸由苏氨酸(T)变为甲硫氨酸(M);887nt处,碱基A转换为G,导致氨基酸由丝氨酸(H)变为精氨酸(R);1079nt处,碱基A转换为G,导致氨基酸由谷氨酸(E)变为甘氨酸(G)。这些位点均因转换而导致氨基酸的改变。
2.5 基于mtDNA Cytb和D-Loop 基因的种群动态变化
各种群的Fu′sFs值均未表现出显著的负值。而在碱基错配图中(图1),因樟江群体的变异位点较少,信息量少,种群扩张不宜采纳。为此,将3个种群按2大水系分为2类,长江流域中锦江河段呈多峰的趋势,珠江流域2大种群合在一起呈单峰的趋势。基于Cytb序列3个群体的分析图中,呈现出单峰的趋势,而基于D-Loop序列中则呈现多峰的趋势。

图1 基于mtDNA Cytb和D-Loop基因3个种群核苷酸不匹配分析Fig.1 Nucleotide mismatch analysis in the three populations based on mtDNA Cytb and D-Loop genesa.锦江群体Cytb序列; b.平舟河与樟江群体Cytb序列; c.3个群体Cytb序列; d.锦江群体D-Loop序列; e.平舟河与樟江群体D-Loop序列; f.3个群体D-Loop序列.a.Cytb sequence in Jinjiang River population; b.Cytb sequence in Pingzhou River and Zhangjiang River populations; c.Cytb sequence in the three populations; d.D-Loop sequence in Jinjiang River population; e.D-Loop sequence in Pingzhou River and Zhangjiang River populations; f.D-Loop sequence in the three populations.
2.6 构建邻接系统进化树
由系统进化树的结果(图2)可知,中国少鳞鳜显示出2个谱系,本试验中18个单倍型与舞水、辰水群体构成了谱系1,且Hap11与另外17个单倍型形成支持率很高的亚枝;而北江、澄家江和漠阳江群体构成了苗岭山脉以南的谱系2,且置信度100%。谱系1中发现,长江流域的锦江群体和珠江流域中柳江和西江水系群体聚类在一起,并且这 3个种群的单倍型聚类未能与当下河流水系对应形成明显的系统地理学关系。

图2 基于线粒体Cytb序列构建邻接系统发生树Fig.2 NJ phylogenetic tree based on mtDNA Cytb sequence
3 讨 论
3.1 Cytb和D-Loop两区段中的碱基组成
本试验获得的D-loop和Cytb基因同源片段序列中,A+T含量均高于G+C含量。这与其他鱼类线粒体DNA碱基组成相同[21-23],符合动物线粒体基因组中4种核苷酸不均一分布这一共性[24]。并且在Cytb同源序列中,碱基C表现出偏歧性和呈现出对碱基G的偏好性;而在D-Loop区段内,A+T含量(64%)远大于 G+C含量(36%),明显表现出对碱基AT的偏好性和反G的偏歧。在大泷六线鱼(Hexagrammosotakii)群体遗传多样性的结果分析中,也存在碱基A、T明显高于碱基G、C的情况,说明这是脊椎动物D-Loop区段的特征[25]。在Cytb区段中存在11个变异位点,共界定了18种单倍型,这两项指标均低于D-Loop区中变异位点数(17个)和单倍型个数(23种)。这很可能是由于在线粒体基因中,D-Loop区段为非编码区,不编码蛋白质,受自然选择的压力小,且变异速度也是最快而产生的差异[26-27]。不仅如此,在该非编码区还发现3个插入和2个缺失,这可能是该区段不受蛋白功能需要和三联体密码限制,插入和缺失位点突变后比较容易保留。而Cytb用于编码蛋白质,带有插入和缺失突变的个体很容易被淘汰[21]。
3.2 遗传多样性分析
遗传多样性就是基因的多样性,而基因多样性就是基因变异的差异大小,即遗传多样性最直接的表达形式就是遗传变异程度。由遗传物质变异积累产生的遗传多样性决定物种的适应能力及进化趋势,也是种质资源保护和利用的前提和基础。而我们通常以单倍型多样性和核苷酸多样性来评价遗传多样性[28]。遗传多样性越丰富,物种对环境变化的适应能力和进化能力越强[29]。Grant等[10]基于整个mtDNA限制性内切酶的结果,将鱼类遗传多样性分为:低单倍型多样性低核苷酸多样性(单倍型多样性<0.5,核苷酸多样性<0.005)、低单倍型多样性高核苷酸多样性(单倍型多样性<0.5,核苷酸多样性>0.005)、高单倍型多样性低核苷酸多样性(单倍型多样性>0.5,核苷酸多样性<0.005)和高单倍型多样性高核苷酸多样性(单倍型多样性>0.5,核苷酸多样性>0.005)4种情形。依据该划分标准,通过Cytb和D-Loop两区段对3个群体多样性程度进行分析,锦江群体与平舟河群体均呈高单倍型多样性低核苷酸多样性类型,而樟江群体呈现出低单倍型多样性低核苷酸多样性类型。司从利[30]认为,珠江水系鳜鱼呈现高单倍型多样性低核苷酸多样性的特点,可能是因为冰期破坏了鳜鱼栖息地,种群数量下降,此类型种群通常由一个较小的有效种群经过近期快速扩张形成一个大的种群所致。这种快速群体扩张可产生许多新的突变,积累了单倍型的多样性,但缺乏足够时间积累核苷酸序列的多样化[31]。本试验中,锦江群体中遗传多样性较平舟河与樟江群体更为丰富,可能是因为锦江河段为中国少鳞鳜的生存和进化提供了较为优越的自然条件。Cao等[5]在对中国少鳞鳜群体线粒体基因和核基因的研究中得到辰水河群体的单倍型多样性和核苷酸多样性指数分别为0.8和0.0028,接近于本试验中锦江群体,但高于平舟河和樟江群体;不仅如此,舞水、北江以及漠阳江群体的遗传多样性程度均与樟江群体一样,但它们又低于钱塘江和澄家江群体的遗传多样性程度,呈现出长江流域遗传多样性水平高于珠江流域的趋势。周文漪等[32-33]在对不同水系斑鳜(Sinipercascherzeri)的研究中得到,长江群体中的遗传多样性最高,这可能与长江流域范围广,分布区向西延伸至四川境内,群体数量大,基因变异丰富,而珠江上游地理范围相对狭小,与其他群体的基因交流缺乏有关。
3.3 遗传分化及种群动态变化
遗传分化指数是衡量群体间遗传分化的重要指标,遗传分化指数接近于0时,表明群体间未发生遗传分化,在0~1范围内,其值越大种群间的分化程度越高[34]。据Balloux等[35]的界定,遗传分化指数为0~0.05表示极小遗传分化;遗传分化指数为0.05~0.15表示中度遗传分化;遗传分化指数为0.15~0.25表示较大遗传分化;遗传分化指数>0.25表示有极大的遗传分化。在本试验中,3个种群间的遗传分化指数值均>0.25这个临界值。此外,结合两区段中基因流的值均<1,由此推断,3个种群间均已存在极大的遗传分化,基因交流频率较为匮乏。这是由于地理隔绝致使生存环境不同,从而使3个群体产生如此的差异。这也就不难解释3个群体间没有共享单倍型的现象。通常情况下,Fu′sFs中性检验和错配碱基分布图均能有效地检测种群动态,该指标对种群扩张现象较为敏感,当出现显著性的负值时,表明种群呈现出扩张现象;而错配碱基分布图在出现种群扩张现象的时候将呈现单峰模式[36]。Cytb和D-Loop区段的中性检验均未出现显著负值,错配碱基分布图也未出现明显单峰的趋势,由此可推测,本试验中中国少鳞鳜群体未出现过种群扩张史。
线粒体Cytb基因序列构建的系统进化树有明显的2个分支。在谱系1中发现,长江流域锦江群体和珠江流域中的群体聚类在一起,此结果与王伟伟等[37]对我国斑鳜不同群体的聚类结果一致。本试验结果表明,既无受苗岭山脉的阻挡而形成独立的2个分支,也没有与当下水系对应形成明显的地理学关系。谱系1中单倍型最多,包含着2个流域中部分群体,有可能该谱系是中国少鳞鳜最古老的群体。推断造成此类分支情况的原因:苗岭山脉在第四纪因青藏高原大幅度整体抬升之前,不足以形成隔离的趋势。随着苗岭地势自东向西隆升和河流溯源侵蚀,苗岭形成独立单元[38]。自此,苗岭两侧种群因地理阻隔和生境差异,沿不同的方向发展进化,并造就现今南北分化明显和种群内变异反差较大的遗传结构。
3.4 资源保护
遗传多样性高低通常能反映出该群体在环境中的适应能力、生存能力以及进化能力。在本试验中,虽然中国少鳞鳜遗传多样性相对丰富,但仍表现出高单倍型多样性低核苷酸多样性的现象。推测可能是中国少鳞鳜属中小型鳜类,生活于河流上游及支流的溪涧中,其生长繁殖局限于局部水域中,扩散能力弱,群体较小,不同地理种群间的基因交流甚少,遗传分化显著,加之修建水坝和水环境恶化等原因,导致中国少鳞鳜补充群体逐年减少、资源量下降,进而有效群体的数量、规模迅速下降,出现瓶颈效应,导致此类现象的发生[3-5]。
对此,建议渔业部门保护其遗传资源,通过加强人们保护鱼类资源的意识和优化当地的水资源,为鱼类提供良好的生存环境。除此之外,修筑水坝电站改变了原有鱼类的栖息环境,导致物种衰退,对此应设计鱼类洄游通道,旨在增加上下游鱼类的基因交流频率,丰富遗传多样性,提高濒危物种的生存进化能力。
4 结 论
对贵州境内苗岭山脉两侧3个中国少鳞鳜自然群体的研究发现,群体间分化明显,这与造山运动导致苗岭山脉被继续抬升有关;另外,3个群体中锦江群体遗传资源相对丰富,同时提醒我们保护平舟河与樟江群体的资源状况迫在眉睫。本试验揭示了两大流域中中国少鳞鳜亚群间的遗传变异,为其种质资源的保护和开发利用提供了参考依据。
