造流对小新月菱形藻敞开式培养的影响
2020-11-19冷晓飞程德金亓守冰张伟杰
冷晓飞,张 勃,程德金,周 秘,亓守冰,陈 顺,张伟杰
( 1.大连海宝渔业有限公司,辽宁 大连 116023; 2.乳山市海洋与渔业监督监察大队,山东 威海 264500;3.大连海洋大学,农业农村部北方海水增养殖重点实验室,辽宁 大连 116023; 4.江苏海洋大学 海洋资源与环境学院,江苏 连云港 210095 )
微藻是自然界中的初级生产力,具有繁殖速度快、环境适应能力强等特点[1]。微藻细胞不仅含有大量的蛋白质、多糖、脂类一般营养物质,还含有丰富的维生素、生物素、β-胡萝卜素和叶酸等特殊营养物质。目前微藻培养在水产养殖、食品、饲料、医药以及环境保护等多个领域已得到广泛的应用[2]。敞开式培养由于构建简单、成本低廉及操作简便,是最常用的一种微藻培养方式,尤其是在大规模的水产动物苗种培育过程中,微藻饵料的培养方式大部分采用敞开式培养[3]。微藻在敞开式培养方式中的生长易受温度、光照和营养盐等环境因子制约,而关于提高微藻培养密度和产量方面的研究也多集中于探讨最佳培养基环境[4-7],对敞开式培养操作方式的研究则相对较少。
水产动物微藻饵料的敞开式培养在接种施肥后,采取的主要操作方式为搅池,目的是防止藻体
沉降和凝结成块,促进气体交换,加快光合作用过程中氧气的释放和二氧化碳的带入。许多研究中以充气作为搅池和增加二氧化碳的方式。王艳等[8]研究发现,充气和搅动均能促进球形棕囊藻(Phaeocystisglobosa)囊体的形成,试验组中囊体密度高于对照组。吴红艳等[9]发现充气培养的钝顶螺旋藻(Spirulinaplatensis)其类胡萝卜素及藻蓝蛋白与叶绿素a含量比例的增长要高于静止培养的螺旋藻,同时该研究还发现,在培养和生产过程中,通过搅拌以释放培养液中的溶解氧,减少由紫外辐射所带来的伤害也是十分必要的。水产动物饵料生产中,搅池多采用人工方式(即每日由饵料培养人员进行若干次搅池),其缺点是耗费人力且搅动效果差,而其他搅池方式如充气搅池、机械臂搅池等需要配备气体消毒设备或机械设备,且操作不慎易造成污染。在微藻敞开式培养中,如何优化
搅池效果亟待研究。
造流泵应用于水族缸中可起到营造自然水流的作用,由于安装方便,可应用于微藻敞开式培养替代人工搅池操作。笔者通过监测不同造流组中小新月菱形藻(Nitzschiaclosteriumf.minutissima)的生长及培养水体水质因子的变化,分析造流方式在微藻敞开式培养中的应用潜力,研究结果将为提高水产动物微藻饵料培养效率提供技术参考。
1 材料与方法
1.1 试验材料
小新月菱形藻一级藻种来自农业农村部北方海水增养殖重点实验室。对其进行二级扩培后,用于各试验组的接种。
1.2 试验方法
利用造流泵(天津森森水族用品有限公司)实现对培养水体的造流,设置3个不同功率的造流培养组,分别为3 W(型号JVP-101)、6 W(型号JVP-102)和12 W(型号JVP-200),对应流量分别为2000、3000、5000 L/h,同时设置1个对照组,用普通搅拌耙搅池,每个处理设置3个平行。
试验组及对照组微藻培养容器采用12个完全一致的53 cm×72 cm×58 cm 200 L水桶,培养海水经500目筛绢过滤并经二氧化氯消毒,培养基施加康威营养液。试验组不同功率的造流泵均固定于培养容器长面距底20 cm处(图1),且调整造流泵使水流角度朝向桶底与水平面呈45°以保证造流时整体水体能混合均匀。
试验组与对照组同时接种,3、6、12 W和对照组的接种密度均设置为7.0×104个/mL,由于培养水体实际大小与估计值略有差异,接种后的实际初始密度分别为(6.8±0.2)×104个/mL、(6.8±0.3)×104个/mL、(6.3±0.6)×104个/mL、(8.3±0.8)×104个/mL,经统计分析各组间无显著差异。试验共进行6 d,接种后各造流组造流泵连续运转至试验结束,对照组每日搅池3次,搅池时间为8:00、12:00和18:00。培养期间采用车间内自然光照,8:00培养水体上方光照度为3760~15 853 lx,12:00光照度为14 723~19 997 lx,18:00光照度为413~6633 lx,各培养水槽光照度一致。
1.3 数据测量
每日8:00和18:00从各试验组与对照组培养容器中取样,利用血球计数板在10倍目镜、40倍物镜下计藻细胞密度,每个样品重复计数3次,求其平均值。每日8:00、12:00和18:00(分别记做M、N和E)使用水质仪(Thermo Orion Star A216)测量水质指标(pH、盐度、温度),并使用照度计(嘉定学联ZDS-10型)测量培养水体表面光照度。
1.4 数据分析
采用单因素方差方法分析造流对各取样时间点上藻细胞密度、培养水体温度、pH及盐度的影响,之后采用S-N-K多重比较方法对各功率造流水平间进行多重比较。利用相关分析对培养水体的pH与藻细胞密度进行相关性分析,并进行回归分析。所有统计分析均在SPSS 17.0中完成,P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 不同造流程度对小新月菱形藻培养密度的影响
各试验组藻细胞密度随培养时间的变化见图2。造流对藻细胞培养密度的提升具有明显效果,试验开始后第3 d上午(3 M),3个造流组内藻细胞密度即显著高于对照组(P<0.05),但3个造流组间无显著差异。自第4 d上午(4 M)开始,12 W造流组内藻细胞密度显著高于6 W和3 W造流组,后二者间无显著差异。自第5 d上午(5 M)开始至试验结束,4个组(3个造流组和1个对照组)两两之间均存在显著差异,藻细胞密度均依次为12 W>6 W>3 W>对照组。第6 d后,对照组的藻细胞密度开始下降,而3个造流组仍保持上升趋势,至第6 d傍晚(6 E)收获时,3、6 W和12 W 3个造流组内藻细胞密度分别为(116.7±4.5)×104个/mL、(133.8±4.0)×104个/mL和(144.5±3.8)×104个/mL,分别较对照组内藻密度(76.3±4.7)×104个/mL提高53.1%、74.6%和93.1%。
2.2 培养水体状态
造流组培养水体在造流作用下不停翻滚,且翻滚速度随造流功率的增加而加快。强光照射下,对照组培养水体可观察到颗粒状结块,造流泵组培养水体呈现出烟雾状,无颗粒状结块形成(图3)。

图2 各试验组小新月菱形藻细胞密度随时间的变化Fig.2 Changes in cell density of alga N. closterium f. minutissima with cultivation time in various groups同一个时间点上,标注不同小写字母表示差异显著(P<0.05),下同.Means with different letters in the same time are significantly different (P<0.05); et sequentia.

图3 对照组(a)与造流组(b)培养水体状态Fig.3 Culture water status in control group (a) and flow making group (b)
2.3 造流对小新月菱形藻培养水体水质因子的影响
培养水体的温度随昼夜时间产生波动,每日上午温度逐渐升高,到傍晚温度达到最高(图4)。方差分析结果表明,从第1 d傍晚(1 E)开始到试验结束,造流始终显著影响培养水体的温度(P<0.05)。对照组温度始终最低,且始终显著低于12 W造流试验组的温度(P<0.05);自第5 d开始至试验结束,6 W造流组的温度始终显著高于对照组(P<0.05),而3 W造流组仅在第5 d中午、傍晚(5 N、5 E)和第6 d中午(6 M)等时间点显著高于对照组;从培养的第4 d开始,3个造流组间的温度在大多数时间点上差异显著(P<0.05),12 W造流组最高,6 W次之,3 W最低。至培养结束,各组水温依次为12 W[(19.91±0.41) ℃]>6 W[(19.48±0.15) ℃]>3 W[(19.11±0.13) ℃]>对照组[(18.66±0.14) ℃]。
各试验组培养基pH随培养时间的变化见图5。培养过程中各组培养水体的pH均呈逐渐升高趋势。培养开始后的前4 d,各组pH无显著差异。第5 d后至试验结束,造流对培养水体pH具有显著影响,对照组pH始终显著低于12 W造流组(P<0.05);从第5 d中午(5 N)开始,对照组pH始终显著低于各造流组(P<0.05),各造流组间无显著差异。至试验结束,各组pH依次为6 W(10.02±0.10)>3 W(9.98±0.09)>12 W(9.94±0.11)>对照组(9.34±0.12)。

图4 各试验组培养水体温度随时间的变化Fig.4 Changes in water temperature in culture medium in various groups with cultivation time
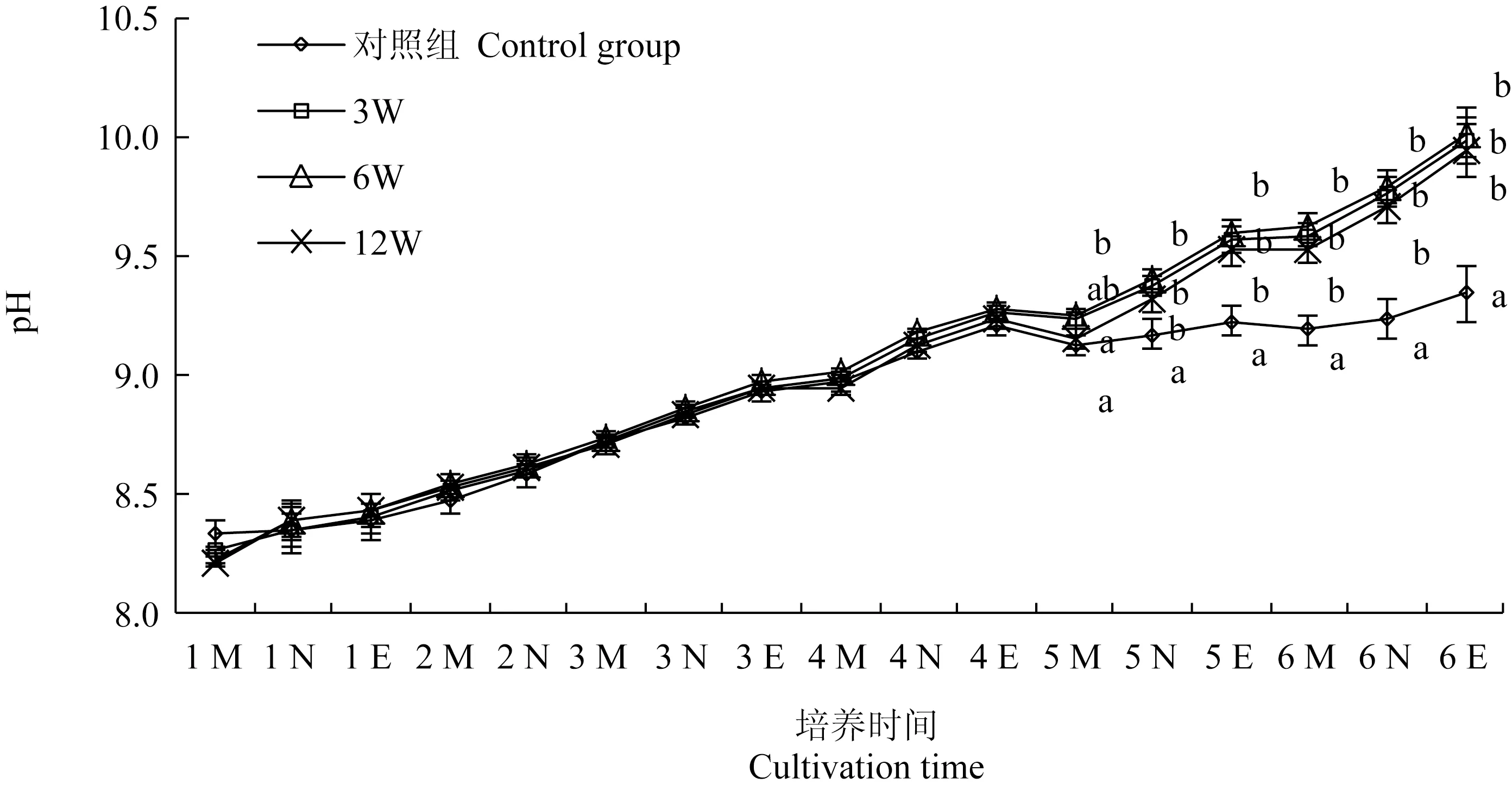
图5 各试验组培养基pH随时间的变化Fig.5 Changes in water pH in culture medium in various groups with cultivation time
各组培养基盐度随培养时间的变化见图6。培养过程中各组培养水体的盐度均呈缓慢升高趋势,但变化幅度不大,为32.93~33.59。从培养第1 d中午(1 N)开始至试验结束,12 W造流组的盐度始终最高,在第5 d后的大部分时间点均显著高于对照组(P<0.05);6 W和3 W造流组培养水体的盐度与对照组均无显著差异。
2.4 小新月菱形藻培养密度与培养水体pH的相关分析
培养水体pH与藻细胞密度之间的相关性分析见表1。4个试验组的藻细胞密度和培养水体pH间的相关系数为0.923~0.975,各相关系数均达到极显著水平(P<0.01)。造流组培养水体pH与藻密度间的相关系数高于对照组。
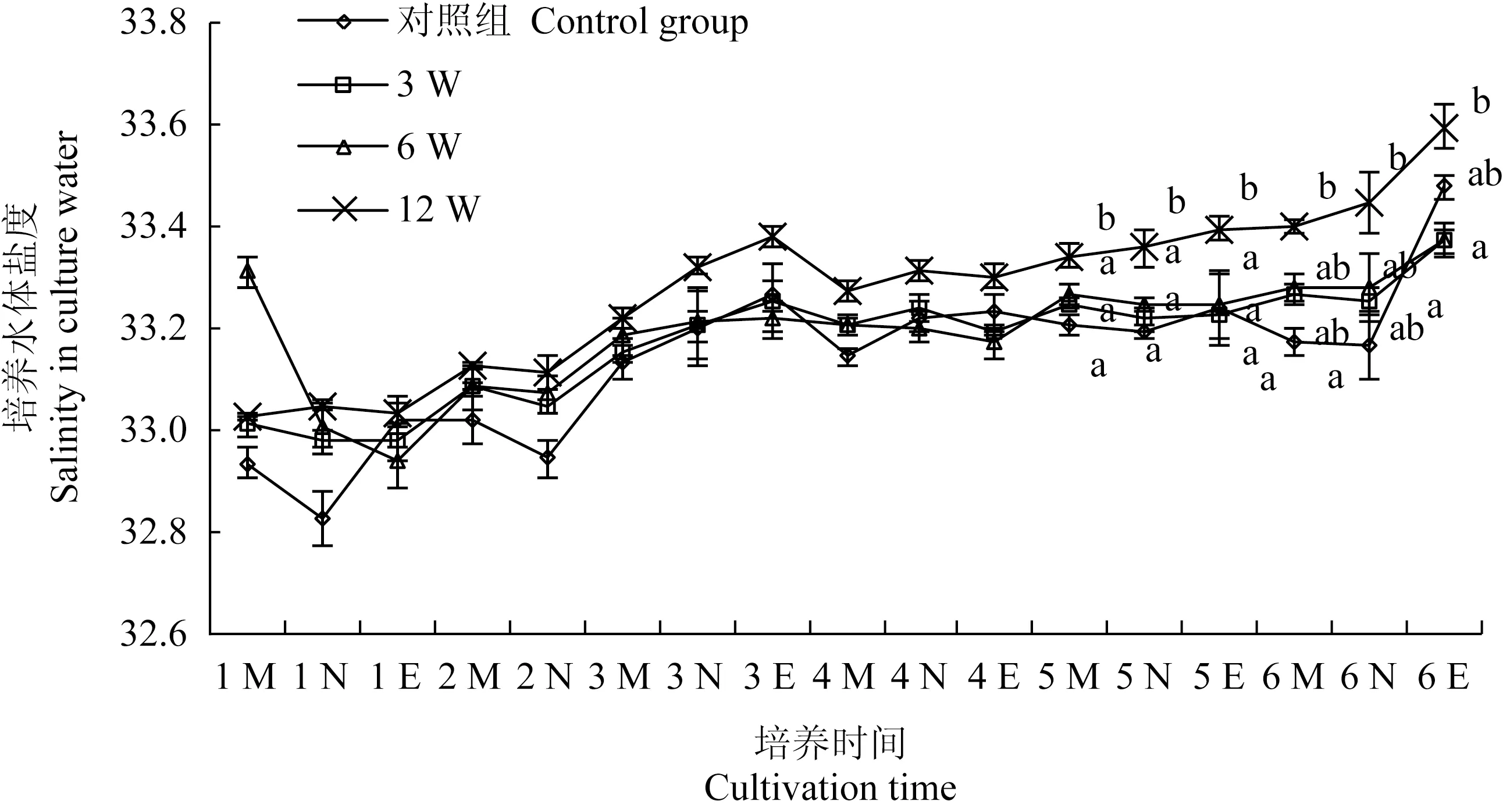
图6 各试验组培养基盐度随时间的变化Fig.6 Changes in water salinity in culture medium in various groups with cultivation time

表1 培养水体pH与藻细胞密度之间的相关性分析Tab.1 Correlation analysis between culture water pH andalgal cell density
回归分析结果表明,藻细胞密度(y)和pH(x)呈二次曲线回归关系,对照组中藻细胞密度和pH的二次回归方程为y=21.822x2-309.26x+1067.3(r2=0.8588)(图7a);3 W试验组中藻细胞密度和pH的二次回归方程为y=-28.421x2+588.69x-2926.2(r2=0.9663)(图7b);6 W试验组中藻细胞密度和pH的二次回归方程为y=-20.096x2+444.46x-2300.2(r2=0.9685)(图7c);12 W试验组中藻细胞密度和pH的二次回归方程为y=-026.499x2+565.89x-2861.1(r2=0.9525)(图7d)。
3 讨 论
3.1 造流对小新月菱形藻生长的影响
造流显著提高了小新月菱形藻的培养密度,至收获时,3、6 W和12 W 3个造流组内藻细胞密度分别较对照组提高53.1%、74.6%和93.1%。造流组藻细胞密度显著提高的主要原因应该是造流打破了静水培养条件下的培养水体的光衰减规律,提高了藻细胞的光暗交替频率。在微藻的培养过程中存在光衰减现象,藻密度和光程的增加会使光衰减程度大幅增加[10-12]。孙颖颖等[10]研究表明,OD680值为0.664的小新月菱形藻,光程为7 cm时的光衰减程度就高达70.8%,而当OD680达到1.435时,5 cm以上的光程后几乎无光;耿金峰等[13]研究表明,13 cm光程反应器南北摆放时可有效提高眼点拟微绿球藻(Nannochlorisoculata)的产量。本研究中的对照组是水产动物饵料生产中普遍使用的方式,此方式除了每日几次的搅动,大部分时间为静水培养模式,在培养早期(如第3 d中午以前,图2),由于藻细胞密度较低,光衰减现象不明显,藻细胞能保持较快的生长速度,因此与造流组无显著差异,而随着藻细胞密度的增加,光衰减程度加剧,在不搅动的情况下,培养水体内的大部分微藻细胞只能接受到非常弱的光照甚至不能接受到光照,因此生长出现光能限制[14];相对于对照组,造流组增强了藻细胞在光照方向上的混合,藻细胞的光暗交替频率大幅提高,因此生长速度得到显著提高。造流功率的增加加快了藻细胞在光照方向上的混合速度从而提高了藻细胞的光暗交替频率,这一优势在藻密度升高后(第4 d中午后,图2)更加明显,因此藻细胞的生长速度会随着造流功率的升高显著增加。王艳等[8]研究发现,搅动提高了球形棕囊藻囊体内细胞的生长速度,但搅动程度之间并不存在显著差异,原因是其使用的是1000 mL锥形瓶,藻细胞的生长受光衰减的影响较小。诸发超等[15]通过研究敞开式跑道池光生物反应器内的粒子运动轨迹,发现仅依靠蹼轮使培养水体在跑道池内流动,藻细胞的运动方向始终为水平,没有光暗区之间的交换,而在此基础上增加充气后,藻细胞的运动方向为螺旋运动,光暗交替频率显著提升,藻细胞生长速度显著提高。可见,向敞开式培养水体中设置造流泵优于仅设置蹼轮或类似的机械臂,可同时实现蹼轮结合充气的功能。由于设置造流泵的方式简单易行,因此此方法非常适用于提高水产动物育苗过程中的饵料培养效率。根据本试验结果,可在藻细胞密度低于60×104个/mL时使用低功率的造流泵(3 W/200 L),在高于该密度后,使用高功率造流泵(12 W/200 L),以节约能源。
3.2 造流泵对培养水体状态及水质因子的影响
造流组培养水体中的藻细胞呈现出烟雾状态(图3a),而对照组中出现颗粒状结块(图3b),这种颗粒结块可能是藻细胞与其代谢产物等杂质凝结而成,其对饵料培养和使用十分不利,它们会成为细菌及原生动物的培养基,从而导致饵料培养失败,即使可用于投喂,也会在投喂后很快沉入池底,降低饵料效果。造流组内由于培养水体的快速流动使藻细胞不易与培养基中的杂质凝结,有效避免了结块的形成,因此提高了饵料质量和使用效果。
工厂化微藻饵料车间为达到采光需求,多采用透明材质房顶,这使得饵料车间保温性低,昼夜温差较大。本试验中也使用了相同的饵料车间,由于培养水体较小,各组培养水体的温度随昼夜产生波动:每日早上开始逐渐升温,傍晚时达到最高,次日早上又回落至最低(图4)。造流组的升温或降温速度与对照组基本一致,表明造流并未明显加速培养水体与空气之间的热交换。造流组尤其是12 W和6 W造流组在多个时间点上的温度显著高于对照组,这可能是由于造流泵发热所致。李炳乾等[16]研究认为,小新月菱形藻的最佳生长温度为15~20 ℃,梁英等[17]研究认为,小新月菱形藻生长适宜温度为10~25 ℃,最适温度为20 ℃,因此,本试验中大部分时间内各培养水体的温度(14~19 ℃)属小新月菱形藻的最佳生长温度。在此温度范围内,藻细胞的生长速度将随温度的上升而逐渐升高,从这一角度看,造流组内小新月菱形藻的生长速度快还得益于温度的升高。本试验中各培养水体的pH随培养时间的增长有较大幅度的升高(图5),这是由于微藻进行光合作用时除了直接利用CO2外,还以HCO3-的形式利用CO2[18],随着藻细胞密度的增加,培养水体对空气中CO2的捕获能力变强,CO2与水体中的H+结合造成了OH-浓度的增加,因此使pH升高[19-22]。从第5 d中午(5 N)到试验结束,造流组的pH始终显著高于对照组,这应该是由于藻细胞密度增加后,造流组和对照组受光衰减影响的程度不同从而造成二者光合作用效率的不同所致:造流组受光衰减影响程度较低,藻细胞始终保持较强的光合作用(图2),因此培养水体的pH保持了原来的升高速度,而对照组受光衰减影响大,光合作用快速减弱,因此培养水体pH升高的速度也快速下降。孟范平等[23]研究发现,小新月菱形藻可在pH 4~8内正常生长。本研究中小新月菱形藻在pH接近10的培养水体中仍能快速生长,因此可认为小新月菱形藻对较高的pH也有较强的耐受能力。Zhu等[24]研究表明,pH升高后的培养水体能从空气中捕获更多的CO2从而更有利于微藻的光合作用和生长,即pH升高和CO2利用可形成良性循环,在这一良性循环中,通过造流以保持高的光合作用效率可能对藻细胞的持续快速生长起到重要作用。在培养过程中各组的盐度均呈缓慢升高趋势,这应该是培养水体蒸发所致。从开始培养到收获,各组盐度变化值均较小(图6),说明各组培养水体的蒸发量均较低。12 W造流组的盐度始终最高,在第5 d后的大部分时间点均显著高于对照组,这应该与该组培养水体温度高,蒸发量较大所致。尽管12 W造流组盐度最高,但与各组差值不足0.2,因此蒸发量的差异几乎不会对藻细胞的密度测量带来误差。
各组的藻细胞密度均和培养水体的pH极显著相关,这与张青田等[25]对铜绿微囊藻的研究结果一致。本研究利用回归分析得到了利用pH预测藻密度的回归模型,相对于对照组,3个造流组的预测模型的决定系数r2更高,这表明在造流情况下获得的回归方程预测准确性更高。
4 结 论
在微藻敞开式培养中进行造流能显著提高微藻的生长速率,3、6 W和12 W 3个造流组内藻细胞密度分别较对照组提高53.1%、74.6%和93.1%,这得益于造流能提高藻细胞的光暗交替频率,并能进一步提高pH以增加CO2的利用效率。此外,造流还能消除饵料结块现象,提高饵料的质量和利用效率。由于造流简单易行,该方法适用于提高水产动物育苗过程中饵料培养的效率,在实际使用中,根据微藻的生长逐渐增大造流泵的功率预计将取得更好的培养效果。
