仿刺参—中国明对虾—斑节对虾混养下水体微生物组成和多样性
2020-11-19关晓燕蒋经伟田甲申周遵春王旭达
关晓燕,王 摆,蒋经伟,田甲申,董 颖,周遵春,王旭达
( 1.大连海事大学,环境科学与工程学院,辽宁 大连 116023;2.辽宁省海洋水产科学研究院,辽宁省海洋水产分子生物学重点实验室,辽宁 大连 116023 )
水产养殖环境具有极高细菌丰度,这些细菌在水产养殖过程中发挥着重要作用[1],其中有的能够加速残留饵料和粪便的分解[2],有的能够将非离子氨、亚硝态氮、硫化氢等有毒的物质转化为低毒性或无毒性的物质[3],有的会导致养殖动物死亡[4]等。因此,研究水产养殖环境细菌群落的多样性和组成结构,在养殖过程中提高养殖效率、减少病害发生、控制环境污染等方面均有十分重要的意义。近年来,随着分子生物学技术的不断发展,越来越多的研究者开始使用高通量测序技术研究水产养殖环境中的不可培养微生物以及环境微生物的整体组成结构,如凡纳滨对虾(Litopenaeusvannamei)生长过程中肠道菌群的变化规律、养殖池塘原核和真核微生物的组成及分类学差异和疾病发生与其肠道菌群结构的关系等研究[5-7]。截至目前,针对水产养殖环境细菌群落的研究依然大多集中在单一养殖物种模式,对多物种混合养殖系统关注较少。
辽东湾位于渤海东北部,作为辽河和大凌河的入海口,适宜的气候条件以及河流带来的丰富营养物质使其成为了发展海水养殖产业的绝佳区域。由于具有环境友好、营养物质可循环利用、经济效益高等特点,多品种的混合养殖目前已经成为了辽东湾地区主要的养殖模式[8]。其中,仿刺参(Apostichopusjaponicus)—中国明对虾(Fenneropenaeuschinensis)—斑节对虾(Penaeusmonodon)(A.F.P)的混合养殖作为新兴的一种养殖模式,在辽东湾地区得到了大力的发展和推广,虽然该养殖模式在水产品产出和经济效益方面取得了成功,但是对于这种养殖模式的基础理论研究,尤其是养殖环境微生物群落罕有研究。鉴于此,笔者通过高通量测序手段,分析仿刺参—中国明对虾—斑节对虾混合养殖过程中池塘水体细菌群落组成及其变化规律,旨在为更好地理解和改进该养殖模式提供理论指导。
1 材料与方法
1.1 养殖池塘情况
试验池塘位于辽宁省辽东湾沿岸某水产养殖场,池塘养殖面积约3.33 hm2,养殖期间水深1.5 m。仿刺参采取轮放轮捕方式,每年5月投苗,放苗量525 kg/hm2;每年春季或秋季收获1次,捕大留小,年产量约750 kg/hm2;中国明对虾放苗时间为5月中旬,放苗密度为30 000尾/hm2;斑节对虾放苗时间为5月底,放苗密度为7500尾/hm2。养殖期间不投饵。中国明对虾和斑节对虾养殖进行到9月底捕捞收获,仿刺参养殖继续进行。
1.2 样品采集和DNA提取
2018年6—9月,每月15日前后参照水生微生物采集方法[9]采集养殖池塘水体样本1次,每次固定在池塘的中心采集表面下方10 cm处的水样5 L,样品采集后,立即置于冰盒中并于12 h内运送至实验室。
1.3 样品处理与DNA提取
水体样品运送到实验室之后,立即使用0.22 μm微孔滤膜真空过滤收集其中的细菌细胞。将过滤后的滤膜保存在5 mL离心管中,液氮速冻3~5 min,转移至冰箱中-80 ℃保存备用,接着将滤膜充分剪碎(使样品表面菌群更好地与裂解液接触)置于1.5 mL灭菌离心管中,加入裂解液,使其释放DNA,随后使用PowerWater®DNA Isolation Kit (MOBIO,USA)按照说明书的步骤提取滤膜上富集细菌的DNA,提取得到的DNA用1%的琼脂糖凝胶电泳检测其完整性,同时使用NanoPhotometer®Classic Launched (IMPLEN,GER)测定其含量和纯度,所有提取成功的DNA样品-20 ℃保存备用。
1.4 16S rRNA扩增子测序
应用含有Illumina接头和barcode序列的引物341F-806R[10]扩增所有提取DNA样品中的16S rRNA基因的V3~V4可变区,所有的PCR反应体系均为30 μL,其中包括15 μL的Phusion®High-Fidelity PCR Master Mix (New England Biolabs)、0.2 μmol/L的引物和1 μL的模板DNA。PCR反应过程如下:98 ℃预变性1 min;之后98 ℃变性10 s,50 ℃退火30 s,72 ℃延伸30 s,30个循环。用2%的琼脂糖凝胶电泳检测PCR产物,使用QIAquick Gel Extraction Kit (QIAGEN, GER)通过切胶回收的方式纯化400~450 bp规格的PCR产物主带,纯化后的PCR产物应用NanoPhotometer®Classic Launched (IMPLEN, GER)测定其含量和纯度,之后每一个样品对应的PCR产物根据其含量进行等量混合构建测序文库。使用Qubit®2.0 Fluorometer (Thermo Scientific)和Agilent Bioanalyzer 2100 system检测文库的质量,最后应用IlluminaHiseq测序平台以PE250 bp策略对文库进行测序。
1.5 数据处理
首先对测序得到的原始序列进行质量控制,去除质量得分低于20、含有模糊碱基、引物出现错配或者长度少于150 bp的序列,剩余的序列根据barcode识别其所属的样品随后去除barcode和引物序列。应用FLASH软件[11]将重叠区域大于10 bp并且没有任何碱基错配的paired-end序列拼接为tags,使用QIIME软件[12]对tags进行聚类,相似度大于97%的tags归属于同一个运算分类单元(OTU),应用默认的参数从每个运算分类单元中挑选其代表序列,之后使用Ribosomal Database Project (RDP) classifier根据Greengenes数据库进行分类学注释,最后根据每一个运算分类单元所包含的序列数目及其分类学注释结果计算各样品细菌群落中从门至属水平的组成及其相对丰度。
1.6 生物信息学分析
应用PAST v3.0软件[13]计算各个样品细菌群落的α-多样性指数,包括Chao1、ACE、Shannon和Simpson指数。使用QIIME计算各样品细菌群落结构的加权Unifrac距离并进行非加权配对平均法聚类(UPGMA)以评估各样品细菌群落的整体差异。使用R语言平台的“ggplot2”软件包绘制各样品从门至属水平主要物种的相对丰度柱形图。
2 结 果
2.1 仿刺参—中国明对虾—斑节对虾养殖池塘水体中细菌群落的分类学注释和α-多样性分析
应用高通量测序技术研究了仿刺参—中国明对虾—斑节对虾混养系统完整养殖周期的细菌群落变化,结果见图1。在配对序列拼接和质量控制之后,共得到了191 956条tags用于细菌群落组成的分析,各样品tags的数目为43 228~52 975条,平均每个水体样品tags 47 989条。这些测序得到的tags按照97%的相似性被聚类为运算分类单元(每个运算分类单元代表1个不同的菌属),共聚类得到1332个运算分类单元,各样品运算分类单元的数目为753~1003,平均每个水体样品含有882个运算分类单元。根据每个运算分类单元的代表序列,对其进行了从门至属水平的分类学注释,这些检测到的细菌分别属于35个门、70个纲、110个目、187个科和336个属。

图1 仿刺参—中国明对虾—斑节对虾养殖池塘水体微生物群落高通量测序得到的序列数目和运算分类单元数目Fig.1 Statistics of sequences and OTUs of different samples in the polyculture of sea cucumber with Chinese shrimp and tiger shrimp, A.F.P. systemPJ3w. Jun, PJ3w. July, PJ3w. Aug, PJ3w. Sep分别指6、7、8、9月采集的仿刺参—中国明对虾—斑节对虾养殖池塘水样,下同.PJ3w refers to the water samples from the A.F.P. polyculture system, and Jun, Jul, Aug, and Sep refer to the sampling time, respectively.
仿刺参—中国明对虾—斑节对虾养殖池塘水体样品细菌群落的α-多样性指数结果见表1。在计算得到的α-多样性指数中,Chao1和ACE用于评估样品细菌群落的物种丰富度,而Shannon和Simpson用于评价细菌群落的多样性。物种丰富度是指细菌群落中含有多少种细菌,其并不计算各个细菌在群落中所占的比例[14],多样性指数在计算的过程中同时考虑了物种的丰富度和各细菌在群落中的丰度[15]。无论是丰富度还是多样性指数,6月和7月的水体样本均低于8月和9月,即养殖后半段(8—9月)的池塘水体具有更高的细菌种类和更均一的细菌丰度分布。

表1 仿刺参—中国明对虾—斑节对虾混养池塘水体微生物群落α-多样性指数表Tab.1 α-diversity indices of microbial communities in water in the A.F.P. polyculture system
2.2 仿刺参—中国明对虾—斑节对虾养殖池塘水体中细菌群落结构随时间的变化
2.2.1 仿刺参—中国明对虾—斑节对虾养殖水体中细菌群落结构聚类和主要门水平微生物相对丰度
通过基于加权Unifrac距离的UPGMA聚类评估了不同时间样品细菌群落结构的整体差异,结果见图2。试验结果表明,养殖前半段(6—7月)样品的细菌群落聚为一类,而养殖后半段(8—9月)样品的细菌群落聚为另外一类,这与α-多样性指数的结果相同,说明养殖前半段和养殖后半段池塘水体细菌群落具有明显的差异。
此外,仿刺参—中国明对虾—斑节对虾养殖水体中主要细菌为变形菌门 (51.5%),其次为放线菌门(23.6%)、拟杆菌门(11.3%)和厚壁菌门(9.1%)。养殖前半段水环境中变形菌门的丰度要明显高于养殖后半段,在6—7月样品中变形菌门的丰度分别为57.7%和61.9%,而在8—9月样品中则降至47.3%和39.2%。放线菌门在仿刺参—中国明对虾—斑节对虾池塘水体中的丰度仅次于变形菌门,其在6月至9月的样品中,丰度依次为21.9%、15.1%、26.6%和30.8%,呈现出先降低后升高的趋势。拟杆菌门是丰度排名第3的细菌门,在6月至9月的样品中,其丰度分别为12.0%、14.9%、8.9%和9.5%,与放线菌门相反,拟杆菌门的丰度呈先升高后降低的趋势。此外,在养殖后半段的水体中,厚壁菌门的丰度明显高于养殖前半段,其丰度由6月至9月依次为5.4%、5.3%、11.1%和14.6%。

图2 仿刺参—中国明对虾—斑节对虾养殖水体中细菌群落结构UPGMA聚类(左)和主要门水平微生物相对丰度(右)Fig.2 UPGMA cluster (left) and relative abundance of bacteria at phylum level (right) in water in A.F.P. polyculture
2.2.2 仿刺参—中国明对虾—斑节对虾养殖水体中细菌群落主要纲水平微生物相对丰度
对仿刺参—中国明对虾—斑节对虾池塘水体纲水平微生物相对丰度进行分析,试验结果见图3。试验结果表明,α-变形菌纲和γ-变形菌纲是变形菌门的主要组成成分,养殖前半段α-变形菌纲的丰度较高,其在6月和7月样品中的丰度分别为30.0%和40.5%,而在8月和9月样品中则只有23.9%和24.7%,这也是变形菌门养殖前半段丰度较高的原因。γ-变形菌纲与α-变形菌纲不同,其在9月的水体中丰度最低,只有10.0%,而在其余时间的样品中丰度为18.4%~22.3%。放线菌门中酸微菌纲在养殖后半段丰度突然上升,从6月和7月的1.9%与2.1%上升至8月和9月的13.4%与18.2%。拟杆菌门中黄杆菌纲的丰度从6月样品中的8.1%降至其他时间样品中的约3%,而7月样品中1种未被鉴定的拟杆菌纲富集(9.9%,其他时间只有1.2%~2.9%),二者共同造成了拟杆菌门丰度前高后低的变化规律。
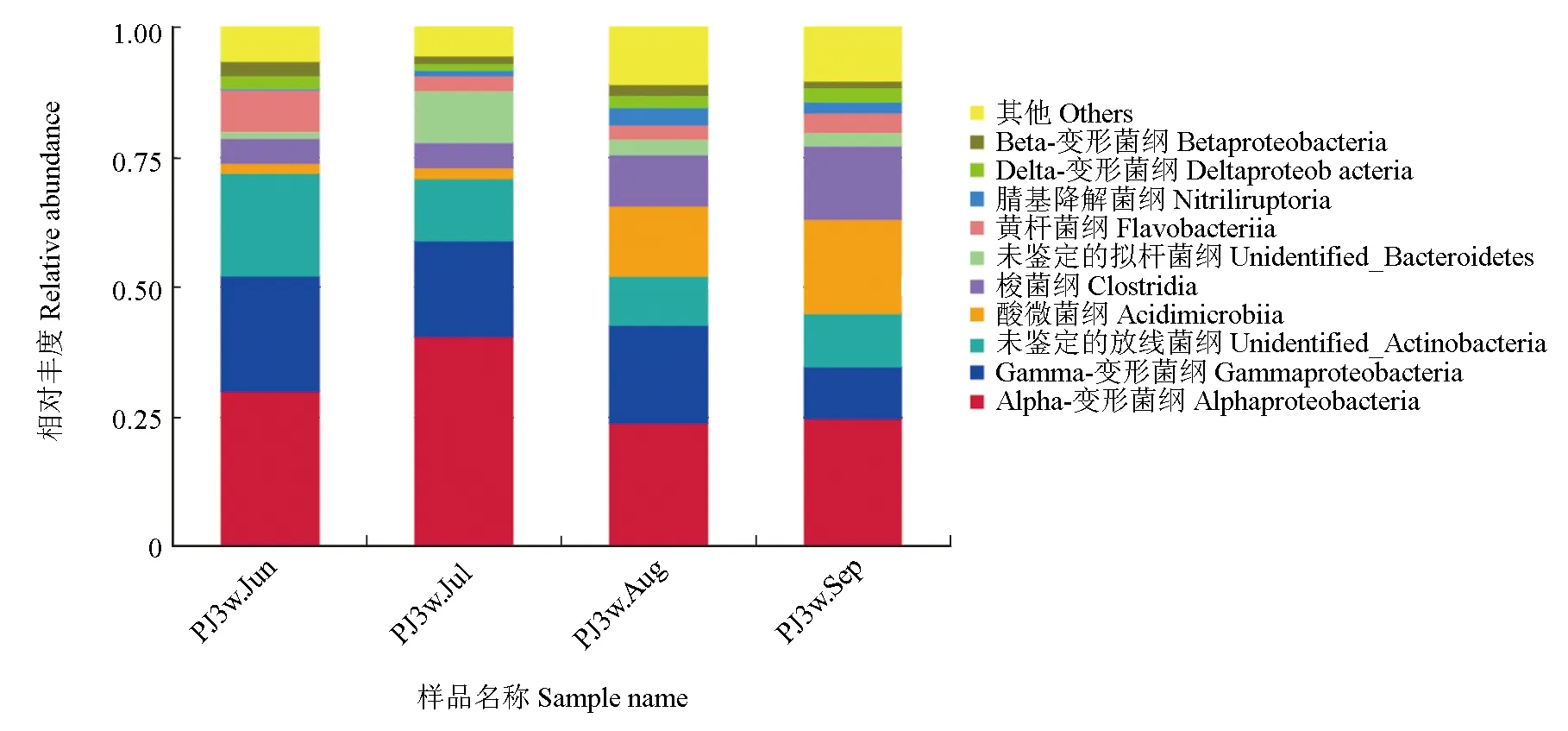
图3 仿刺参—中国明对虾—斑节对虾养殖水体中细菌群落主要纲水平微生物相对丰度Fig.3 The relative abundance of bacteria at class level in water in A.F.P. polyculture
2.2.3 仿刺参—中国明对虾—斑节对虾养殖水体中细菌群落主要属水平微生物相对丰度
对仿刺参—中国明对虾—斑节对虾养殖水体中细菌群落主要属水平微生物相对丰度进行分析,试验结果见图4。试验结果表明,α-变形菌纲中丰度最高的属为远洋杆菌属(Pelagibacter),其在7月样品中所占的丰度明显高于其他时间(7月样品为23.0%,其余时间仅约为10%)。养殖前3个月γ-变形菌纲的丰度较高,但不同时间水体中γ-变形菌纲的组成并不相同,6月样品中的γ-变形菌纲主要是Halioqlobus,其丰度为7.7%,而在其余时间只有不到1%;7月样品中的γ-变形菌纲主要为假交替单胞菌(Pseudoalteromonas),其丰度为7.8%,在其余时间只占0.1%~1.3%;8月样品中的γ-变形菌纲主要为假单胞菌(Pseudomonas)和不动杆菌(Acinetobacter),丰度分别为4.5%和4.0%,而这2种细菌在其余时间样品中均未检出。

图4 仿刺参—中国明对虾—斑节对虾养殖水体中细菌群落主要属水平微生物相对丰度Fig.4 The relative abundance of bacteria at genus level in water in A.F.P. polyculture
3 讨 论
3.1 不同养殖品种混养水体中微生物群落组成和多样性差异
近年来,不同养殖品种混养水体中微生物群落的组成成分的研究已有较多报道。Li等[16]测定了江苏省连云港市沿海地区对虾、螃蟹和贝类混养池塘水体中微生物群落组成,证实该养殖模式中主要微生物依次为变形菌门、绿弯菌门、放线菌门、厚壁菌门和酸杆菌门;林玉荣等[17]测定了福建省莆田市海水虾蛤混养池塘水体中微生物群落组成,结果显示,该养殖模式中以放线菌门、变形菌门和拟杆菌门为主;Zhao等[18]分析了辽东湾沿海斑节对虾、海蜇(Rhopilemaesculenta)和菲律宾蛤仔(Ruditapesphilippinarum)养殖池塘水体微生物群落组成,发现变形菌门、放线菌门、酸杆菌门和嗜热菌门是占优势地位的微生物;Gao等[19]在辽东湾另一种中国明对虾、海蜇、缢蛏(Sinonovaculaconstricta)混养池塘的水体微生物群落中测定发现,丰度排名前三的微生物分别为变形菌门、放线菌门和拟杆菌门。本试验结果表明,在仿刺参—中国明对虾—斑节对虾混养水体的微生物群落组成中,主要的微生物依次为变形菌门、放线菌门、拟杆菌门和厚壁菌门。上述研究表明,在不同的水产养殖系统中,变形菌门均为丰度最高的微生物,但其他微生物的种类和丰度会受到养殖物种、养殖操作方式以及养殖地域等因素的影响,从而导致不同养殖系统中微生物群落的组成结构各不相同。
此外,在仿刺参—中国明对虾—斑节对虾混养水体中,微生物群落聚为两类,养殖前半段和养殖后半段的微生物群落组成结构和物种丰富度及多样性具有明显差异。本试验前期针对辽东湾地区斑节对虾—海蜇—菲律宾蛤仔混养进行了研究[18],该养殖模式与仿刺参—中国明对虾—斑节对虾类似,均是在每年5月底投放虾苗直至9月收获,该养殖模式水体微生物群落的多样性和组成结构的变化规律与本研究不同,在斑节对虾—海蜇—菲律宾蛤仔养殖模式中,不同时间水体微生物群落的组成结构各不相同,同时,其水体微生物群落的丰富度和多样性指数没有明显的养殖时间特征,其丰富度指数在养殖过程中没有明显变化,多样性指数也只是在8月有所提升。以上研究结果表明,养殖池塘内的微生物群落组成及其变化规律,具有养殖品种特异性。
3.2 仿刺参—中国明对虾—斑节对虾养殖模式微生物群落组成参与控制水体富营养化
在海水池塘养殖过程中,养殖水体的富营养化以及藻类的大量繁殖可能对养殖动物的生存造成威胁。在仿刺参—中国明对虾—斑节对虾混养水体中,远洋杆菌属是丰度最高的微生物属。据报道,远洋杆菌是海洋环境中一种常见的典型贫营养微生物,主要生活在低营养水平的环境中,以溶解性的有机碳和有机氮为底物进行生长和繁殖[20-21]。本试验结果显示,在养殖进行到7月时,仿刺参—中国明对虾—斑节对虾混养水体中远洋杆菌的丰度达到了峰值,预示着此时养殖水体中营养物质含量可能较低。此外,假交替单胞菌在仿刺参—中国明对虾—斑节对虾养殖进行到7月时也出现了明显的富集。众所周知,假交替单胞菌主要附着于高等真核生物,尤其是藻类等海洋植物表面[22],能够分泌胞外酶、毒素、抗生素、多糖等多种胞外生物活性物质,抑制藻类孢子萌发、降解藻类细胞、分解植物多糖[23],因此,假交替单胞菌在仿刺参—中国明对虾—斑节对虾养殖池塘内的富集同样有助于过量藻类的降解。Aquiluna是一种含有肌动蛋白的光能异养型微生物,有研究检测到在藻类大量暴发的水产养殖池塘中,通常也伴随着Aquiluna丰度的明显上升[24]。在仿刺参—中国明对虾—斑节对虾养殖过程中,其水体微生物群落中Aquiluna的丰度呈现持续下降的趋势,这一结果也间接表明了仿刺参—中国明对虾—斑节对虾养殖池塘中的微生物群落组成能够有效地抑制藻类的大量繁殖。然而,需要说明的是,虽然从仿刺参—中国明对虾—斑节对虾养殖过程中水体微生物群落的变化能够推测到养殖过程中富营养化相关的信息,但是由于仿刺参—中国明对虾—斑节对虾混养是一种新兴的养殖模式,目前关于该养殖模式的相关研究非常有限,尚未见有关于养殖过程中池塘水环境营养物质及藻类水平的相关报道,有待于后续针对仿刺参—中国明对虾—斑节对虾养殖模式进行更为深入和全面的研究。
3.3 仿刺参—中国明对虾—斑节对虾养殖模式微生物群落参与水质净化过程
假单胞菌具有很强的有机物分解和转化能力,因此其在环境污染生物修复中的应用已成为近年来的研究热点问题[25-26]。例如,铜绿假单胞菌(P.aeruginosa)YY24可以提高凡纳滨对虾养殖过程中的存活率和质量增加率,同时还能够净化水质,提高水体pH,降低氨氮、硝态氮、亚硝态氮的含量[27]。铜绿假单胞菌OP2能够分解不溶于水的含磷物质,使其成为可溶性磷,更加便于养殖动物吸收,还能有效去除水体中残留的氨氮和亚硝态氮[28]。本试验结果显示,在仿刺参—中国明对虾—斑节对虾养殖后期,水体中假单胞菌属丰度的上升,可能有利于养殖动物的存活和生长及净化水质。
此外,梭状芽孢杆菌(Clostridium)的丰度在仿刺参—中国明对虾—斑节对虾养殖后半段出现了明显富集。据报道,丁酸梭状芽孢杆菌(C.butyricum)可以有效地帮助日本沼虾(Macrobrachiumnipponense)抵抗亚硝态氮所造成的压力,同时能够明显提升其超氧化物歧化酶和过氧化氢酶的活性[29],这预示着仿刺参—中国明对虾—斑节对虾养殖水体中的梭状芽孢杆菌可能有助于提升养殖对虾抵抗亚硝态氮的能力,保证养殖后半段对虾健康快速生长。
除了梭状芽孢杆菌,在仿刺参—中国明对虾—斑节对虾模式养殖后半段微酸菌纲丰度出现了明显的上升,水环境中微酸菌纲的分布及其丰度要明显高于其他环境介质[30]。有研究发现,部分微酸菌纲的微生物在重金属污染的酸性环境中大量繁殖,并且参与利用铁离子还原介导的氨氧化过程[31]。这说明在仿刺参—中国明对虾—斑节对虾养殖后半段富集的微酸菌纲可能与假单胞菌共同参与水环境中氨氮的转化过程,对于去除养殖池塘内过量的氮、净化水体、提高养殖物种存活率具有十分重要的意义。
4 结 论
本试验通过16S rRNA扩增子的高通量测序考察了仿刺参—中国明对虾—斑节对虾混合养殖池塘水体细菌群落的多样性及丰度变化,发现其中主要的细菌为变形菌门、放线菌门、拟杆菌门、和厚壁菌门。养殖前半段和后半段池塘水体细菌群落具有明显的差异。后半段,池塘水体微生物群落的丰富度和多样性均出现了明显的上升;变形菌门的丰度和拟杆菌门的丰度在养殖前半段要明显高于养殖后半段,放线菌门的丰度呈先降后升的趋势,而厚壁菌门在养殖后半段的丰度要明显高于养殖前半段。
