南盘江破碎生境中子陵吻虾虎鱼的遗传多样性
2020-11-19丁雪梅颜岳辉唐利洲
丁雪梅,颜岳辉,李 强,罗 旭,唐利洲
( 1.西南林业大学,云南省高校极小种群野生动物保育重点实验室,云南 昆明 650224; 2.曲靖师范学院,云南高原生物资源保护与利用研究中心,云南 曲靖 655011 )
生境破碎化一直被认为是导致生物多样性降低的重要因素之一[1],其可能会限制物种的扩散和种内基因交流,增加遗传漂变带来的负面效应,进而影响物种的遗传多样性和遗传结构,最终改变物种的进化潜能并增大局部灭绝的风险[2-5]。研究表明,种群较小、体型较大、营养等级较高、世代周期较长的物种更易受到生境破碎化的威胁[3,6-7],此外,生境破碎化对物种的影响程度还取决于物种的群落结构及分布范围等因素[4,8-9]。作为发源于云贵高原的中国南方第一大河流,珠江以其复杂的地质构造、独特的河谷纵切和良好的水文条件等特征形成了丰富的水生生物资源和鱼类物种多样性[10-14]。然而,珠江也在地形地貌差异、河流不同程度的开发利用和生态环境恶化等因素的综合影响下出现了不同程度的生境破碎化现象。陈艳等[15-16]将珠江分为22个子流域进行研究,发现其上游的南盘江因高原湖泊水库众多、水利设施修建等因素影响出现了最严重的生境破碎化现象。水库大坝的建设创造了自然流水生态系统中的静水栖息地,这为生境破碎化研究提供了良好的模型体系。
在生境高度破碎化的南盘江流域中孕育着丰富的鱼类物种资源,是作为整个珠江水系鱼类物种多样性的重要组成部分。而在河流生态系统中,生境破碎化则被认为是对其水生生物多样性最主要的威胁之一[15,17]。因此,亟待开展南盘江破碎生境中鱼类遗传多样性与物种保护的系统研究,以期为制定合理有效的保护措施提供理论依据。作为南盘江广域性分布的物种,子陵吻虾虎鱼(Rhinogobiusgiurinus)属鲈形目,虾虎鱼亚目,虾虎鱼亚科,吻虾虎鱼属,是一种肉食性底栖鱼类[18-20]。子陵吻虾虎鱼因体型较小、世代较短、生存繁殖能力较强和缺乏较好的经济价值而未受到人类驯化养殖的影响[21-25],从而很好地保留了因生境破碎化等条件变化而留存的遗传学证据,可真实反映其在南盘江破碎化生境中的遗传多样性水平和遗传分化特征。子陵吻虾虎鱼的线粒体基因组已有报道[26],且其有效独立种的分类地位也相继得到了系统分类学家的确立[27-28]。其种群遗传研究也表明,连通水域中的子陵吻虾虎鱼种群差异比较均一[29-30],但子陵吻虾虎鱼在破碎化生境下的遗传分化及机制的相关研究至今尚未见报道。
笔者以分布在珠江上游南盘江破碎生境中的子陵吻虾虎为研究对象,探讨其在生境破碎化作用下的遗传分化水平和群体遗传结构,揭示其遗传多样性和遗传结构的形成过程与影响因素,旨在为南盘江水系破碎生境中小型淡水鱼类的遗传多样性保护提供重要理论依据。
1 材料与方法
1.1 样本的采集
试验用的194尾子陵吻虾虎鱼样本采自南盘江水系的13个相互隔离的水库种群,分别是位于曲靖市麒麟区的潇湘水库、面店水库、独木水库、三宝水库、涨水坡水库、太阳岛水库、沿江水乡;曲靖市富源县的法土水库;曲靖市沾益区的红瓦房水库、西河水库、白浪水库、新屯水库;曲靖市陆良县的响水坝水库(图1)。采集到的样本置于95%的乙醇中固定保存,带回实验室于冰箱4 ℃保存。
1.2 总DNA的提取和PCR扩增
采用动物基因组DNA提取试剂盒抽提总DNA,试剂盒由北京鼎国昌盛生物技术有限责任公司提供。根据GenBank数据库中子陵吻虾虎鱼Cyt b基因序列(AB018997)和COXⅠ基因序列(KU871066)设计PCR扩增引物,引物序列为:Cyt bF:5′-ACCACCGCTGTAATTCAACT-3′,Cyt bR:5′-CTCTGGCGCTGAGCTACTAA-3′;COXⅠF:5′-ATGGGGCTACAATCCACCAC-3′,COXⅠR:5′-AGGTGATGCTGCGTCTTGAA-3′,由生工生物工程(上海)股份有限公司合成。PCR扩增反应体系为50 μL,分别为:2 μL DNA模版,上下游引物各1 μL,25 μL 2×Easy Taq PCR Supermix(TRANSGEN BIOTECH),21 μL ddH2O。反应程序为:95 ℃预变性5 min;95 ℃变性30 s,退火30 s(Cyt b:55 ℃,COXⅠ:58 ℃),72 ℃延伸30 s,31个循环;72 ℃续延伸5 min,最后4 ℃保存。扩增产物混合2 μL 6×Loading buffer经琼脂糖凝胶电泳检测,纯化后的PCR扩增产物由生工生物工程(上海)股份有限公司测序。
1.3 数据分析
利用Chromas 2.62[31]、Seqman[32]对测序结果进行同源排序。用MEGA 6.0[33]对序列进行人工校对。利用DnaSP 5.10[34]统计序列的多态性位点、单倍型多样性、核苷酸多样性及其标准差。
以MrModeltest 2.2[35]估计核苷酸最适模型,以GenBank数据库下载的波氏吻虾虎鱼(R.cliffordpopei) (Cyt b:NC029252,COXⅠ:KP694000)

图1 子陵吻虾虎鱼采集样本的地理信息Fig.1 The geographical information on goby R. giurinus samples
和褐吻虾虎鱼 (R.brunneus)(Cyt b:KT601096,COXⅠ:NC028435)作为外类群,利用MEGA 6.0(Bootstrap,1000)构建子陵吻虾虎鱼COXⅠ基因片段(GTR+I模型)、Cyt b基因片段(GTR+G)及联合基因片段(GTR+I+G)单倍型间的最大似然树。同时利用MrBayes 3.2.5[36]构建子陵吻虾虎鱼COXⅠ基因片段(GTR+I模型)、Cyt b基因片段(GTR+G)及联合基因片段(GTR+I+G)的贝叶斯树,贝叶斯树的构建均运算500万代,每100代取样1次,直到链的收敛,即分裂频率平均标准差小于0.01停止运算。用Tree View 1.6.6[37]查看并编辑贝叶斯树。运行NETWORK 5.0[38]构建子陵吻虾虎鱼的中值连接网络结构。利用MEGA 6.0中的Kimura双参数模型计算群体内和群体间的遗传距离。
利用Arlequin 3.5[39]的分子方差分析[40]模块估算遗传变异在群体间和群体内的分布及遗传分化指数(FST),并进行Tajima′sD和 Fu′sFS中性检验及核苷酸错配分布检验,利用IBD 1.52[41]对遗传距离与地理距离之间的Mantel相关性进行分析。
2 结 果
2.1 序列差异与遗传多样性分析
本试验分析获得194尾子陵吻虾虎鱼1509 bp的COXⅠ基因片段和1098 bp的Cyt b基因片段,联合基因(COXⅠ+Cyt b)DNA序列总长度为2607 bp,并获得基于单基因DNA片段和联合基因序列分析的种群遗传多样性参数(表1)。
COXⅠ基因DNA序列片段共统计出27个变异位点和11个单倍型(登录号:MK858195~MK858205),其中涨水坡水库种群单倍型多样性指数和核苷酸多样性指数最高,分别为0.825和0.0076,红瓦房水库种群的单倍型多样性指数和核苷酸多样性指数最低,分别为0.000和0.0001。基于Cyt b基因序列片段共检测到22个变异位点和13个单倍型(登录号:MK883442~MK883454),其中涨水坡水库种群单倍型多样性指数和核苷酸多样性指数最高,分别为0.803和0.0082,红瓦房水库种群的单倍型多样性指数和核苷酸多样性指数最低,分别为0.000和0.0001。基于联合基因DNA片段共检测到49个变异位点和26个单倍型,其中涨水坡水库种群的单倍型多样性指数和核苷酸多样性指数最高,分别为0.879和0.0078,而红瓦房水库种群的单倍型多样性指数和核苷酸多样性指数同样表现为最低。其次,基于COXⅠ、Cyt b及联合基因DNA序列的子陵吻虾虎鱼群体的单倍型多样性分别为0.691、0.813、0.881,核苷酸多样性分别为0.0053、0.0060、0.0056。根据各个种群间的遗传多样性参数比较发现,线粒体单基因和联合基因片段分析所得的遗传多样性结果是一致的(表1)。

表1 子陵吻虾虎鱼的种群遗传多样性Tab.1 Genetic diversity of goby R. giurinus populations
2.2 系统发育关系进化树和单倍型网络图
基于Cyt b、COXⅠ和联合基因DNA序列,利用最大似然法和贝叶斯法构建子陵吻虾虎鱼的系统发育树,结果均显示,子陵吻虾虎鱼的13个地理种群分化为2个分支(图2),即分支A和分支B。分支A包含了红瓦房水库种群、三宝水库种群、西河水库种群、独木水库种群、沿江水乡种群、太阳岛水库种群、白浪水库种群共7个种群;分支B包含了面店水库种群、法土水库种群2个种群;其余潇湘水库种群、响水坝水库种群、涨水坡水库种群、新屯水库种群4个种群则为2个分支共享。同时,基于Cyt b、COXⅠ和联合基因构建的单倍型网络图(图3),同样支持子陵吻虾虎鱼群体分化为2个分支,且其结论与系统发育树一致。

图2 子陵吻虾虎鱼群体单倍型间的贝叶斯树和最大似然树Fig.2 Bayesian Inference tree and Maximum Likelihood tree of goby R. giurinus haplotypesa.COXⅠ基因; b.Cyt b基因; c.联合基因;分支(/)以上的数字是最大似然树的自举值;而贝叶斯树的自举值显示在分支(/)的下面.a.COXⅠgene; b.Cyt b gene; c.combined gene; the numbers above the branches (/) are the bootstrap values of Maximum Likelihood tree (ML). Bayesian inference tree (BI) bootstrap values are shown under the branches (/).
2.3 种群的遗传距离和遗传分化
基于Cyt b基因序列的种群间遗传距离分析结果显示,子陵吻虾虎鱼种群间的遗传距离为0.000~0.011,其中种群法土水库与白浪水库、独木水库、太阳岛水库间,以及种群独木水库与面店水库间的遗传距离最大(表2)。以COXⅠ基因序列为基础的分析结果表明,子陵吻虾虎鱼种群间的遗传距离为0.000~0.014,其中法土水库与白浪水库、独木水库、太阳岛水库、沿江水乡间,以及面店水库和白浪水库种群间的遗传距离最大(表2)。其次,基于联合基因分析结果显示,子陵吻虾虎鱼种群间的遗传距离为0.000~0.014,种群间的遗传分化系数为-0.026~0.993(表3)。同时,Mantel相关性检验结果显示,子陵吻虾虎鱼种群间的遗传距离与地理距离没有显著相关性(R=0.187,P>0.05),即该物种种群分化受到地理距离隔离的效应不显著。
以单基因和2个基因联合序列进行的分子变异方差分析结果显示,子陵吻虾虎鱼种群间的变异(COXⅠ: 65.95%,Cyt b: 67.80%,联合基因:66.78%)大于种群内的变异(COXⅠ:34.05%,Cyt b:32.20%,联合基因:33.22%)(表4),显著性检验为极显著(P<0.001)。该结果有效说明,南盘江破碎化生境中的子陵吻虾虎鱼存在极显著的种群遗传结构与高水平的遗传分化。
2.4 历史种群动态
对子陵吻虾虎鱼进行Tajima′sD和Fu′sFs中性检验及核苷酸错配分布检验结果显示,其Fu′sFs值和Tajima′sD值分别为-23.8781(P<0.05),2.1920(P>0.05),且其群体的核苷酸错配分布均表现为多峰(图4)。综合上述检测指标得知,子陵吻虾虎鱼群体近期没有经历历史种群扩张,并维持着相对稳定的有效种群数量。
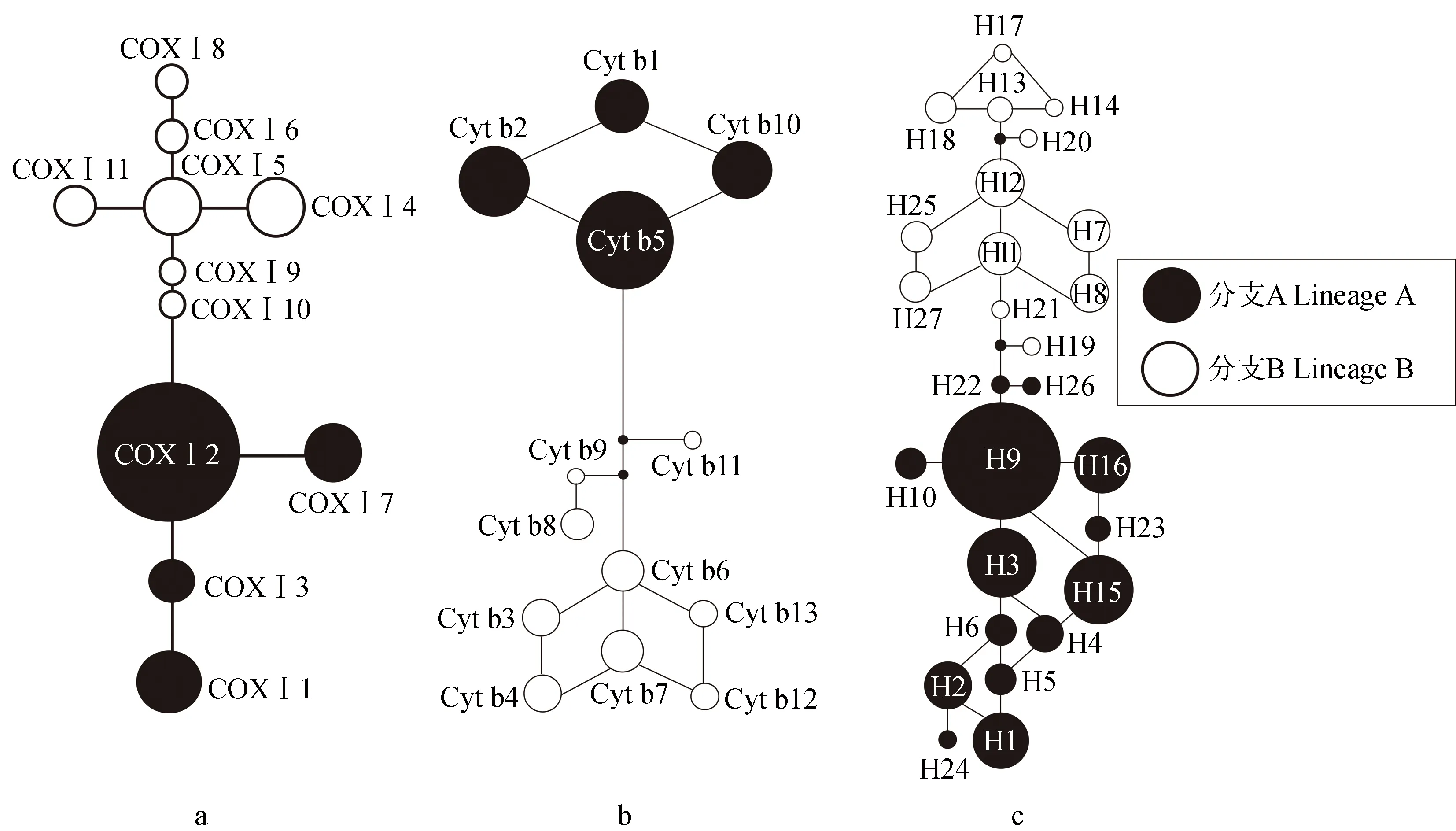
图3 子陵吻虾虎鱼的单倍型网络Fig.3 The median-joining network relationship of goby R. giurinus haplotypesa.COXⅠ基因; b.Cyt b基因; c.联合基因.a.COXⅠgene; b.Cyt b gene; c.combined gene

表2 基于单基因片段子陵吻虾虎鱼种群间的遗传距离Tab.2 The genetic distance among the populations of goby R. giurinus based on single gene fragment

表3 基于联合基因的子陵吻虾虎鱼种群间的遗传分化系数(对角线下)和种群间遗传距离(对角线上)Tab.3 Coefficient of genetic differentiation (under the diagonal) and genetic distance (above the diagonal) among the populationsof goby R. giurinus based on combined genes

表4 子陵吻虾虎鱼的分子变异方差分析Tab.4 Molecular variance AMOVA of genetic variations in goby R. giurinus

图4 子陵吻虾虎鱼有效种群历史动态Fig.4 The demographic history of goby R. giurinusa.COXⅠ基因; b.Cyt b基因; c.联合基因.a.COXⅠgene; b.Cyt b gene; c.combined gene.
3 讨 论
3.1 子陵吻虾虎鱼的遗传多样性
作为生物多样性的3种形式之一,物种的遗传多样性是物种应对自然选择的基础,因此,评估生境破碎化对物种遗传多样性的影响,可以为野生物种种群的保护提供一定的理论依据[42-43]。与珠江中的鳜鱼(Sinipercachuatsi)(单倍型多样性0.773,核苷酸多样性0.0019)[10]、大眼华鳊(Sinibramamacrops)(单倍型多样性0.767,核苷酸多样性0.00007)[44]、光唇裂腹鱼(Schizothoraxlissolabiatus)(单倍型多样性0.733,核苷酸多样性0.0027)[45]等鱼类相比,破碎生境中子陵吻虾虎鱼群体则表现出相对较高的遗传多样性(单倍型多样性0.691~0.881,核苷酸多样性0.0053~0.0060)(表1)。因此可以有效说明,在珠江上游南盘江的破碎化生境中,子陵吻虾虎鱼群体的遗传多样性仍保持较高水平。一般而言,生境破碎化会导致物种种群遗传多样性降低,特别是在受遗传漂变和近亲繁殖影响的小而孤立的群体中[5]。但也有前期研究表明,并非所有破碎化生境均会对物种的遗传多样性产生负面影响,一方面,生境破碎化程度、碎片化栖息地的类型和质量等外在因素对物种遗传多样性的影响不可忽略,遗传多样性的高低可能与不同的水文状况和栖息地可用性有关,另一方面,物种的生态特征(如动物迁移能力、种群大小、生命周期长短)也决定其在应对栖息地的破碎中维持遗传变异的能力[46-48]。已有研究证实[5,49],由于两栖动物和爬行动物相较于鸟类迁移能力差,对环境变化的敏感度较高,因此其遗传多样性可能更易受到生境破碎化的负面影响,对于破碎生境中的同一个分类群而言,体型较大的物种由于需要更多的生存空间而造成其自身种群密度降低、有效种群规模变小,最终导致遗传多样性丧失。本试验中,子陵吻虾虎鱼凭借世代较短、个体较小、缺乏天敌及繁殖生存能力较强(累计产卵可达1000~1600 枚)等特点,从而能不断补充和稳定自身的有效种群数量(图3)[22-23,50],虽受到破碎生境的隔离,但足够数量的个体促进了种群内的基因交流,并抵消了生境破碎化带来的遗传漂变、近亲繁殖等消极影响,继而保持了其自身较高的遗传多样性水平[51]。此外,由于破碎化会增加各生境间的差异,这种差异可能会促进破碎生境中大而孤立的子陵吻虾虎鱼种群产生更多的适应性变异而维持物种的生态适应性[52],同时种内的基因交流可以为促进新的有益突变的传播提供便利,而相对稳定的水库生境和适宜栖息地为核苷酸突变的积累创造了条件[51,53-54]。
3.2 子陵吻虾虎鱼的遗传结构
在本试验中,已得到子陵吻虾虎鱼种群间具有显著的遗传结构和遗传分化的证据。首先,基于不同遗传标记构建的系统发育树和单倍型网络图均支持子陵吻虾虎鱼分化为2个谱系分支,但并未出现明显的地理聚类现象(图1~3)。其次,子陵吻虾虎鱼的种群间遗传距离分析、分子变异方差分析及遗传分化系数均有效证实,该物种在南盘江破碎生境中呈现出显著的种群遗传结构与高水平的遗传分化(表2~4)。同时,Tajima′sD和Fu′sFs中性检验及核苷酸错配分布检验结果说明,子陵吻虾虎鱼群体保持了其相对稳定的有效种群数量,并未经历历史种群扩张(图4)。Mantel相关性检验则显示,种群间遗传距离与地理距离之间缺乏显著相关性(R=0.1874,P>0.05),说明子陵吻虾虎鱼种群间显著的谱系分化并未产生明显的地理距离隔离效应,即该物种的分化格局未呈现出典型的地理性遗传分化。据前期相关研究表明,长江中下游不同地理种群鳜鱼[55]以及长江、珠江等不同水系中的野生鲇鱼(Silurusasotus)[56]群体均存在着类似显著的谱系分化格局,其主要原因在于生境中长期存在一定的人为障碍,如修筑的水坝、管道、涵洞、堰、堤坝,改变的水流状态和水污染等因素,阻断了鱼类种群间的基因交流,加之不稳定的栖息生境,进而造成了较为显著的种群遗传分化[57]。据Stebbins等[58-59]的观点,遗传分化系数值高于0.25则表明种群间的遗传分化很强烈,且高遗传分化系数值通常出现在种群间基因流受限的孤立湖泊或河流栖息地的物种中,且淡水物种的种群遗传结构极易受其扩散能力和河网隔离的限制而产生分化。本试验中,子陵吻虾虎鱼的所有种群样本均来自于相互隔离的南盘江上游水库生境,而各生境均有人为修筑的大坝、稳定的水文条件与较理想的适宜环境,这种特定的隔离生境特征可能提供了其种群数量稳定和遗传突变积累的条件,继而维持了该物种群体较高的遗传多样性水平和有效历史种群大小。同时,该物种分化出2个谱系分支,但其种群并未呈现出因地理距离的远近而发生聚类现象,而其群体也并未经历因地质演化和历史环境变化发生的种群暴增事件,继而可以说明历史事件产生的地理距离隔离作用可能并不是导致子陵吻虾虎鱼谱系分化的主要原因。然而,基于分子变异方差分析的子陵吻虾虎鱼种群间遗传变异达到总变异组分的65%~68%,且种群间的平均遗传分化系数值达到0.65~0.68,综合说明该物种呈现出的显著遗传分化主要源于各种群间较大的遗传差异,从而有效证实了南盘江破碎化生境导致的种群间分歧可能为该物种显著的遗传结构和较高的遗传分化水平的重要原因。其次,作为一种小型淡水底栖鱼类,子陵吻虾虎鱼具有体型小、世代周期短、繁殖和适应能力强、迁移能力弱和生存领域性等生物学特性,其特殊的生理生活特征可能限制了该物种的扩散分布与种群间的基因交流,加大了种群间的遗传分化水平[60]。根据已有的相关研究可知,体型小、扩散能力弱、生命周期短的红鳍原鲌(Cultrichthyserythropterus)由于受到了长江沿岸湖泊的隔离作用出现了显著的遗传差异,而经济效益低、分布广泛、繁殖能力强的圆鳍雅罗鱼(Squaliuscephalus)也受到了莱茵河流域中众多水力发电站的影响而出现了显著的遗传分化,据此Wang等[61-63]提出,相对于运动能力较强的大型鱼类而言,活动能力较弱的鱼类(例如一些小型底栖鱼类)更易受破碎化生境的隔离效应的影响。与此同时,生境破碎化隔离作用产生了多样的稳定生境,子陵吻虾虎鱼拥有的较小体型、高繁殖力,以及护卵孵化、攻击性和适应生境能力强的特点,恰好为其提高生态位竞争能力、有效种群大小、稳定的种群数量和遗传多样性提供了条件,最终可能使得分布于各隔离生境中的子陵吻虾虎鱼产生了对其各自特定栖息地的生态适应性[52,60]。因此,子陵吻虾虎鱼自身特定的繁殖习性与生活习性同样可能成为导致其在破碎生境中出现显著遗传结构和较高遗传分化水平的重要因素。
3.3 破碎生境中鱼类资源的保护
本试验中发现,南盘江破碎化生境中子陵吻虾虎鱼具有较高的遗传多样性和显著的种群遗传分化,而生境的破碎化与子陵吻虾虎鱼特定的生物学特性成为种群谱系分化的重要影响因素。长期以来,珠江鱼类在维持水体生物多样性、提供鱼类种质资源和重要基因库等方面发挥着重要作用[14],但近年来珠江流域上修建的大量水利工程,造成南盘江等流域出现不同程度的河流生境破碎化现象,这将严重威胁到鱼类的物种多样性和遗传多样性[15,48,64]。不仅如此,珠江中也不乏分布着一些珍稀濒危土著种,如大头鲤(Cyprinuspellegrini)、无眼金线鲃(Sinocyclocheilusanophthalmus)、云南高原鳅(Triplophysayunnanensis)等,与子陵吻虾虎鱼不同,此类群鱼类多为洞穴鱼类,分布范围窄,种群数量少,必须通过物种的不断迁移或增加遗传变异的方式来提高种群应对多变环境的适应能力,而生境的破碎化则限制了这两个过程。对于这些极易受到生境破碎化威胁的小而孤立的类群而言,同种内其他种群基因流的补充可以迅速增加遗传多样性并提高种群的适应性[65]。因此,评估种群隔离后的遗传多样性水平和遗传漂变强度有助于制定有效的保护策略。笔者建议未来应加强生境破碎化对珠江鱼类遗传多样影响的研究,同时在扩大时间和空间的研究尺度上科学评估水利工程的建设同珠江鱼类物种多样性之间的关系,继而为整个珠江鱼类的保护提供切实可行的方法和策略。
致 谢
本试验受云南省高校云贵高原动植物多样性及生态适应性进化重点实验室的资助,在此予以感谢!
