基于网络药理学的茵陈五苓散防治肝纤维化机制研究
2020-11-18王铮孙明瑜
王铮 孙明瑜
摘要 目的:通过网络药理学方法探索茵陈五苓散防治肝纤维化的作用机制。方法:通过TCMSP数据库检索茵陈五苓散的主要活性成分;通过检索CTD数据库选肝纤维化的疾病靶点;匹配药物-疾病靶点,应用Cytoscape软件构建中药-成分-靶点网络;运用STRING软件构建蛋白质互作用(PPI)网络,并将结果可视化;使用DAVID数据库进行GO功能富集分析和KEGG通路分析。结果:获取茵陈五苓散防治肝纤维化主要活性成分46个,作用靶点84个;网络数据表明,茵陈的活性成分具有最大的总度值;GO功能富集分析和KEGG通路分析获取GO条目35个,信号通路14条。结论:茵陈五苓散可能是通过Fc epsilon RI等信号通路调控IL6、TNF与PTGS2等靶点减轻炎性反应并减少细胞外基质沉积发挥抗肝纤维化作用的,而中药茵陈与活性成分槲皮素可能在这之中发挥主要作用。
关键词 网络药理学;茵陈五苓散;肝纤维化;经方;中医药
Abstract Objective:To explore the mechanism of Yinchen Wuling Powder on liver fibrosis based on network pharmacology. Methods:The main active ingredients of Yinchen Wuling Powder was searched through TCMSP database. The disease target of liver fibrosis was searched by the CTD database; the drug-disease target was matched, Cytoscape software was used to build a traditional Chinese medicine-component-target network; STRING software was used to build a protein interaction (PPI) network, and the results were visualized; DAVID database was used perform GO function enrichment analysis and KEGG pathway analysis. Results:A total of 46 main ingredients and 84 targets of Yinchen Wuling Powder were obtained; network data indicated that active compounds of Herba Artemisiae Scopariae had the highest degree in total; and there were 35 GO terms and 14 signaling pathways in the GO and KEGG pathway analysis. Conclusion:Yinchen Wuling Powder may regulate IL6, TNF, PTGS2, etc. via pathways like Fc epsilon RI signaling pathway to reduce extracellular matrix deposition having an anti-liver fibrosis effect, and Chinese medicine Herba Artemisiae Scopariae and the active ingredient quercetin may play a major role.
Keywords Network pharmacology; Yinchen Wuling Powder; Liver fibrosis; Classical prescription; Traditional Chinese medicine
中图分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.19.003
持续的肝损伤会导致肝内胶原沉积,形成肝纤维化[1]。肝纤维化是肝硬化、肝癌等诸多重大肝病的必经病理过程[2]。然而,目前临床上尚无注册适应证为肝纤维化的特异性药物[3]。但中医药在肝纤维化防治方面体现出独特优势。研究表明,经方茵陈五苓散能够改善大鼠肝纤维化模型的肝功能以及肝组织病理[4]。茵陈五苓散出自东汉张仲景所著《金匮要略》,由茵陈与五苓散(泽泻、茯苓、猪苓、白术与桂枝)组成,常用于治療湿重于热型黄疸。因此,本文拟从网络药理学角度入手,探究茵陈五苓散防治肝纤维化的具体作用机制。
1 材料与方法
1.1 茵陈五苓散主要活性成分的筛选及作用靶点的确定 本研究通过检索Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)数据库获取茵陈五苓散所有化学成分,并依照数据库推荐方法,以口服生物利用度(Oral bioavailability,OB)≥30%&类药性(Drug-likeness,DL)≥0.18作为筛选标准进行筛选,得到主要活性成分[5-7]。然后,通过PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库绘制主要活性成分的三维结构。最后,将三维结构输入SwissTargetPrediction(http://www.swisstargetprediction.ch/)软件,通过其二维或三维结构相似性预测主要活性成分靶点[8]。
1.2 肝纤维化疾病靶点收集 通过以主题词“Fibrosis,Liver”检索Comparative Toxicogenomics Database(CTD,http://ctdbase.org/),获取目前已知的肝纤维化靶点列表[9]。
1.3 茵陈五苓散与肝纤维化靶点匹配及蛋白互作用网络构建 将茵陈五苓散作用靶点与肝纤维化靶点逐一进行匹配,绘制Venn图,获取茵陈五苓散防治肝纤维化靶点列表。然后,将该列表各靶点输入STRING v11(https://string-db.org/)软件,将Organism参数设置为“homo sapiens”,构建蛋白互作用(Protein-protein Interactions,PPI)网络,并将该网络导入Cytoscape v3.8.0软件进行绘图[10-11]。
1.4 中药-成分-靶点网络构建 逐一匹配中药-成分-靶点关系,并将列表导入Cytoscape软件构建网络,进行绘图,确定网络节点、边、度值等参数。
1.5 GO分析与KEGG通路分析 将靶点列表输入Database for Annotation,Visualization and Integrated Discovery v6.8(DAVID,https://david.ncifcrf.gov/)数据库,进行基因本体学(Gene Ontology,GO)与Kyoto Encyclopedia of Genes and Genomes(KEGG)通路富集分析[12-13]。
2 结果
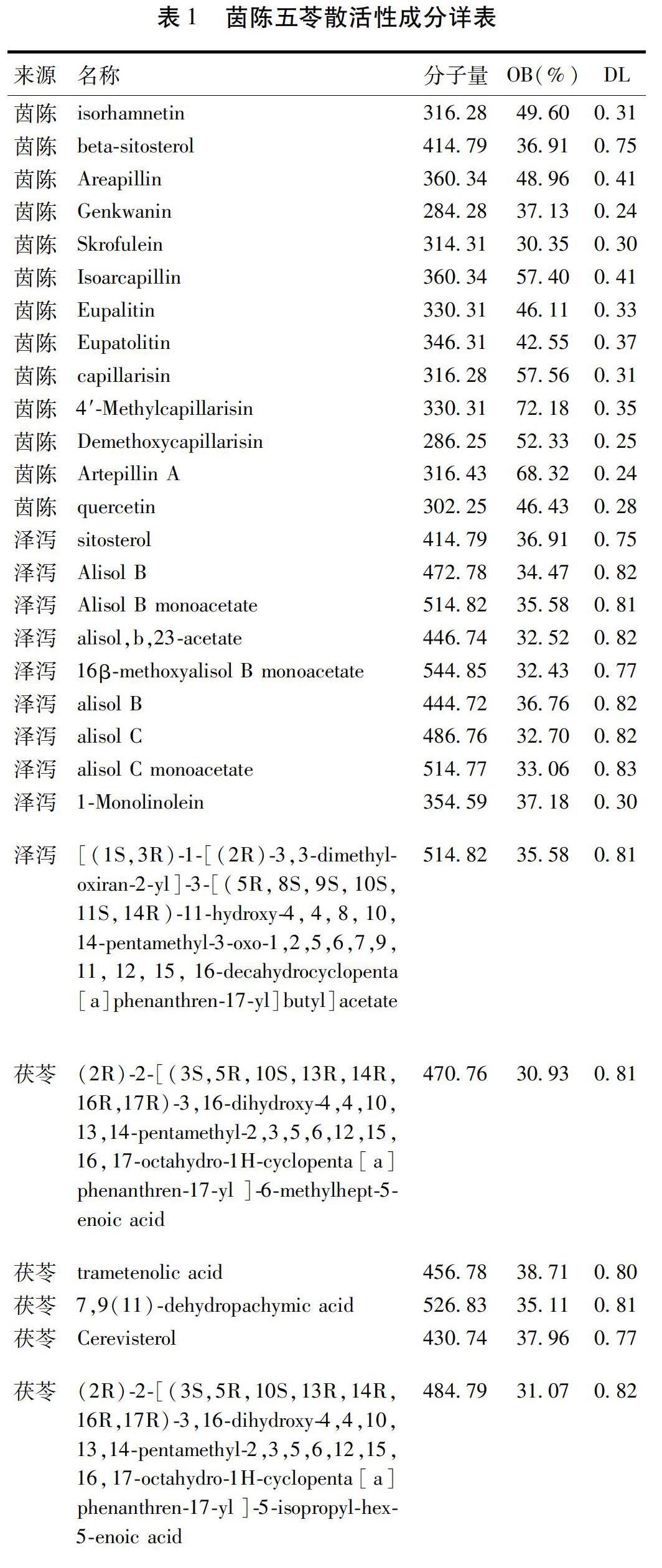
2.1 茵陈五苓散主要活性成分的筛选及作用靶点 本研究通过检索TCMSP数据库并进行筛选后,共获取茵陈五苓散活性成分46个,茵陈含有其中14个,泽泻含有8个,茯苓含有15个,猪苓含有10个,桂枝含有7个,白术含有7个,存在2种中药共有相同成分的情况。见表1。经过二维与三维结构比对,预测茵陈五苓散存在药物靶点共521个。
2.2 肝纤维化的疾病靶点筛选 在CTD数据库中共检索到肝纤维化相关靶点共1 029个。去重后,共得到955个肝纤维化相关靶点。
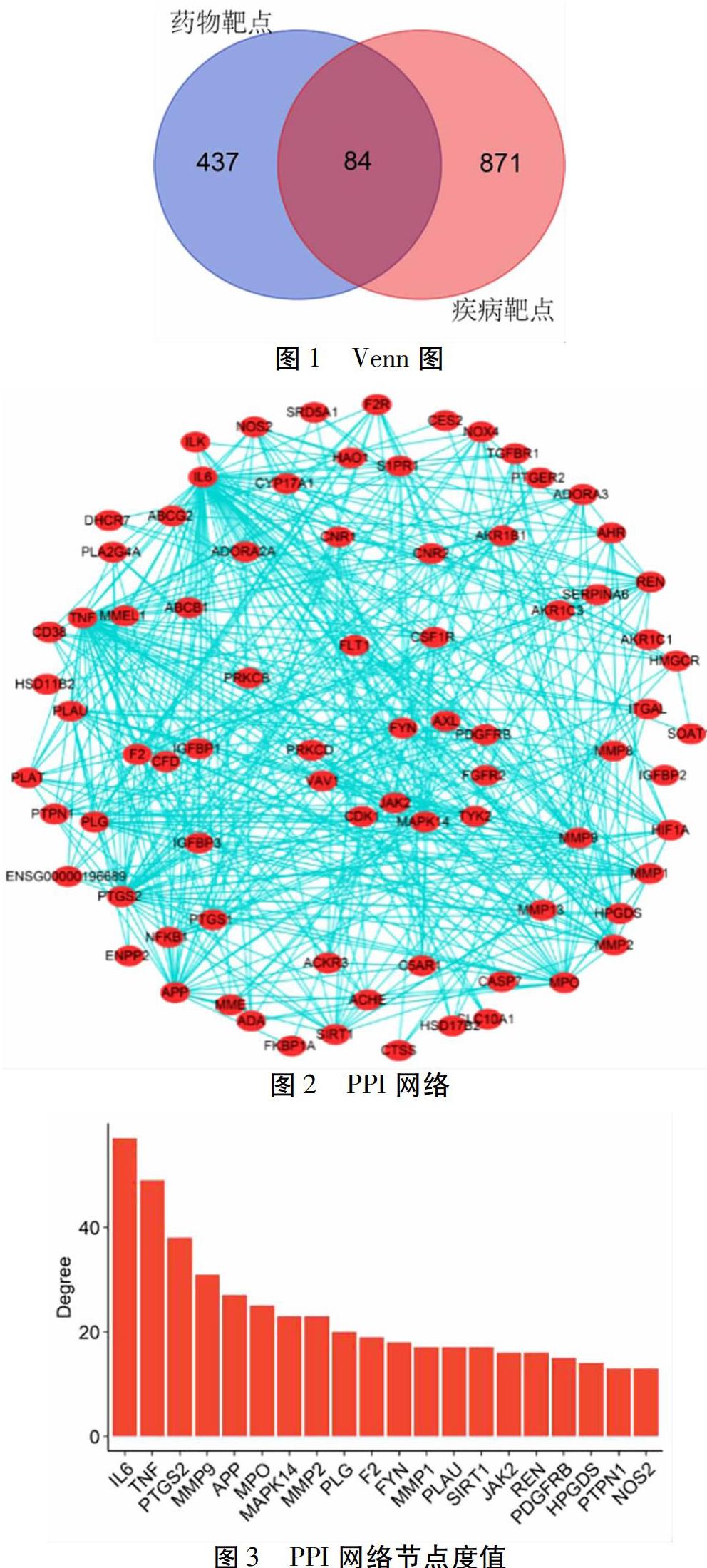
2.3 共同靶点筛选及互作网络构建 通过绘制Venn图,获取茵陈五苓散与肝纤维化交集靶点84个。见图1。然后,对此84个靶点构建PPI网络。见图2。此网络中,每个节点代表一个靶点,每条边代表一项靶点间互作用关系。此外,度值最高的3个节点分别为IL6(度值57)、TNF(度值49)与PTGS2(度值38)。见图3。度值能够表示一个节点在其所在网络的重要性。
2.4 中药-成分-靶点网络 对茵陈五苓散组成中药、所含主要活性成分与对应靶点进行网络构筑。见图4。其中紫色节点代表茵陈五苓散组成中药,红色节点代表主要活性成分,蓝色节点代表对应靶点。此网络中度值最高的3个主要活性成分分别为Cerevisterin(啤酒甾醇,度值34)、Ergosterol Peroxide(过氧麦角甾醇,度值30)与6-demethoxycapillarisin(6-去甲氧基茵陈色原酮,度值25);度值最高的3个对应靶点分别为PTPN1(度值35),CYP17A1(度值31)与HMGCR(度值28)。见图5。此外,计算表明,在茵陈五苓散中,茵陈的活性成分具有最高的总度值。同时,在各个中药的活性成分中,Quercetin(槲皮素)与重要靶点对接次数最多。
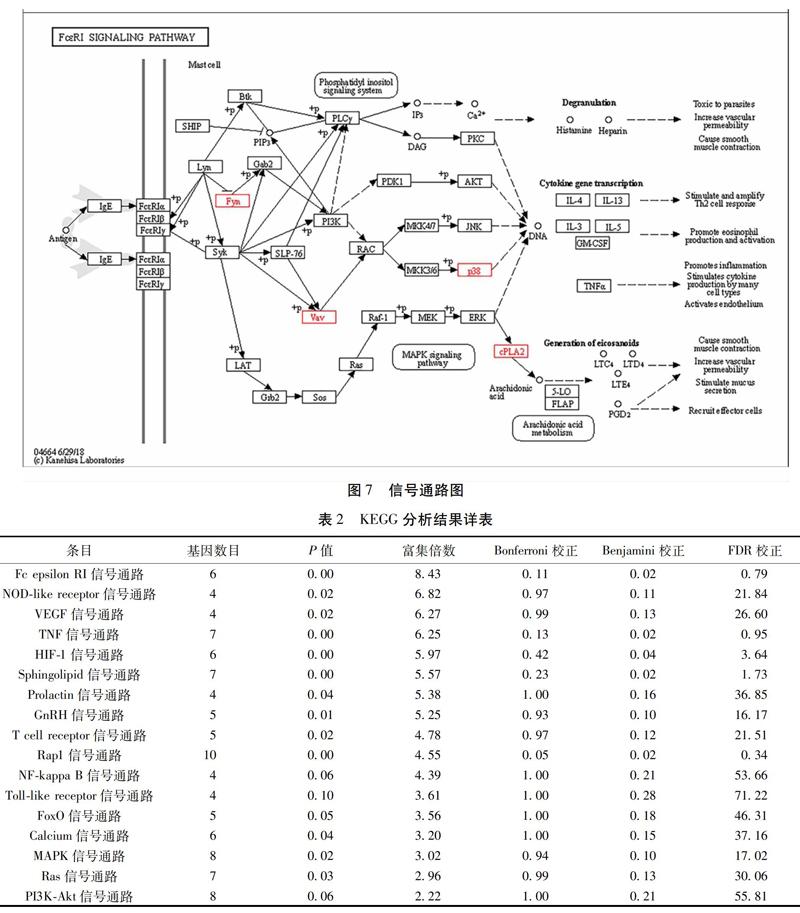
2.5 GO分析与KEGG通路分析 应用DAVID v6.8进行GO与KEGG通路富集分析,并进行可视化。GO分析获取GO条目35个,其中生物过程(Biological Process,BP)的主要条目为蛋白质水解(Proteolysis)、氧化还原过程(Oxidation-reduction Process)、炎性反应(Inflammatory Response)等,细胞组分(Cellular Component,CC)的主要条目为浆膜(Plasma Membrane)、细胞外外泌体(Extracellular Exosome)、细胞外间隙(Extracellular Space)等,分子功能(Molecular Function)的主要条目为受体结合(Receptor Binding)、酶结合(Enzyme Binding)、丝氨酸类型内肽酶活性(Serine-type Endopeptidase Activity)等。见图6A。KEGG通路分析获取信号转导通路14条,主要信号通路为Fc epsilon RI信号通路、TNF信号通路、Sphingolipid信号通路、Rap1信号通路等。见图6B、图7,表2。
3 讨论
现代研究表明,茵陈五苓散能够保肝利胆、降血脂与抗动脉粥样硬化,同时也具有抗过敏、抗炎、镇痛,在肝炎、高血脂与痛风性关节炎等作用[14]。此外,也有研究表明茵陈五苓散具有抗肝纤维化潛力[4]。因此,本文通过网络药理学方法对其抗肝纤维化的可能机制进行了探索。
中药复方成分复杂。本研究通过数据库筛选已发现的茵陈五苓散成分,获取易于人体利用的成分46个。在后续的实验中,相继发现这些成分的作用靶点521个,以及潜在的抗肝纤维化靶点84个。
在PPI分析中,重要的靶点有IL-6、TNF与PTGS2等。IL(interleukin,白细胞介素)-6是一种重要的细胞因子,能够调控细胞的增殖、分化与特异性基因的表达,并且在肝纤维化中发挥重要作用[15]。IL-6通过Fas通路促进肝星状细胞的活化,导致细胞外基质过度沉积,加重肝纤维化程度[16]。TNF(tumor necrosis factor,肿瘤坏死因子)-α是巨噬细胞等免疫细胞分泌的多效性细胞因子,能够促进炎性反应的发生发展[17]。而炎性反应的存在会导致过度的肝再生,分泌过剩的细胞外基质,从而加重肝纤维化。PTGS2,其编码蛋白COX(cyclooxygenase,环氧化酶)-2属于诱导型酶,在受到各种刺激的情况下才会发生诱导表达。而COX-2抑制剂能够通过抑制这个途径参与炎性反应、细胞增殖、血管增生等纤维化相关生理病理过程[18]。因此,茵陈五苓散可能是通过调节对应靶点改善肝脏炎性反应以发挥其抗纤维化效果的。
值得注意的是,在茵陳五苓散中,茵陈的活性成分具有最高的总度值,这提示在此方剂中,茵陈可能发挥主要作用。茵陈本身具有显著抗肝纤维化作用,其能够改善大鼠血清丙二醛与肝羟脯氨酸水平[19]。此外,茵陈具有良好的抗炎作用,其能够抑制COX-2活性,组织巨噬细胞产生活性氧。也有研究表明,茵陈也能通过下调TLR4抑制NF-κB信号通路,从而发挥其抗炎作用[19]。同时,与关键靶点对接次数最多的活性成分为槲皮素。既往研究发现,槲皮素能够通过调节TGF-β1/Smads与PI3K/Akt通路抑制肝星状细胞激活并减少其自噬作用发挥抗肝纤维化作用[20]。此外,槲皮素在多种纤维化疾病中均有一定防治作用[21-23]。
GO分析也表明,茵陈五苓散靶点与炎性反应、细胞外外泌体、细胞外间隙、受体结合等条目相关。乙醇、肝炎病毒等对肝脏造成损伤后,肝脏会启动名为肝再生的损伤修复[1]。这一过程中,活化的肝星状细胞会分泌细胞外基质以修复受损的肝脏。若病因持续存在,细胞外基质则会分泌过剩,造成胶原沉积,引起肝纤维化[24-25]。因此GO分析结果能够在一定程度上验证茵陈五苓散防治肝纤维化的有效性,并较为明确地指出了其具体作用环节与位置。
KEGG通路分析结果提示茵陈五苓散防治肝纤维化作用机制与Fc epsilon RI信号通路相关。茵陈五苓散可能参与调控该通路中Fyn、Vav、p38、cPLA2等节点。这一通路参与调控IL-3、4、5、13等多种细胞因子,并与花生四烯酸代谢、MAPK信号通路等密切相关,而这些细胞因子与通路均在肝纤维化以及相关炎性反应中发挥重要作用[26-28]。
综上所述,茵陈五苓散具有防治肝纤维化的潜力,其具体机制可能是通过减轻肝脏炎性反应并减少细胞外基质分泌从而发挥其抗纤维化作用。其中发挥主要防治作用的中药与活性成分可能为茵陈与槲皮素。
本文采用网络药理学方法,初步探索了茵陈五苓散防治肝纤维化的有效活性成分、关键靶点、作用机制及可能通路。结果显示,茵陈五苓散可能通过Fc epsilon RI等信号通路调控IL-6、TNF与PTGS2等靶点,减轻炎性反应并减少细胞外基质分泌发挥其抗肝纤维化作用,提示茵陈五苓散具有作为防治肝纤维化药物的潜力。而在茵陈五苓散中,中药茵陈以及活性成分槲皮素可能发挥主要作用,因此,槲皮素有望以单体的形式成为肝纤维化的防治药物。本文研究结果具有局限性,需要动物及临床试验验证其有效性与可靠性。
参考文献
[1]Cordero-Espinoza L,Huch M.The balancing act of the liver:tissue regeneration versus fibrosis[J].J Clin Invest,2018,128(1):85-96.
[2]Trautwein C,Friedman SL,Schuppan D,et al.Hepatic fibrosis:Concept to treatment[J].J Hepatol,2015,62(1):S15-24.
[3]中国中西医结合学会肝病专业委员会.肝纤维化中西医结合诊疗指南(2019年版)[J].现代医药卫生,2019,35(15):2424-2432.
[4]边艳琴,宁冰冰,曹红燕,等.经典退黄三方抗二甲基亚硝胺诱导的大鼠肝纤维化的方证比较研究[J].中西医结合学报,2012,10(12):1405-1412.
[5]Ru J,Li P,Wang J,et al.TCMSP:a database of systems pharmacology for drug discovery from herbal medicines[J].J Cheminform,2014,6:13.
[6]Xu X,Zhang W,Huang C,et al.A novel chemometric method for the prediction of human oral bioavailability[J].Int J Mol Sci,2012,13(6):6964-6982.
[7]Tao W,Xu X,Wang X,et al.Network pharmacology-based prediction of the active ingredients and potential targets of Chinese herbal Radix Curcumae formula for application to cardiovascular disease[J].J Ethnopharmacol,2013,145(1):1-10.
[8]Daina A,Michielin O,Zoete V.SwissTargetPrediction:updated data and new features for efficient prediction of protein targets of small molecules[J].Nucleic Acids Res,2019,47(W1):W357-W364.
[9]Davis AP,Grondin CJ,Johnson RJ,et al.The Comparative Toxicogenomics Database:update 2019[J].Nucleic Acids Res,2019,47(D1):D948-D954.
[10]Szklarczyk D,Gable AL,Lyon D,et al.STRING v11:protein-protein association networks with increased coverage,supporting functional discovery in genome-wide experimental datasets[J].Nucleic Acids Res,2019,47(D1):D607-D613.
[11]Shannon P,Markiel A,Ozier O,et al.Cytoscape:a software environment for integrated models of biomolecular interaction networks[J].Genome Res,2003,13(11):2498-2504.
[12]Huang da W,Sherman BT,Lempicki RA.Bioinformatics enrichment tools:paths toward the comprehensive functional analysis of large gene lists[J].Nucleic Acids Res,2009,37(1):1-13.
[13]Huang da W,Sherman BT,Lempicki RA.Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J].Nat Protoc,2009,4(1):44-57.
[14]蔡小蓉,杨建云,肖炳坤,等.茵陈五苓散的药理及临床研究进展[J].中国临床药理学杂志,2017,33(9):857-860.
[15]Hashimoto N.Rabeprazole is effective for bile reflux oesophagitis after total gastrectomy in a rat model[J].World J Gastrointest Pathophysiol,2015,6(1):23-28.
[16]Yildirim CH,Yucetas SC,Kaya M,et al.Alpha-lipoic acid inhibits peridural fibrosis following laminectomy through the inactivation of TGF-β1,PDGF,PAI-1 and IL-6 expressions[J].Turk Neurosurg,2015,25(1):90-99.
[17]Roh YS,Cho A,Cha YS,et al.Lactobacillus Aggravate Bile Duct Ligation-Induced Liver Inflammation and Fibrosis in Mice[J].Toxicol Res,2018,34(3):241-247.
[18]胡辉,荆绪斌,邹细岩,等.环氧化酶2及其抑制剂代他考昔在小鼠肝纤维化中的作用[J].中华医学杂志,2014,94(10):784-787.
[19]Han JM,Kim HG,Choi MK,et al.Artemisia capillaris extract protects against bile duct ligation-induced liver fibrosis in rats[J].Exp Toxicol Pathol,2013,65(6):837-844.
[20]Wu L,Zhang Q,Mo W,et al.Quercetin prevents hepatic fibrosis by inhibiting hepatic stellate cell activation and reducing autophagy via the TGF-β1/Smads and PI3K/Akt pathways[J].Sci Rep,2017,7(1):9289.
[21]Hohmann MS,Habiel DM,Coelho AL,et al.Quercetin Enhances Ligand-induced Apoptosis in Senescent Idiopathic Pulmonary Fibrosis Fibroblasts and Reduces Lung Fibrosis In Vivo[J].Am J Respir Cell Mol Biol,2019,60(1):28-40.
[22]Zhang X,Cai Y,Zhang W,et al.Quercetin ameliorates pulmonary fibrosis by inhibiting SphK1/S1P signaling[J].Biochem Cell Biol,2018,96(6):742-751.
[23]Lu H,Wu L,Liu L,et al.Quercetin ameliorates kidney injury and fibrosis by modulating M1/M2 macrophage polarization[J].Biochem Pharmacol,2018,154:203-212.
[24]Eming SA,Martin P,Tomic-Canic M.Wound repair and regeneration:mechanisms,signaling,and translation[J].Sci Transl Med,2014,6(265):265sr6.
[25]Bhattacharyya S,Wei J,Varga J.Understanding fibrosis in systemic sclerosis:shifting paradigms,emerging opportunities[J].Nat Rev Rheumatol,2011,8(1):42-54.
[26]曹紅燕,边艳琴,武超,等.基于方证相关探讨茵陈蒿汤调控库普弗细胞功能及MAPK通路抗肝纤维化的作用机制[J].世界中医药,2015,10(2):162-168,173.
[27]Dougan M,Dranoff G,Dougan SK.GM-CSF,IL-3,and IL-5 Family of Cytokines:Regulators of Inflammation[J].Immunity,2019,50(4):796-811.
[28]McCormick SM,Heller NM.Commentary:IL-4 and IL-13 receptors and signaling[J].Cytokine,2015,75(1):38-50.
(2020-09-10收稿 责任编辑:王明)
