扶正化瘀方体外给药方法及生物活性差异的探讨
2020-11-18薛静波陶艳艳刘成海
薛静波 陶艳艳 刘成海

摘要 目的:建立扶正化瘀方体外给药方法,观察不同批次间药效差异,为中药复方生物活性的质控奠定基础。方法:选择人肝细胞L-02、小鼠单核巨噬细胞RAW264.7和小鼠原代骨髓来源巨噬细胞(Bone Marrow-derived Macrophage,BMDM),分别建立肝细胞过氧化损伤模型和巨噬细胞活化模型,首先通过考察溶媒、作用浓度等因素对细胞效应的影响,基于扶正化瘀体外给药的最佳保肝抗炎效果,建立扶正化瘀浸膏體外配置给药方法;再比较不同批次的扶正化瘀浸膏对肝细胞损伤和巨噬细胞活化药效差异。结果:扶正化瘀浸膏以二甲基亚枫溶解不过滤,不同批次扶正化瘀的化学指标成分不同,但在细胞生物活性总体无显著性差异,其中批号171005与其他批次的部分生物活性略有不同。结论:确立了扶正化瘀方体外给药方法,发现其化学成分质控与细胞生物活性不一致。
关键词 中药质量控制;生物活性;扶正化瘀方;抗肝纤维化;体外给药
Abstract Objective:To establish in-vitro administration method for Fuzheng Huayu(FZHY) and further to observe the medicinal effect differences of different batches, which will be fundermental for establishment of Traditional Chinese Medicine(TCM) bioactivity-based quality control. Methods:Human hepatocyte cell L-02, mouse leukemia cell of monocyte macrophage Raw264.7, mouse bone marrow-derived macrophage (BMDM) were selected to establish hepatocyte peroxidation injury model and macrophage activation model. Firstly, by investigating the influence of factors such as solvent, concentration and other factors on cellular effects, based on the best hepatoprotective and anti-inflammatory effects of Fuzheng Huayu in vitro medicine, an in vitro drug delivery method for Fuzheng Huayu extract was established; the effect of Fuzheng Huayu extract on liver cell damage and macrophage activation was different. Results:Fuzheng Huayu extract was dissolved in dimethyl sulfoxide and was not filtered. The chemical index components of different batches of Fuzheng Huayu are different, but there is no significant difference in overall cell biological activity. Among them, the biological activity of batch number 171005 was slightly less than that of other batches and was a little different. Conclusion:Hereby, standard in-vitro FZHY administration method was established. We found chemical component-based quality control is not consisted with its cellular bioactivity.
Keywords Traditional Chinese medicine quality control; Bioactivity; Fuzheng Huayu Formula; Anti hepatic fibrosis; In-vitro administration medicine
中图分类号:R285.5;R283文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.19.002
中药质量可控是保证中药安全有效的重要基础。目前最常用最重要的中药质控方法基于化学成分分析。虽然其对于保障中药质量、提高中药稳定性发挥了重要作用,但仍存在一定局限性。一方面,中药制剂的效应成分不够明确,经常选用的含量高、容易检测的成分进行检测,但这些指标性成分不一定是药效成分;另一方面,许多适应证不同的中药采用相同的含量测定指标,难以真正反映中药制剂的质量。尤其对于复方中成药,由于其含有多种活性成分且具有多种药理作用,仅仅控制少数化学成分并不能完全控制其质量并反映临床疗效[1]。不同批次复方中药间的药效差异也不能完全由化学质控成分差异来解释。因此建立标准化的中药配置给药方法,然后探索基于生物活性评价的敏感可重复的质量控制新方法,迫在眉睫[2-3]。本文聚焦抗肝纤维化中药扶正化瘀片,它具有良好的临床效果及多靶点效应[4-6],在此我们选择其保护肝细胞过氧化损伤与凋亡[7-10]以及对巨噬细胞的消炎作用[11-12],想基于其细胞生物活性确定体外标准给药法。
1 材料与方法
1.1 材料
1.1.1 动物 C57BL/6小鼠,雄性,SPF级,采购至北京维通利华实验技术有限公司,许可证号:SCXK(京)2016-0006,饲养于上海中医药大学动物实验中心,温度18~22 ℃,湿度55%~65%,以12 h/12 h为光暗周期饲养,动物均自由饮食,伦理编号为PZSHUTCM200814020。人肝細胞(L-02),小鼠单核巨噬细胞(RAW264.7),小鼠成纤维细胞(L929)均购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所;小鼠骨髓来源原代巨噬细胞(BMDM)分离自C57BL/6小鼠,详见方法。
1.1.2 药物 5批次扶正化瘀浸膏粉,均来自上海黄海制药,批号分别为180206、180207、180208、181118和171005,各批次成分质控数据如下。见表1。
1.1.3 试剂与仪器 Dulbecco′s modification of Eagle′s Medium(DMEM)高糖培养基(货号:12800017);1640培养基(货号:31800022);Endothelial Cell Medium(MEM)培养基(货号:11090-081);Glutamax(货号:35050061),Sodium Pyruvate(货号:11360070),Non-essential Amino Acids(货号:11140050),以上均购于Invitrogen公司,美国。马血清(Gibco公司,美国,货号:26050-070)。LDH试剂盒(货号:A020-1-2);ALT试剂盒(货号:A009-1-1);AST试剂盒(货号:A010-1-1),以上均购于南京建成生物工程研究所。Cell Counting Kit-8(CCK8)试剂盒(MCE公司,美国,货号:HY-K0301);JC-1荧光探针(Invitrogen公司,美国,货号:T3168);离心机(Thermo公司,美国,型号:Biofuge Primo R);微孔板分光光度计(Bio-Tek公司,美国,型号:Bio-Tek PowerWave XS);电子天平(Sartorius公司,德国,型号:BSA224S-CW);倒置显微镜(Olympus公司,日本,型号:IX70)。
1.2方法
1.2.1 分组与模型制备
1.2.1.1 肝细胞过氧化损伤模型 将L-02细胞以10 000个/孔接种于96孔板,培养24 h,无血清饥饿6 h后,予0.5 mmol/L H2O2刺激0.5 h诱导肝细胞损伤模型。
1.2.1.2 巨噬细胞LPS促炎模型 将RAW264.7细胞以5 000个/孔接种于96孔板,培养24 h,无血清饥饿6 h后,予100 ng/mL LPS持续刺激24 h,诱导细胞炎性反应模型。
1.2.2 给药方法
1.2.2.1 扶正化瘀浸膏粉的配置方法 称取扶正化瘀浸膏粉,分别用DMSO与DMEM震荡溶解,予40 kHz、37 ℃超声后,各配制成100 mg/mL的扶正化瘀储存液。各取一半溶液用0.45 μm PTFE膜过滤,一半不予过滤。最终配置成4组储存液,分别是DMSO溶液、DMSO过滤溶液、DMEM溶液和DMEM过滤溶液。各储存液分装置于-20 ℃冰箱保存。
1.2.2.2 BMDM细胞分离 取8~10周龄小鼠股骨和胫骨,用1 mL针管吸取ECM培养基冲洗骨髓,500×g 4 ℃离心5 min,吸弃上清,加入2 mL红细胞裂解液裂解2 min,再加入8 mL含血清培养基后500×g 4 ℃离心5 min,70 μm滤网过滤后,加入含20% L929上清液和10%FBS的DMEM培养基,培养4 d后换液,然后继续培养至7 d待用。
1.2.2.4 细胞培养 Raw264.7细胞培养于含10%FBS的DMEM培养基;L-02细胞培养于含10%FBS的1640培养基;L929细胞培养于含10%马血清,1%Glutamax,1% Sodium Pyruvate与1% Non-essential Amino Acids的MEM培养基。BMDM细胞培养于含20% L929细胞上清液,10%FBS的DMEM培养基。所有细胞均置于37 ℃、5% CO2、95%湿度的CO2培养箱中培养,待细胞长至亚单层后用于实验。将各细胞以适宜的浓度接种于96孔板中,培养于相应的培养基中。
1.2.3 检测指标与方法
1.2.3.1 pH值测定 用pH计对4组扶正化瘀溶液进行pH值的测定,并用零度渗透压测试仪对其进行渗透压的测定。
1.2.3.2 采用LC-MS方法检测扶正化瘀DMEM和DMSO溶液的主要成分 选用甲醇作为标准溶剂对照。称取0.75 mg扶正化瘀浸膏粉,加入甲醇震荡超声后定溶到25 mL后,配置成浓度为50 μg/mL的标准对照溶液。吸取4 μL扶正化瘀DMSO及DMEM 100 mg/mL储存溶液,分别加入20 mL乙腈稀释,配置成浓度为20 μg/mL样品溶液。吸取对照品溶液10 mL,样品溶液20 mL注入液相色谱仪进行梯度洗脱,得到总离子流色谱图,分别计算各峰对应总峰面积的相对百分含量,以对照品的峰面积为标准,分别计算各组分的含量。
1.2.3.3 细胞增殖与毒性 将L-02和RAW264.7细胞分别以5 000个/孔和10 000个/孔接种于96孔板,培养24 h。无血清饥饿6 h后,分别加入浓度为50、100、200、400、800 μg/mL的扶正化瘀不同溶剂过滤各组工作液,每个浓度均设4个复孔,设正常对照组,细胞与药物连续共孵育,以20、24和48 h为动态观察点,吸弃上清,按照CCK8原液:培养基=1∶10的比例混合,100 μL/孔,在37 ℃孵育2 h,读取A450值,检测细胞活力,观察最大无毒浓度。
1.2.3.4 肝细胞过氧化损伤模型生化测定以及线粒体膜电位测定 将L-02诱导肝细胞损伤模型后(详见1.2.1.1),与25、50、100、200 μg/mL扶正化瘀各组工作液孵育18 h,每个浓度均设4个复孔。设正常对照组,模型组,不同浓度扶正化瘀组。CCK8试剂盒检测细胞活力;留取细胞上清,用生化试剂盒分别检测上清中的ALT、AST和LDH含量。另用无血清培养基清洗细胞2次,加入2.5 μg/mL工作浓度的JC-1,在37 ℃孵育30 min,PBS洗涤3次,5 min/次,荧光显微镜下529 nm和590 nm波长进行观察。
1.2.3.5 巨噬细胞促炎模型一氧化氮NO、肿瘤坏死因子TNF-α含量测定 将RAW264.7细胞以LPS诱导炎性反应模型(详见1.2.1.2),并同时给予扶正化瘀工作液连续孵育24 h,每个浓度均设4个复孔。CCK8试剂盒检测细胞活力;留取细胞上清。按1∶1配置1%磺胺与0.1%N-1-萘基乙二胺盐酸混合液,再与细胞上清1∶1混合,根据NaNO2标准曲线,在540 nm波长下测定吸光度来确定一氧化氮含量。将BMDM细胞以30 000个/孔接种于96孔板,培养24 h,予100 ng/mL LPS持续刺激24 h,诱导细胞炎性反应模型。同时给予扶正化瘀工作液连续孵育24 h,每个浓度均设4个复孔。CCK8试剂盒检测细胞存活率;留取细胞上清,ELISA试剂盒测定细胞上清TNF-α含量。96孔板中一抗200 μL 4 ℃孵育过夜,去掉上清后用>250 μL PBS-T溶液洗涤3次,加入封闭液室温孵育1 h后用PBS-T溶液洗涤1次。分别加入100 μL细胞上清及标准品,4 ℃孵育过夜。次日用PBS-T溶液洗涤3~5次后,加入100 μL二抗室温孵育1 h。PBS-T溶液洗涤3~5次后,加入100 μL Avidin-HRP予室温孵育30 min,再次用PBS-T溶液洗涤5~7次,加入100 μLTMB显色试剂予室温孵育15 min,最后加入50 μL终止液,读取A540值。
1.3 统计学方法 采用SPSS 18.0统计软件进行数据处理,GraphPad Prism 6.0软件作图。计量资料以“均数±标准差”表示,组间差别采用单因素方差分析,2组间比较采用Turkey检验,以P<0.05为差异有统计学意义。
2 结果
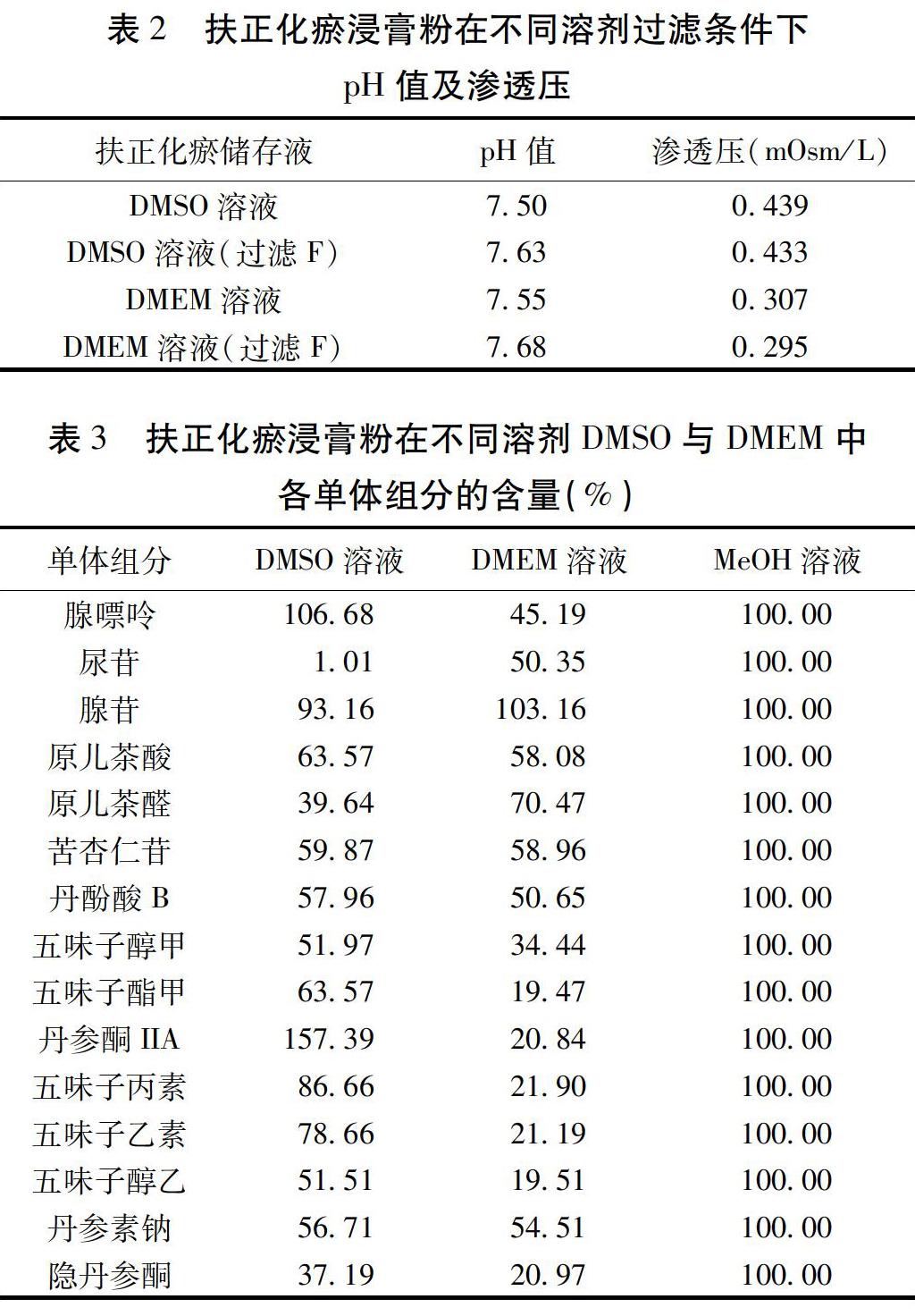
2.1 基于扶正化瘀浸膏粉不同配置方法的物理、化学性质 扶正化瘀浸膏粉以不同溶剂(DMSO、DMEM)、再选择过滤不过滤,比较各组在理化性质方面的差异。实验可见,4组溶液均溶解差异无统计学意义,并且物理性质pH值、渗透压上没有显著区别。见表2。但是DMEM與DMSO溶液的某些组分含量差异有统计学意义,譬如腺嘌呤、尿苷、原儿茶醛、五味子酯甲、丹参酮IIA、五味子乙素、五味子丙素和五味子醇乙。见表3。
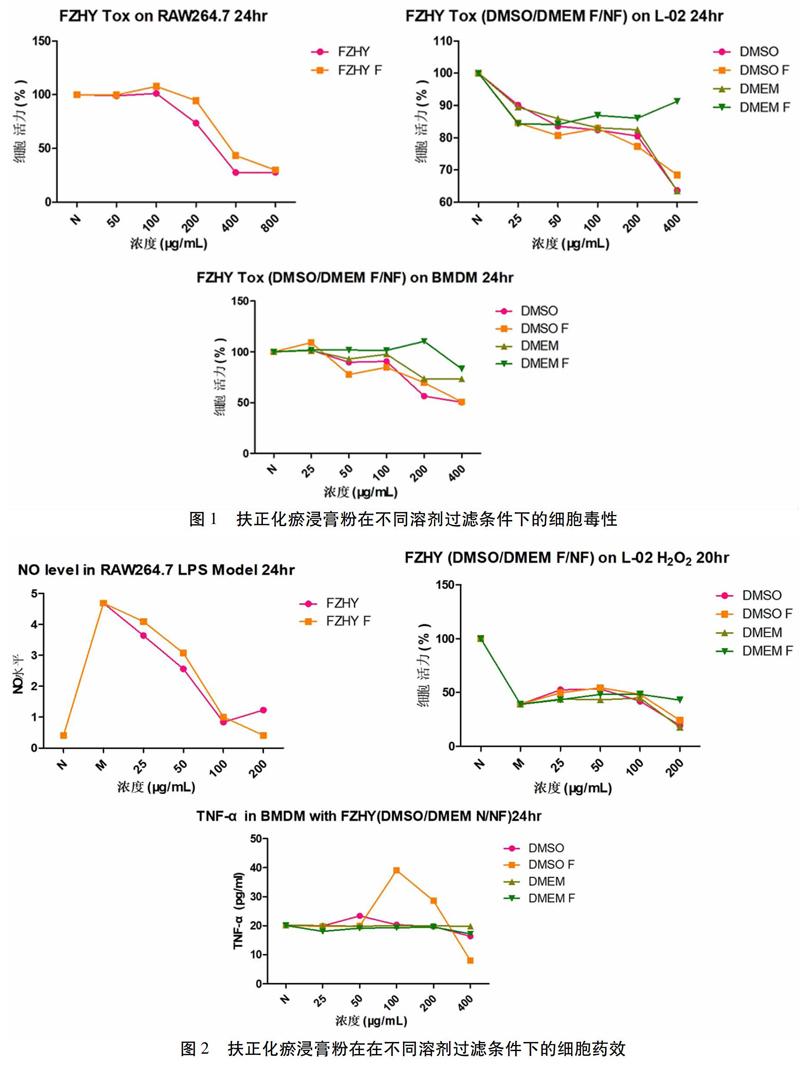
2.2 基于扶正化瘀浸膏粉不同配置方法的生物活性 在L-02、RAW264.7、BMDM细胞中,各扶正化瘀溶液组的细胞毒性均没有明显差异,在400、800 μg/mL高浓度时,对细胞可能具有潜在毒性。见图1。同样,在L-02细胞过氧化损伤模型、RAW264.7和BMDM细胞LPS炎性反应模型中,各扶正化瘀溶液组的生物活性差异无统计学意义。见图2。由于上述各组在物理、化学、生物活性上差异无统计学意义,而DMSO溶液比DMEM溶液更稳定,而且细菌在DMSO内无法存活,更适合长久保存,我们最终选取扶正化瘀浸膏粉DMSO溶液不过滤作为标准配置方法,储存液浓度为100 mg/mL,分装置于-20 ℃冰箱中保存。
2.3 扶正化瘀标准体外给药法在肝细胞及巨噬细胞中的药效 将-20 ℃保存的100 mg/mL扶正化瘀储存液置于室温解冻,配置成工作浓度。实验可见,在RAW264.7细胞LPS模型中,扶正化瘀能显著降低一氧化氮(NO)的产生,并促进细胞增殖。见图3。同样在BMDM细胞LPS模型中,扶正化瘀能明显减少细胞肿瘤坏死因子(TNF-α)的表达,且呈剂量依赖关系。见图3。在的L-02细胞过氧化损伤模型中,扶正化瘀不但能恢复损伤肝细胞的数量,并能显著降低细胞上清中ALT、AST与LDH的含量,呈剂量依赖关系。见图4。同时荧光可见,不同浓度的扶正化瘀也能剂量依赖地提高肝细胞的线粒体膜电位。见图5。
2.4 不同批次的扶正化瘀浸膏粉在肝细胞及巨噬细胞中的药效 将不同批次的-20 ℃保存的100 mg/mL扶正化瘀储存液(批号分别为180206、180207、180208、181118和171005)置于室温解冻,配置成工作浓度。根据厂方质量控制数据可见,虽然5批次扶正化瘀浸膏粉在厂家质控的3个标志物的含量有所差异,但对肝细胞过氧化损伤均能产生保护作用,并均能降低细胞上清中ALT和AST的含量,不同批次间差异无统计学意义。见图6。在小鼠单核巨噬细胞RAW264.7与小鼠原代骨髓来源巨噬细胞BMDM中,各批次扶正化瘀均能明显降低LPS模型中TNF-α与的NO的表达,各批次间差异无统计学意义。见图7、图8。然而在BMDM与浸膏粉单独孵育时,比较其他批次,批次171005浸膏粉对TNF-α的表达的影响较弱。见图8。由以上结果可见,扶正化瘀的化学成分质控并不能与其细胞药效直接相关,因此建立以生物活性为基础的复方中药质量控制体系作为传统化学质控的补充是大势所趋。
3 讨论
扶正化瘀方由六味中药组成,临床效果好,复方中成药成分复杂,机制多样[13-15]。在本实验中比较了扶正化瘀浸膏粉在不同溶媒、不同过滤条件下,物理、化学、生物性质的差异,发现扶正化瘀在水中溶解度很差,在DMSO及DMEM,有无过滤组中,pH值、渗透压、主要成分含量、细胞毒性以及细胞药效上没有显著却别。因而从中选择了最稳定的配置方法,即用DMSO溶解不过滤,基本确立可行、稳定的扶正化瘀浸膏粉配置方法。然后在肝细胞及巨噬细胞中确认了药效,确立了标准的体外给药方法。然而在不同批次的扶正化瘀浸膏粉之间,虽然在化学指标性成分上有所差异,但是总体在细胞药效上差异无统计学意义。因此仅仅依赖化学成分检测作为中药质量控制是远远不够的,后续批次间产生差异的各靶标基因将被重点关注,并以此建立以生物活性为基础的质控新方法。
另外,肝星状细胞的活化与肝窦内皮细胞的血管增生也是扶正化瘀抗肝纤维化的机制[16-18]。后期将会针对扶正化瘀在肝星状细胞及肝窦内皮细胞上进行药效评估,与肝细胞、肝巨噬细胞一起找出各细胞上最敏感、稳定的药效靶点,然后构建含有靶点的稳转细胞株来进行药效评估,并予动物模型中进行验证,从而成功建立扶正化瘀的生物活性质量控制体系。
参考文献
[1]薛静波,彭渊,刘洪亮,等.基于关键细胞信号转导效应靶标建立抗肝纤维化中药的生物活性评价与质量控制新方法[J].世界科学技术-中医药现代化,2020,22(4):1213-1218.
[2]罗国安,王义明,曹进,等.建立我国现代中药质量标准体系的研究[J].世界科学技术-中药现代化,2002,4(4):5-11.
[3]游云,廖福龙,黄璐琦.基于生物活性测定开展中药质量控制的研究进展[J].中国中药杂志,2018,43(3):452-456.
[4]Seki E,Schwabe RF.Hepatic inflammation and fibrosis:functional links and key pathways[J].Hepatology,2015,61(3):1066-1079.
[5]Liu P,Hu YY,Liu C,et al.Multicenter clinical study on Fuzhenghuayu capsule against liver fibrosis due to chronic hepatitis B[J].World J Gastroenterol,2005,11(19):2892-2899.
[6]Hassanein T,Box TD,Tong MJ,et al.A phase II,randomized,placebo-controlled,double-blind,multicenter study to assess the antifibrotic activity of Fuzheng Huayu in chronic hepatitis C patients with hepatic fibrosis[J].Hepatol Int,2014,8:S308-S309.
[7]胡义扬,刘成,刘平,等.扶正化瘀方抗CCl4大鼠肝纤维化作用与抗脂质过氧化[J].新消化病学杂志,1997,5(8):485-486.
[8]刘成海,陈文慧,刘平,等.二甲基亚硝胺致大鼠脂质过氧化变化与药物干预作用[J].中華肝脏病杂志,2001,9(ZK):18-20.
[9]周滔,闫秀川,陈倩,等.扶正化瘀方对实验性急性肝损伤肝细胞凋亡的影响[J].药品评价,2008,5(5):204-208.
[10]Tao Yanyan,Yan Xiuchun,Zhou Tao,Shen Li,Liu Zulong,Liu Chenghai.; Fuzheng Huayu recipe alleviates hepatic fibrosis via inhibiting TNF-α induced hepatocyte apoptosis[J].BMC Complementary and Alternative Medicine,2014,14:449.
[11]张满,胡旭东,黄恺,等.扶正化瘀方对脂多糖诱导的RAW264.7巨噬细胞M1型炎性极化JNK通路的影响[J].中国中医药信息杂志,2020,27(3):43-47.
[12]Peng Y,Huang K,Shen L,et al.Cultured Mycelium Cordyceps sinensis alleviates CCl4-induced liver inflammation and fibrosis in mice by activating hepatic natural killer cells[J].Acta Pharmacol Sin,2016,37(2):204-216.
[13]Lee YA,Wallace MC,Friedman SL.Pathobiology of liver fibrosis:a translational success story[J].Gut,2015,64(5):830-841.
[14]Trautwein C,Friedman SL,Schuppan D,et al.Hepatic fibrosis:Concept to treatment[J].J Hepatol,2015,62(1):S15-24.
[15]Liu C,Hu Y,Xu L,et al.Effect of Fuzheng Huayu formula and its actions against liver fibrosis[J].Chin Med,2009,4:12.
[16]姜春萌,刘成海,刘成.扶正化瘀胶囊对肝星状细胞激活的干预[J].中国中西医结合消化杂志,2003,11(5):280-283.
[17]王清兰,陶艳艳,沈丽,等.扶正化瘀方影响转化生长因子β1/Smad信号通路的抗肝纤维化作用机制[J].中西医结合学报,2012,10(5):561-568.
[18]Zhao Zhimin,Liu Hongliang,Sun Xin,et al.Levistilide A inhibits angiogenesis in liver fibrosis via vascular endothelial growth factor signaling pathway[J].Experimental Biology and Medicine,2017,242(9):974-985.
(2020-09-10收稿 责任编辑:王明)
